全脑辐照致神经损伤大鼠神经化学物质类生物标志物的筛选
2021-11-09孟宪双白桦马强张鹏马宏邓玉林
孟宪双, 白桦, 马强, 张鹏, 马宏, 邓玉林
(1. 北京理工大学 生命学院,北京 100081;2. 中国检验检疫科学研究院,北京 100176)
执行空间飞行任务的宇航员面临空间辐射带来的潜在危害[1-3],尤其当宇航员执行出舱作业时,其头面部防护的相对薄弱增加了受到空间辐射的风险[4-5],辐射对发育早期神经细胞分裂行为的干扰,将导致神经系统结构及功能的异常[6-8];此外,放射治疗是头颈部原发及转移肿瘤的重要治疗方法,然而在接受放射治疗后,往往会导致患者严重的并发症-放射性脑损伤[9]. 随着社会经济和医疗技术的发展,肿瘤发病率和确诊率逐年增加,同时随着各种放疗技术的临床应用以及先进影像等技术的使用,头颈部病灶的发现率也在增大,因此,近几年放射性脑损伤的确诊率在总体呈上升趋势. 根据时程和临床表现,辐射诱导的脑损伤分为急性、早期迟发和晚期迟发性损伤[10],急性症状一般是短暂且可逆的,而晚期迟发性症状是进行性且不可逆转的,因此,评估生物机体辐照后早期的特异反应,系统研究机体内早期出现的代谢物变化情况,对于降低辐射暴露后早期可能造成的伤害和改善治疗策略是非常有必要的,同时也可为进一步理解和阐述辐射损伤的分子机理提供实验依据.
本实验室在全脑辐照诱导的神经损伤变化规律及由神经损伤诱导的外周免疫系统间接效应等方面进行了系统研究并形成了一系列研究成果[11-13]. 前期研究成功建立了大鼠全脑辐照诱导神经损伤的动物模型,并采用影像学手段和蛋白表达水平分析等技术对动物模型机体内的蛋白质,如各种细胞因子,进行了表达分析,阐述了不同脑区的敏感性差异及其机理. 本文重点探究全脑辐照诱导的神经损伤发生后,外周血中神经化学物质含量的变化情况,以期寻找潜在的生物标志物. 针对外周血中42种神经化学物质,作者基于超高效液相色谱-串联四极杆复合线性离子阱技术建立了靶向测定方法[14]. 鉴于多数神经化学物质在反相色谱中保留效果差、质谱响应强度低的特点,采用苯甲酰氯进行衍生化,经衍生化后的待测物色谱保留好,灵敏度高. 由于待测物均为血清内源性小分子化合物,实验采用磷酸缓冲盐溶液+牛血清白蛋白作为空白血清模拟液进行质量控制样本和标准工作曲线溶液的配制,然后按照确定的方法处理,经衍生化后的物质采用内标法定量,未衍生化的乙酰胆碱和褪黑素采用外标法定量,检出限和定量下限分别为0.05~11.63 nM和0.09~46.50 nM,灵敏度高,能够满足血清中42种神经化学物质的分析要求;采用蛋白沉淀法,样本与蛋白沉淀剂体积比例为1∶4,针对6种不同种类的溶剂/溶液进行了沉淀剂的考察,选择0.1%甲酸-乙腈体系作为蛋白沉淀剂. 方法特异性好,灵敏度高,标准工作曲线在各自线性范围内线性良好(线性相关系数R2>0.99),仪器精密度、提取回收率、基质效应、准确度、日内及日间精密度、稳定性、稀释效应及残留效应均满足生物样本的分析需求.
本研究利用上述已建立的靶向分析方法,采用靶向代谢组学策略,通过单维和多维统计学分析,研究全脑辐照暴露下神经损伤大鼠的血清样本与健康血清样本间的代谢轮廓差异,寻找显著性差异代谢物,发现全脑辐照暴露下神经损伤的潜在生物标志物,并映射机体内相关的代谢通路,探索全脑辐照诱导神经损伤可能的发生机制,为早期诊断和改善治疗策略提供理论基础和科学依据.
1 实验方法
1.1 仪器、材料与试剂
超高效液相色谱仪(UHPLC,美国SCIEX公司,ExionLC型,配二元泵、在线真空脱气机、自动进样器和柱温箱);串联四极杆复合线性离子阱质谱仪(QTrap,美国SCIEX公司,6500+型);涡旋振荡器(德国IKA公司,MS2型);超声仪(深圳市方奥微电子有限公司;YM-080S型);超低温保存箱(中国海尔公司,DW-86L626型);超纯水仪(美国Millipore公司,MILLI-Q50型).
42种神经化学物质标准品,包括α-丙氨酸、天冬酰胺、天冬氨酸、β-丙氨酸、半胱氨酸、谷胱甘肽、甘氨酸、亮氨酸、赖氨酸、甲硫氨酸、鸟氨酸、苯丙氨酸、腐胺、丝氨酸、亚精胺、精胺、苏氨酸、缬氨酸、3,4-二羟苯乙酸、γ-氨基丁酸、5-羟基吲哚乙酸、乙酰胆碱、精氨酸、多巴胺、谷氨酰胺、组胺、组氨酸、高香草酸、犬尿氨酸、去甲肾上腺素、5-羟色胺、色胺、色氨酸、酪胺、酪氨酸、左旋多巴胺、5-羟基色氨酸、谷氨酸、肾上腺素、褪黑素、章鱼胺、香草扁桃酸购自美国Sigma-Aldrich公司、德国Dr.Ehrestorfer公司和美国AccuStandard公司;LC-MS级甲醇、乙腈和甲酸购自美国Fisher公司.
1.2 实验动物
健康雄性SD大鼠,5~6周龄,SPF级,γ射线辐照前200~250 g,购自斯贝福(北京)生物技术有限公司,合格证号:SCXK(京)2016-0002. 全部动物程序均经北京理工大学动物研究委员会批准,按照《实验动物的护理和使用指南》进行饲养. 大鼠饲料由北京科奥协力饲料有限公司提供,合格证号:SCXK(京)2016-0002;饲养条件:北京理工大学SPF级动物房,屏障环境,合格证号:SYXK(京)2017-0031;大鼠为独立隔离饲养笼具饲养,室内环境控制:温度20~26 ℃,湿度40%~70%,噪音不超过60 dm(A),氨浓度不超过14 mg/m3,自然光照,每天12 h,辐照前,所有大鼠使用标准饲料和纯净水进行喂养(自由饮水进食).
1.3 γ射线全脑辐照实验
辐照部位为从眼球后援至枕骨前缘. γ射线辐照前,将大鼠用3%(质量分数)的戊巴比妥钠溶液进行腹腔注射麻醉(剂量为0.3 mL/100 g体重). 将大鼠标记好号码并竖直悬挂进行体位固定,使用铅砖将自颈部下半身屏蔽,室温条件下对脑部进行辐照.60Co γ射线源距为1 m,一次性辐照,辐照剂量为10、20、30、40和50 Gy,剂量率为2.519 4 Gy/min. 其中,分次累积全脑辐照采用每周进行10 Gy剂量辐照,共3次(总剂量为30 Gy)的方式进行. 因60Co γ射线在定位照射方面存在一定难度,本实验通过铅砖屏蔽95%以上射线,因此,可用来模拟脑局部辐照. 辐照后的实验大鼠被运送回至北京理工大学生命学院动物房,继续以标准维持饲料和纯净水喂养,直至处死.
1.4 氧化应激指标的测定
每组大鼠(8只)在辐照30天后,用3%(质量分数)的戊巴比妥钠溶液进行腹腔注射麻醉(剂量为0.3 mL/100 g体重)取脑组织,称取180 mg置于匀浆管,加入4 ℃预冷0.9%生理盐水,将脑组织剪碎进行匀浆处理(冰上操作),3 000 r/min离心15 min,收集上清液,为避免反复冻融可进行分装,置于-20 ℃条件下保存备用,分别进行氧化应激损伤相关指标丙二醛(MDA)、谷胱甘肽(GSH)和8-羟基脱氧鸟苷(8-OHdG)含量的测定. 电离辐射对机体的损伤主要通过间接作用,作用于机体内的大分子,使其发生电离作用,产生自由基. 自由基作为机体代谢的中间产物,一方面与超氧化物歧化酶(SOD)作用,导致其酶活性下降,另一方面它还可攻击脂质、蛋白质和DNA等,使得脂质过氧化物水平升高,造成组织细胞受损. MDA是脂质过氧化的终产物,其含量高低可作为反映机体氧化损伤的间接指标;谷胱甘肽有还原型(GSH)和氧化型(L-Glutathione oxidized,GSSG)两种形式,在生理条件下以还原型谷胱甘肽占绝大多数. 当辐照诱导机体内产生自由基时,GSH因参与自由基的清除和过氧化物的解毒而被消耗生成GSSG;8-羟基脱氧鸟苷是敏感的DNA损伤标志物,其生成原因主要包括电离辐射、化学致癌物以及细胞新陈代谢过程中产生的大量ROS攻击DNA中鸟嘌呤生成8-羟基脱氧鸟苷.

1.5 血清采集
将全部大鼠称重并以戊巴比妥钠以腹腔注射(60 mg/kg体重)进行麻醉;待麻醉后约20 min,将大鼠以仰卧位固定于木板上,用环形钳夹住大鼠颈部及左右腹股沟,环形钳手柄套固定于铁钉,大鼠即固定好;打开胸腔,将心脏暴露,进行心尖取血. 取完血后将血置于灭菌的离心管中,室温下凝固1~2 h(如凝血效果不好,可放置4 ℃冰箱过夜,使血液充分凝固),待凝固后,4 ℃条件下3 500 r/min离心10 min,吸取上清液,分装并标记好,置于-80 ℃黑暗条件下保存,用于神经化学物质的分析测定.
关于血清样本处理、空白血清模拟液的配制及色谱-质谱方法见文献[14].
1.6 原始数据预处理
采用R软件进行数据预处理. 当信号接近背景时,会增加分析误差,基于这些数据的结论是可疑的,在进一步分析前消除这些噪声;对单个色谱峰进行过滤筛选,每个组别中只保留空值不超过50%或所有组别中空值不多于50%的色谱峰数据;对原始数据中的缺失值进行模拟(missing value recording),缺失值模拟方法为最小值1/2进行填补.
1.7 统计学分析
单变量统计分析的计算结果以“平均值±标准方差”表示,并采用独立样本t检验(Student'st-test),当p<0.05,认为在统计学上具有显著性差异,当p<0.01时,认为具有极显著性差异,不同组别之间神经化学物质的浓度比较采用倍数变化(fold change,FC)值表示. 进行多变量统计学分析时,将处理后的LC-MS/MS数据导入至SIMCA-P软件(Version 15.0.2,Umetrics AB,Umea,Sweden)进行多元变量模式识别分析. 首先采用无师监督的主成分分析(principal component analysis,PCA)法建立多维统计模型,进行各组样本间整体分布情况及有无离散样本点的考察,并且通过质控样本在PCA中的聚集程度考察该分析批次LC-MS系统的稳定性;然后采用有监督的正交偏最小二乘判别分析(orthogonal partial least square-discriminant analysis,OPLS-DA)法构建模型,以区分不同组别样本以及其中的差异神经化学物质.
2 结果与讨论
2.1 辐射剂量的选择
适宜的辐照剂量是本实验成功与否的关键,因此,结合全脑辐照后氧化应激指标含量的变化情况及实验室前期研究基础. 本实验首先确定辐照剂量. 从表1可以看出,与对照组相比,3个辐照组大鼠脑组织中的丙二醛和8-羟基脱氧鸟苷的浓度均出现升高趋势,其中除10 Gy组与对照组之间丙二醛的差异无显著性差异外,其他的组间差异均具有统计学意义(p<0.05),且其中除20 Gy组与对照组的差异p<0.05外,其他组间差异均具有极显著性差异(p<0.01). 与对照组相比,3个辐照组大鼠脑组织中的还原型谷胱甘肽含量呈下降趋势,且10 Gy、20 Gy、30 Gy、40 Gy、50 Gy与对照组间的差异均具有统计学意义(p<0.05和p<0.01). 这主要是因为电离辐射对机体的损伤主要通过间接作用,作用于机体内的大分子,使其发生电离作用,产生活性氧自由基(ROS). 当体内ROS产生量大于机体可承受的抗氧化能力后,就会使机体产生氧化应激损伤. 因此,3种与氧化应激相关的内源性抗氧化组分的含量变化可间接反映鼠脑经辐照后的受损程度. 本实验在对大鼠进行三个不同剂量的γ射线全脑辐照后,综合大鼠的一般状态、生存率和氧化应激等指标检测结果,旨在达到辐射具有生物学效应的同时,又不至造成实验大鼠基本机能的丧失或死亡,采用10 Gy作为低剂量进行大鼠全脑辐照.

表1 不同辐照剂量下大鼠丙二醛、还原型谷胱甘肽及8-羟基脱氧鸟苷含量的比较Tab.1 Comparison of the concentrations of MDA,GSH,and 8-OHdG of rats irradiated in different
实验前期研究发现[9],在全脑辐照后30 d,30 Gy的γ射线可导致大鼠探索行为及肢体活动能力明显下降,且焦虑和抑郁水平明显上升,指示γ射线全脑辐照对脑功能存在潜在的影响作用;通过18F-FDG micro PET-CT研究大鼠脑内葡萄糖代谢情况,发现30 Gy的剂量可引起海马和皮层(包括顶叶相关皮层、听觉皮层、感觉皮层和运动皮层)中葡萄糖代谢下降. 在辐照后90 d,皮层中葡萄糖代谢已经恢复,但海马中葡萄糖代谢的下降趋势仍较显著. 这不仅说明不同脑区葡萄糖代谢对辐照的敏感性存在差异,而且有着时间上依赖性,表明30 Gy的全脑辐照剂量已造成一定程度的神经损伤,而该辐照剂量对大鼠的存活率又无显著影响,因此,本课题拟选择γ射线的30 Gy作为大鼠全脑辐照模型的最大辐照剂量.
由于在头颈癌的放疗过程中,通常采用分次累积辐照的方式进行,因此本研究拟同样采用分次辐照的模式进行临床模拟. 由于全脑辐照过程中需进行麻醉,若分次次数较多,则平均每次辐照剂量较小,意味着麻醉次数过多,而麻药对神经系统会产生较大的危害作用,因此,为避免反复麻醉,本实验选择单束辐照剂量为10 Gy,共辐照3次. 在辐照中和辐照后,均未发现大鼠的非正常死亡现象.
2.2 单变量统计分析
对神经化学物质的定量结果(每只大鼠测定一次,组内大鼠的结果取平均值)进行t检验,结果如表2所示,计量结果以“平均值±标准差”形式表示,当p<0.05时,认为在统计学上具有显著性差异. 与对照组相比,辐照组(10 Gy、30 Gy和10 Gy×3)中多数神经化学物质的浓度呈下降趋势,且有些物质的浓度下降趋势具有统计学意义(p<0.05),如去甲肾上腺素、γ-氨基丁酸、酪胺、谷氨酸、酪氨酸、色氨酸的浓度显著性下降,而少量神经化学物质浓度呈显著性上升趋势(p<0.05),如乙酰胆碱和褪黑素,浓度变化倍数分别为4.68(30 Gy组/对照组)和10.00(30 Gy组/对照组). 值得注意的是,分次累积辐照组(10 Gy×3)与30 Gy辐照组相比,由于分次累积辐照造成的机体损伤小于单次相同剂量的辐照,因此,10 Gy×3辐照组神经化学物质浓度的变化情况(与对照组相比)没有30 Gy辐照组明显;另外,与对照组相比时,有些神经化学物质的浓度在10 Gy剂量辐照后早期表现为下降,而在30 Gy剂量辐照后(与10 Gy组比较),浓度却表现为不同程度的上升. 实验统计了在10 Gy组与对照组、30 Gy组与10 Gy组以及10 Gy×3组与30 Gy组对比分析中,具有显著性差异(p<0.05)的神经化学物质,包括去甲肾上腺素、乙酰胆碱、γ-氨基丁酸、酪胺、谷氨酸、酪氨酸、色氨酸、褪黑素、α-丙氨酸和甘氨酸. 单变量统计实验结果提示全脑辐照损伤的机理比较复杂,仅用一种代谢物的浓度变化情况很难满足早期损伤诊断的准确度要求. 而结合多变量统计分析则能综合多个变量的差异性信息,在不同组别间的分类中具有单变量分析不可比拟的优势. 因此,本研究将结合多变量分析模型进行对照组与辐照组的分类研究.

表2 对照组和辐照组大鼠血清中神经化学物质的浓度(nmol/L)变化

续表
2.3 多变量统计分析
2.3.1主成分分析
PCA模型中两个主成分的贡献率PC(1)为0.693,PC(2)为0.107,累计贡献率为0.8,表明所选主成分可较真实地反映原变量信息,得分散点图见图1.图中无异常离散样本点,全部处于95%置信区间(Hotelling’s T-squared ellipse)内,对照组血清样本分布比较紧凑,而不同剂量的辐照组分布比较分散;对照组与10 Gy、30 Gy和10 Gy×3辐照组早期的血清样本具有一定的分离趋势,而不同剂量的辐照组不能很好的区分,实验结果表明,PCA模型不能完全区分对照组和不同剂量的辐照组以及分次累积辐照组早期的血清样本. 另外,值得注意的是,在PCA分析中,全体质控样本点均较密集地聚集在象限中央位置附近,表明系统和方法具有良好的稳定性与可靠性.

图1 对照组、辐照组和质控样本血清LC-MS/MS数据的PCA得分散点图Fig.1 PCA score scatter plot of LC-MS/MS data from serum samples of Ctrl group,IR groups,and QC samples
2.3.2正交偏最小二乘-判别分析
OPLS-DA模型的解释率R2Y(cum)为0.717,预测率Q2(cum)为0.276,其得分散点图见图2(a),对照组和三个辐照组的血清样本分离趋势非常明显,表明辐照早期的血清样本中神经化学物质的代谢发生了较为明显的紊乱;而不同剂量的辐照组血样样本仍不能较好区分. 实验结果表明,该OPLS-DA模型对不同实验组的区分程度较低,预测率较低,不能够完全区分不同剂量的辐照组早期血清样本.
因此,鉴于不同剂量的辐照组血清样本不能完全区分,本实验将10 Gy、30 Gy和10 Gy×3辐照组合并组成辐照组建立OPLS-DA模型. 模型的解释率R2Y(cum)为0.892,预测率Q2(cum)为0.833,模型解释率R2Y和预测率Q2都较高,能很好地解释和预测两组样本间的差异. 该模型包括了1个第一主成分的预测成分和2个正交主成分拟合得分散点图见图2(b). 对照组分布比较紧凑,辐照组分部较为分散,表明对照组与辐照组血清早期样本的神经化学物质代谢谱存在差异,可以较好地区分. 对模型采用200次响应置换检验,R2Y值构成的回归线截距为0.39,Q2构成的回归线截距为-1.93,通过随机排序计算所得的R2(cum)和Q2(cum)值小于原始值,表明原模型可很好地解释不同组样本之间的差异. 同时随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降,提示原模型具有良好的稳健性,不存在过拟合现象.
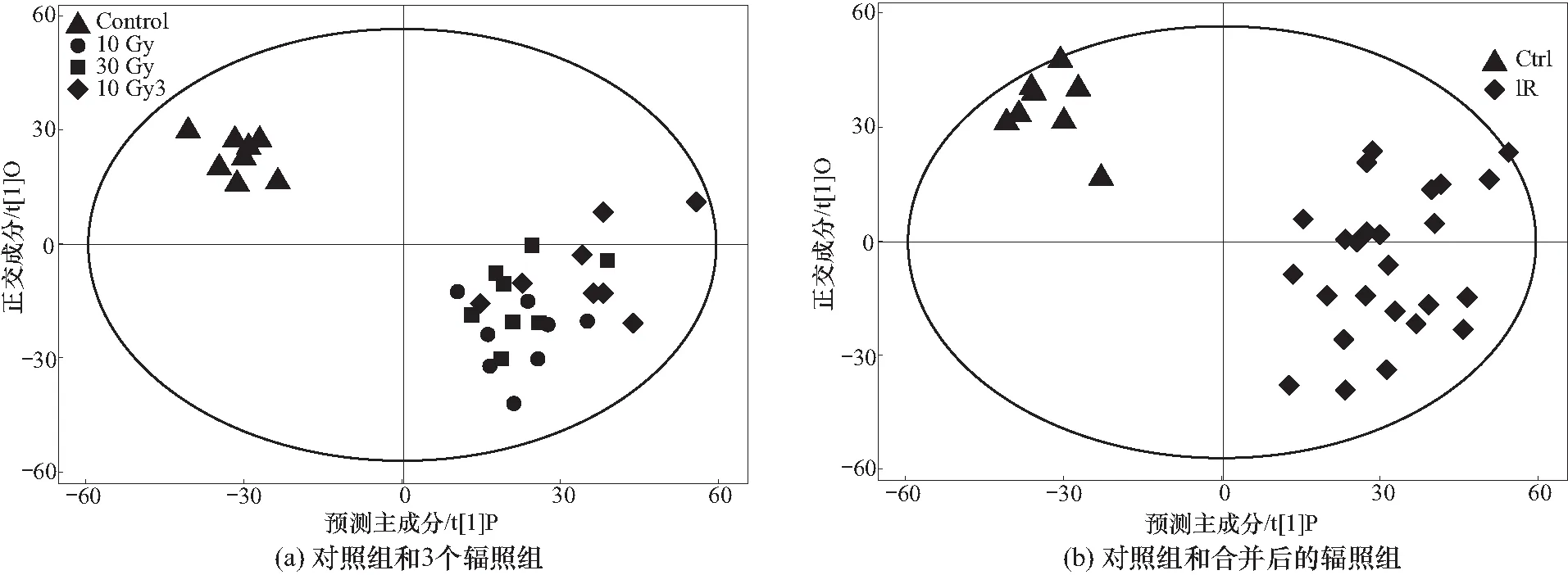
图2 PCA得分散点图Fig.2 PCA score scatter plots
2.4 差异神经化学物质的筛选
采用变量性重要投影(variable importance in the projection,VIP)这一指标进行差异性神经化学物质的筛选. 基于不同辐照组间OPLS-DA模型分析结果,本实验筛选出14个VIP值均大于1.0的重要差异神经化学物质(图3),包括酪胺、谷氨酸、高香草酸、肾上腺素、5-羟吲哚乙酸、半胱氨酸、天冬氨酸、亚精胺、多巴胺、谷胱甘肽、精胺、鸟氨酸、乙酰胆碱、褪黑素,它们都是对OPLS-DA模型中分组贡献较大的变量,同时结合单变量统计分析t-test中的p<0.05. 本实验共筛选到乙酰胆碱、褪黑素、谷氨酸和酪胺4种神经化学物质,它们是指示电离辐射致脑损伤潜在的生物标志物.

图3 血清样本中神经化学物质代谢谱的S形曲线图Fig. 3 S-plot of neurochemicals metabolic profiles in two groups of rat serum samples
2.5 差异性神经化学物质可能的代谢通路
将差异性神经化学物质在KEGG pathway数据库中进行映射,并整理出14个差异性神经化学物质映射的所有代谢通路(图4). 结果表明,健康对照组与辐照组大鼠间的差异神经化学物质总共映射出了34个相关代谢通路,其中5个代谢通路的Impact值大于0.5,是本实验所要研究的重要代谢通路,值得进一步关注. 它们分别是苯丙氨酸、酪氨酸和色氨酸的生物合成(phenylalanine,tyrosine and tryptophan biosynthesis)、丙氨酸、天冬氨酸和谷氨酸代谢(alanine,aspartate and glutamate metabolism)、酪氨酸代谢(tyrosine metabolism)、甘氨酸、丝氨酸和苏氨酸代谢(glycine,serine and threonine metabolism)以及D-谷氨酰胺与D-谷氨酸代谢(D-Glutamine and D-glutamate metabolism)途径. 表明这些代谢途径在全脑辐照过程中受到了扰动,可能是与辐照致神经损伤过程密切相关的代谢通路. 代谢通路富集分析和富集分析的气泡图中,每个气泡代表一个代谢通路,横坐标代表该通路在拓扑分析中的影响因子大小,纵坐标和气泡的颜色代表富集分析的P值,颜色越深,表示P值越小,即富集程度越显著.
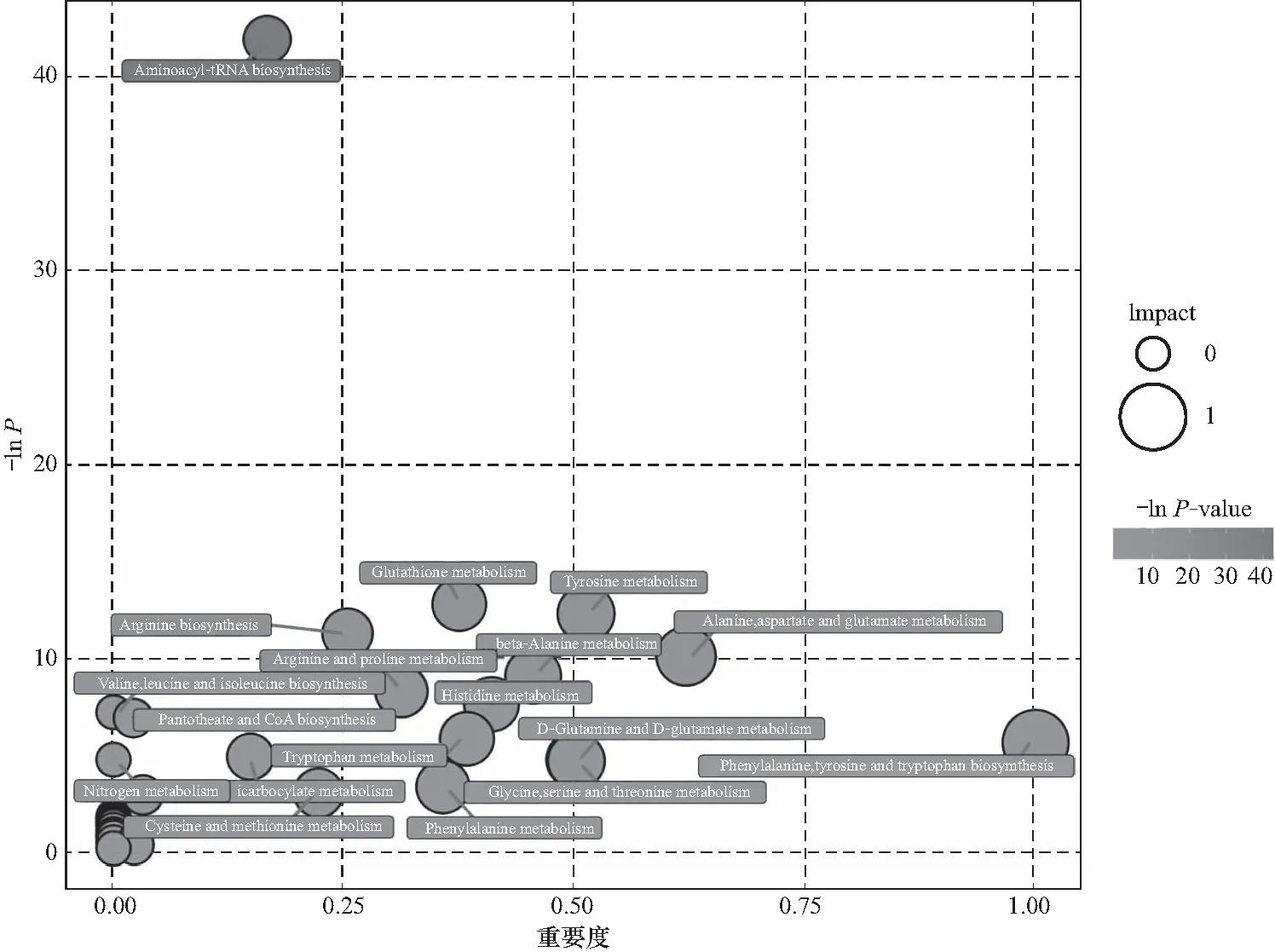
图4 差异性神经化学物质的代谢通路富集分析和拓扑分析气泡图Fig.4 Bubble plot for metabolic pathway enrichment analysis andtopology analysis of the differential neurochemicals
3 结 论
本实验在前期建立的超高效液相色谱-串联质谱分析方法基础上,对60Co γ射线全脑辐照暴露下神经损伤大鼠的血清样本进行了基于靶向代谢组学策略的统计学分析. 血清样本中神经化学物质单变量统计分析表明,全脑辐照大鼠血清中绝大多数神经化学物质随着辐照剂量增大含量降低,其中去甲肾上腺素、乙酰胆碱、γ-氨基丁酸、酪胺、谷氨酸、酪氨酸、色氨酸、褪黑素、α-丙氨酸和甘氨酸在10 Gy、30 Gy及10 Gy×3辐照组中的含量均显著低于对照组血清样本,而3个辐照组中乙酰胆碱和褪黑素的含量均显著高于对照组,表明接受全脑辐照后,血清中的神经化学物质代谢谱发生了紊乱. 另外,通过进行30 Gy和10 Gy×3辐照组的单变量统计分析发现,分次累积辐照较同等剂量单次辐照对神经化学物质造成的扰动程度低,其中具有显著性差异的神经化学物质包括去甲肾上腺素、乙酰胆碱、酪胺、谷氨酸、谷氨酰胺、酪氨酸、色氨酸、褪黑素、α-丙氨酸、甘氨酸和苯丙氨酸. 通过结合多变量统计分析,本实验建立的OPLS-DA模型较好地区分了对照组和辐照组的血清样本,筛选到了VIP>1和p<0.05的4种神经化学物质,即乙酰胆碱、谷氨酸、酪胺和褪黑素,它们是对模型分类贡献较大的变量,可作为全脑辐照诱导神经损伤潜在的生物标志物.
