永存第五对主动脉弓的影像诊断
2021-11-07禹纪红支爱华李楠王恩宁祁晓鸥蒋世良戴汝平吕滨
禹纪红,支爱华,李楠,王恩宁,祁晓鸥,蒋世良,戴汝平,吕滨
永存第五对主动脉弓(persistent fifth aortic arch,PFAA)是一种非常少见的主动脉弓部畸形,是胚胎时期第五对鳃动脉弓未退化、持续存在,形成连接升主动脉和降主动脉或肺动脉干之间的弓状血管结构,常与第四鳃动脉弓发育而来的主动脉弓并存。自1969 年被Van Praagh[1]首次报道以来,全球累计文献报道仅100 余篇[2-5],多为个案报道,并存在一定争议。本文总结我院诊断的8 例PFAA 患者临床及影像资料,探讨其解剖特征、分型及不同影像学方法对其的诊断价值。
1 资料与方法
一般资料:回顾分析2010 年10 月至2019年10 月中国医学科学院阜外医院放射科诊断的15 663 例先天性心脏病患者中,主动脉弓部畸形(包括主动脉弓缩窄、离断,右位主动脉弓,主动脉双弓畸形,PFAA)共1 836 例,其中PFAA 8 例,占主动脉弓部畸形的0.4%,在先天性心脏病中发生率为0.5‰;8 例PFAA 患者年龄0.2~32.0 岁,平均(9.0±10.4)岁,男性4 例,女性4 例。其临床资料详见表1。
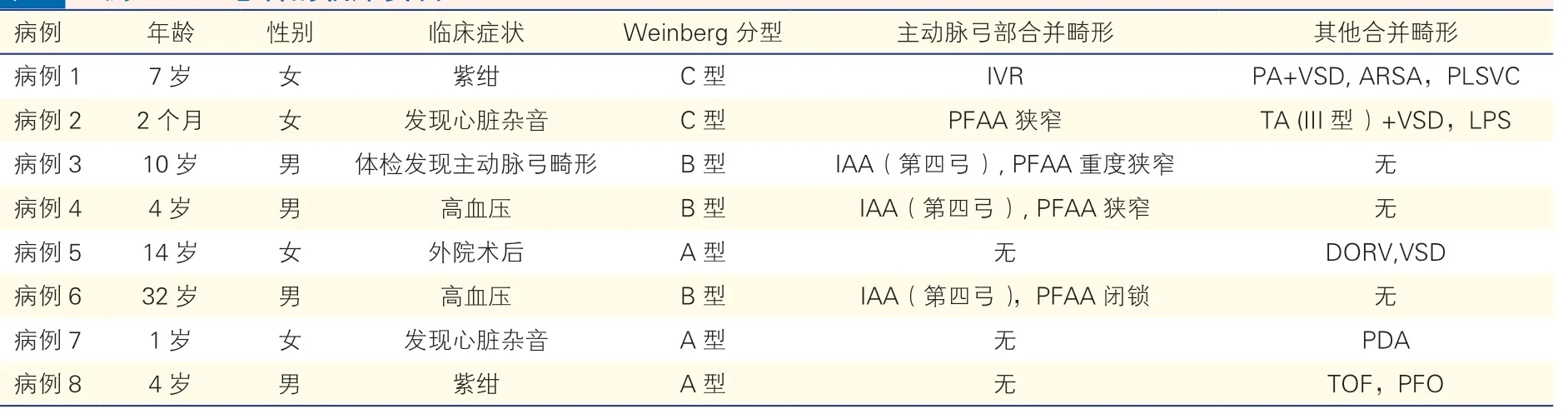
表1 8 例PFAA 患者的临床资料
影像学检查方法:所有患者均行X 线胸片、超声心动图及CT 检查,其中4 例行心血管造影检查。超声心动图常规经胸骨旁长、短轴、胸骨上及心尖四腔位,必要时辅以剑突下等体位。对怀疑主动脉弓部畸形的患者采用主动脉CT 血管造影(CTA)检查(螺旋扫描方式),对伴有心内畸形的患者采用心脏CTA 检查(前瞻性心电门控扫描,采集时间窗为35%~75% R-R 间期);扫描参数:管电压120 kV或100 kV,管电流400~500 mAs,扫描野(FOV)200 mm×200 mm~250 mm×250 mm;注入对比剂60~80 ml,注射流率为5~6 ml/s。造影检查于全麻或局麻下穿刺股动脉,行升主动脉造影,部分合并心内畸形者根据需要行心室及大动脉造影;成人造影剂每次总量≤35 ml,流率15~18 ml/s,婴幼儿及儿童流量1.0~1.5 ml/kg。
分型方法:Weinberg 分型法[6],A 型:双腔主动脉弓;B 型:主动脉弓闭锁或离断,其下方PFAA连接升主动脉及降主动脉;C 型:体-肺动脉连接,PFAA 起源于升主动脉远端无名动脉开口对侧,末端与第六对动脉弓发育的肺动脉相连,详见图1。
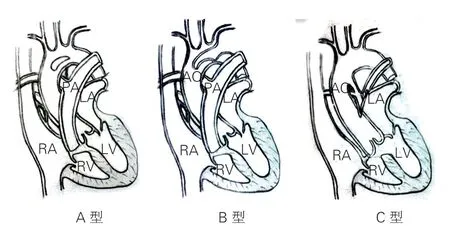
图1 永存第5 对主动脉弓Weinberg 分型示意图
图像分析:由2 名从事心血管影像诊断的主治医师及主任医师共同阅片,达成一致意见。观察指标包括大动脉起源、位置关系、走行、异常交通、狭窄及扩张改变、头臂动脉变异、伴发其他心血管畸形,气管及食道是否受压。
2 结果
2.1 X 线胸片检查结果
8 例患者均行心脏远达+左侧位检查,其中3例主动脉结显示不清、降主动脉近端偏宽,双侧肋骨切迹,提示主动脉缩窄;5 例发现肺血异常(增多3 例,减少2 例),提示先天性心脏病。主动脉结增宽3 例,右位主动脉结1 例;X 线胸片所见均无特异性,不能诊断PFAA。
2.2 超声心动图检查结果
8 例患者均行经胸超声心动图检查,首次超声心动图检查均未明确PFAA 诊断,其中,完全漏诊弓部畸形的3 例,提示主动脉缩窄或狭窄性病变2例,将PFAA 误诊为动脉导管未闭2 例,1 例C 型PFAA 患者超声心动图诊断为Ⅲ型共同动脉干,将PFAA 误诊为肺动脉异常起自升主动脉。3 例患者复查超声心动图时,2 例诊断PFAA(图2),1 例提示弓部异常血管。
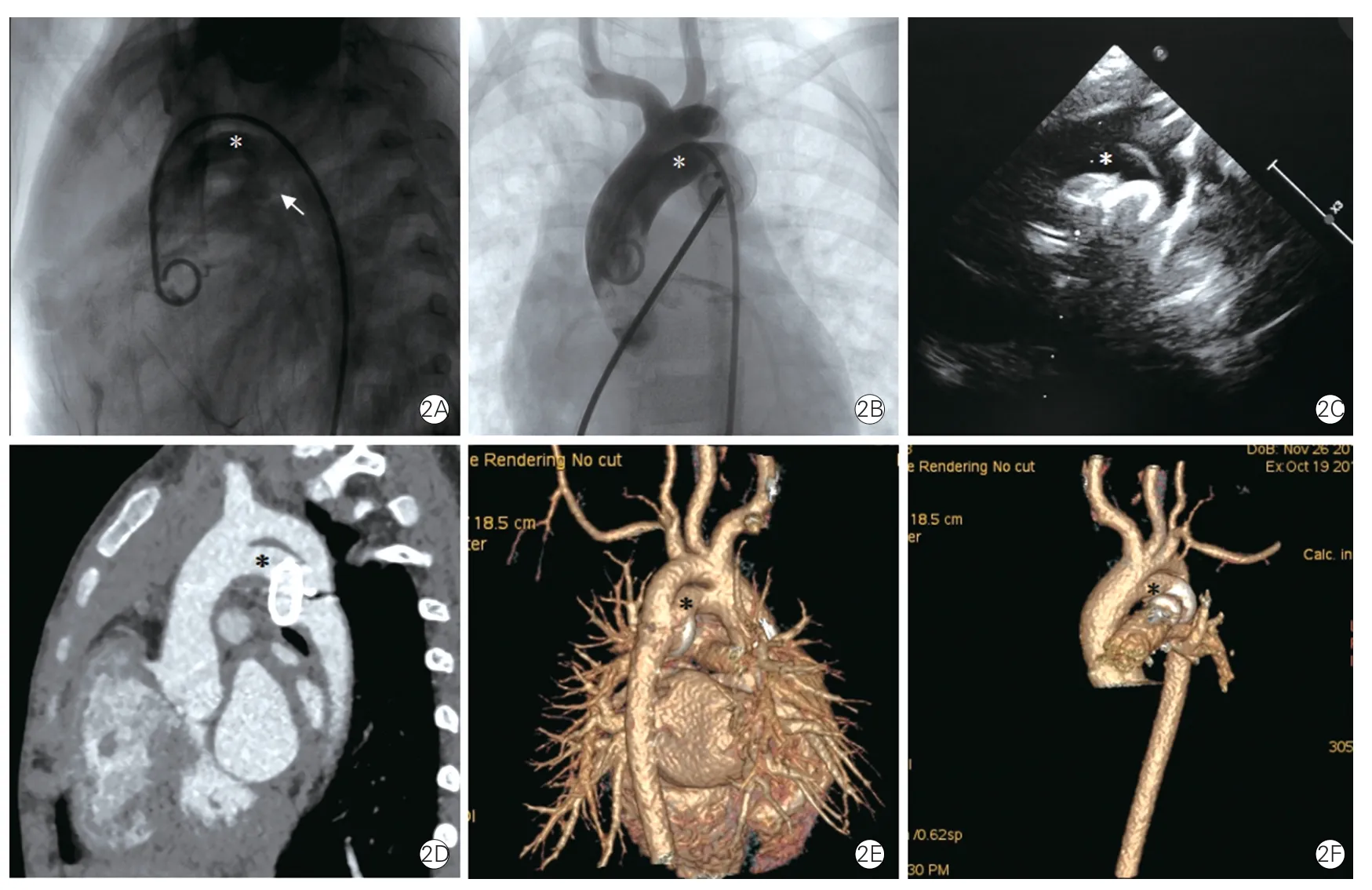
图2 永存第五对主动脉弓Weinberg A 型影像图
2.3 CT 检查结果
本组4 例主动脉CTA 及4 例心脏CTA 检查均可清晰显示PFAA 及其他主动脉弓部畸形,主动脉CTA 扫描范围更广泛,可显示主动脉侧支循环的全貌;心脏CTA 采用心电门控扫描,无运动伪影干扰,可以更清晰显示合并的心内畸形。
CT 表现:(1)A 型:主动脉弓下方可见平行的弓状血管(即PFAA),与主动脉弓首尾相连、形成双血管通道(双腔主动脉弓),连接升主动脉和降主动脉,下方的PFAA 可代偿部分主动脉弓血流(图2);(2)B 型:主动脉弓离断,其下方PFAA 连接升主动脉及降主动脉,可代偿主动脉弓血流,PFAA合并狭窄、闭锁时,则引起上、下肢压差(图3);(3)C 型:升主动脉远端(无名动脉开口旁或对侧)发出一弓状血管与肺动脉干相连,形成左向右分流(图4)。
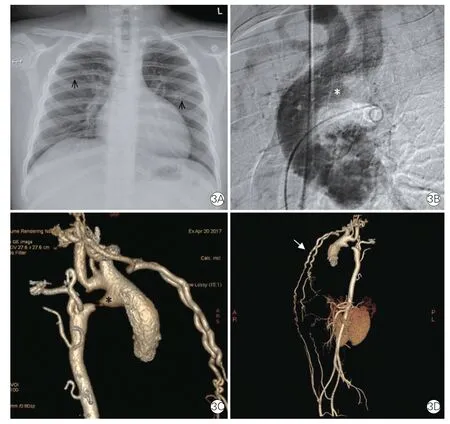
图3 永存第五对主动脉弓Weinberg B 型影像图

图4 永存第五对主动脉弓Weinberg C 型影像图
本组8 例PFAA 患者中A 型3 例,B 型3 例,C 型2 例;8 例PFAA 均起自升主动脉远端无名动脉开口旁或对侧,6 例止于降主动脉近端,2 例止于一侧肺动脉干;7 例PFAA 与主动脉弓位于同侧,仅1例位于动脉弓对侧,与主动脉弓及迷走右锁骨下动脉一起形成部分血管环,轻度压迫气管及食道;2 例PFAA 位于气管右侧、即右位PFAA,余6 例均左位PFAA。8 例患者PFAA 直径为(9.8±4.4)mm,主动脉弓部直径为(12.4±3.5)mm,降主动脉中段直径为(14.6±4.5)mm;PFAA 狭窄及闭锁共4 例,3例B 型PFAA 合并主动脉弓离断,8 例PFAA 患者中合并室间隔缺损4 例,其他合并畸形还有法乐四联症、共同动脉干、右心室双出口、肺动脉闭锁、动脉导管未闭、卵圆孔未闭。
2.4 造影结果
本组8 例患者中,3 例行心血管造影检查,其中,1 例超声心动图诊断动脉导管未闭患者行封堵治疗,术中造影发现双腔主动脉弓,术后CT 检查结果与造影所见一致;1 例B 型PFAA 患者,由于股动脉搏动弱,股动、静脉穿刺困难,改行颈静脉入路,行右心室及肺动脉造影,晚期再循环主动脉显影,可见主动脉弓离断,弓部下方异常锥形血管影,显示欠清晰,未能明确PFAA 诊断;另1 例C 型PFAA患者心血管造影检查结果与CT 检查结果一致。
2.5 手术结果
本组8 例患者中,3 例行外科手术,其中2 例B 型PFAA 行主动脉人工血管搭桥术解除弓部缩窄及闭锁,术中所见与CT 结果一致;1 例A 型PFAA弓部血流通畅,仅手术矫正心内畸形。另外1 例 A型PFAA 合并动脉导管未闭患者,行动脉导管未闭封堵治疗。
3 讨论
PFAA 是一类较罕见的先天性心血管畸形,1969 年Van Praagh 等[1]通过尸检首次发现并报道了第一例PFAA 之后,其观点迅速为很多学者所接受,世界各地均出现了一些关于PFAA 的报道,但多为个案报道,其发病率尚无准确统计。目前文献报道的发病率约为0.3‰~3‰[7-8],我院诊断的先天性心脏病患者中,PFAA 的发生率为0.5‰,由于早期对该病认识不足,存在一定的漏误诊,且部分PFAA不引起血流动力学异常、无临床症状,难以发现,故其实际发生率应高于此值。
3.1 PFAA 的发育机制
胚胎发育早期先后出现6 对鳃动脉弓连接于头端的腹主动脉与背主动脉之间,它们按一定时间顺序出现并逐一退化。正常人体主动脉弓发育过程中,左侧第4 鳃弓动脉演变为主动脉弓,右侧第4 鳃弓动脉演变为右锁骨下动脉近段,第6 鳃弓动脉演变为左右肺动脉干近段及左侧动脉导管,而第5 对鳃动脉弓发生后很快即退化消失,若其全部和(或)部分残存,即被称为PFAA[9]。两侧的第5鳃弓动脉可以分别或同时残存、形成左位、右位或双侧的PFAA,PFAA 可以与第4 鳃弓动脉发育形成的主动脉弓位于同侧,亦可位于对侧[10-12]。有研究指出PFAA 可以很好地解释一侧肺动脉异常起自升主动脉以及部分头臂动脉先天变异(如锁骨下动脉作为第一支头臂动脉起自升弓部)[13-14],并将之纳入PFAA 的改良分型中。但也有些研究认为人类胚胎发育过程中第五鳃动脉弓是否存在尚缺乏胚胎学的可靠证据,与PFAA 相关的一些畸形及头臂动脉变异的形成机制亦存在不同的解释[15-16]。由于对PFAA 的争议较大,Yang 等[17]认为PFAA 的诊断应慎重,诊断应满足以下条件:在心包外,起自升主动脉远端无名动脉开口对侧,止于降主动脉近端或一侧肺动脉干,形态上呈弓状,故本研究采用该标准及Weinberg 分型法[7]。
3.2 PFAA 的合并畸形
PFAA 可以单独发生,不合并其他畸形,本组8 例患者均合并其他心血管畸形,考虑与部分单发PFAA 的患者无临床症状、难以发现有关[17]。根据文献报道,PFAA 合并的心血管畸形包括:主动脉缩窄、主动脉离断、动脉导管未闭、室间隔缺损、房间隔缺损、肺动脉闭锁、法乐四联症、三尖瓣闭锁、共同动脉干、大动脉转位等[4,15],另外,PFAA可见于22q11.2 缺失综合征,研究认为22ql1.2的缺失与第三和第四鳃动脉弓的发育缺陷相关[12,18]。本组合并心血管畸形中以室间隔缺损最常见,4 例(50.0%)患者合并室间隔缺损;其次,3 例(37.5%)患者合并主动脉弓(第四弓)离断。
3.3 PFAA 的影像诊断方法
包括X 线胸片、超声心动图、CTA 及MRI 和造影检查。
X 线胸片是心血管疾病的常规检查方法,PFAA不合并弓部缩窄、离断及其他心血管畸形时,A型及B 型PFAA 的X 线胸片可无异常表现,C 型PFAA 形成体肺分流,引起肺血异常;PFAA 的X 线胸片表现无特征性,无法作出明确诊断。
超声心动图经济无创,作为先天性心血管畸形的首选筛查方法[5],可实时动态观察PFAA 及伴发心血管畸形的病理解剖,并可对血流动力学和心脏、瓣膜功能做出较准确的评价,但超声心动图对检查医师的技术水平依赖性高,在诊断主动脉弓畸形时主要依靠胸骨上窝切面,此切面声窗范围小、受肺部气体影响重,常导致对主动脉弓畸形的漏诊及误诊。本组8 例患者首次超声心动图检查均未明确诊断,除上述因素外,考虑部分与检查医师对PFAA认识不足有关。
CTA 及MRI 是目前诊断PFAA 的最有效的无创检查方法,能够清晰、直观、多角度立体展示PFAA 的解剖形态、走行特征、毗邻关系及连接情况,对各型PFAA 均可作出正确诊断,明显优于超声心动图,一定程度上可以替代血管造影[19-20]。本组8例PFAA 患者CT 检查无一例漏诊、误诊,对PFAA的诊断及分型、对合并的主动脉弓及心脏畸形的诊断均准确无误。本组3 例造影检查结果及3 例外科手术所见与CT 诊断一致。
心血管造影检查不仅可以清晰显示各种主动脉及心血管畸形,更能获得最准确的血流动力学资料,目前仍是先天性心脏病诊断的金标准[21-22]。但PFAA 狭窄同时伴有主动脉弓缩窄、离断时,股动脉搏动弱,特别是婴幼儿患者,常致股动脉穿刺困难,导管难以到达升主动脉及左心室造影,从而影响PFAA 及主动脉弓部畸形的观察[23]。本组1 例弓离断的患者,股动、静脉穿刺失败,选择颈静脉入路,行右心室造影,再循环观察主动脉,对PFAA 显示欠清晰,选择CTA 检查协助诊断。
3.4 PFAA 的鉴别诊断
(1)A 型PFAA 需与主动脉双弓畸形鉴别:后者是一种常见的血管环类型,是胚胎时期两侧第四鳃动脉弓均完全保留所致,表现为升主动脉在气管前分为左、右两个弓,环绕气管及食道,于后方汇合连接于降主动脉,形成完全血管环,两侧的颈总动脉及锁骨下动脉分别起自同侧的主动脉弓,气管、食管常受压引起喘鸣、呼吸困难等症状;而PFAA多与主动脉弓位于同侧,走行于主动脉弓下方、相互平行,两侧弓上动脉均起源于上方的主动脉弓,多不形成血管环,但 PFAA 位于主动脉弓对侧时,可能会构成不完全血管环结构。(2)B 型PFAA 主要与主动脉弓离断鉴别:后者主动脉弓离断,降主动脉未与升主动脉直接沟通,籍动脉导管未闭与肺动脉相连,存在肺动脉高压,弓离断与动脉导管未闭及室间隔缺损合称“主动脉弓离断三联征”;而B型PFAA 患者,主动脉弓(第四弓)离断,降主动脉通过PFAA 与升主动脉相连。(3)C 型PFAA 主要与动脉导管未闭及体肺侧支鉴别:动脉导管为第6 鳃动脉弓背侧发育而成,持续存在不退化即形成动脉导管未闭,临床上动脉导管未闭与C 型PFAA 血流动力学异常基本一致,均导致左向右分流[24],鉴别点在于两者的起点不同,动脉导管未闭起自主动脉峡部,而PFAA 起自升主动脉远端无名动脉开口对侧。体肺侧支是肺动脉狭窄或闭锁时,为代偿肺血流不足,体动脉与肺动脉间形成的侧支循环,其起点不固定,常自降主动脉、腹主动脉及头臂动脉发出,往往走行迂曲,可有分支,多走行至肺门及肺内,部分与肺动脉干远端或分支交通,不会起自升主动脉。
总之,PFAA 是一种较为罕见的主动脉弓部畸形,对各型PFAA 的胚胎发育、解剖及影像特征的完整理解对于提高诊断准确性非常重要。PFAA 常与多种心血管畸形并存,仅凭超声心动图很难诊断,CTA 的使用可大大提高诊断率,是首选的无创检查,在一定程度上可替代血管造影。
利益冲突:所有作者均声明不存在利益冲突
