外科手术治疗完全型大动脉转位合并非限制性室间隔缺损或Taussig-Bing畸形超龄患儿的疗效及预后分析
2021-11-07施浩陈亮闫军王强花中东李守军张旌
施浩,陈亮,闫军,王强,花中东,李守军,张旌
心室大动脉连接不一致的复杂先天性心脏病包括完全性大动脉转位(TGA)及Taussig-Bing 畸形(TBA)。目前可通过大动脉调转术(ASO)或心房调转术(Senning 术或Mustard 术)治疗这类疾病,前者被公认为是可获得理想效果的标准解剖矫治术式[1-2]。对于TGA 合并非限制性室间隔缺损(VSD)或TBA的患儿,肺血管梗阻性病变进展快,甚至达到不可逆状态,会严重影响手术效果,因此建议这类患儿尽早行手术治疗,最佳手术年龄是小于6 个月。我国的患儿就诊年龄偏大,根据中国医学科学院阜外医院早年统计结果,约40%患儿就诊年龄超过了6个月[3]。虽然国内外有不少文献报道了ASO 的中-长期结果及死亡危险因素[4-6],但目前鲜有针对年龄较大的TGA 合并非限制性VSD 或TBA 患儿手术治疗后的中-长期预后的分析。本研究旨在分析我院接受手术治疗的6 个月以上患儿的术后生存率及死亡的危险因素。
1 资料与方法
临床资料:回顾性分析2009 年1 月至2018年12 月在我院接受手术治疗的TGA 合并非限制性VSD 或TBA 的48 例患儿的临床资料。男性31例,女性17 例;年龄为(2.8±2.9)岁(范围:6 个月~12.4 岁),体重(10.6±7.0)kg(范围:4.2~47.0 kg)。TGA 合并非限制性VSD 患儿38 例,TBA 患儿10例。入组患儿均不合并主动脉弓发育不良、房室瓣反流、主动脉弓缩窄或主动脉弓离断等可能导致肺动脉高压的复杂心血管畸形。48 例患儿中,13 例合并房间隔缺损(ASD),15 例合并动脉导管未闭(PDA)。48 例患儿的术前血红蛋白为(172±45)g/L(范围:46~253 g/L),经皮动脉血氧饱和度(SpO2)为(73±10)%(范围:50%~95%),肺动脉平均压(mPAP)为(46.7±16)mmHg(范围:15~86 mmHg,1 mmHg=0.133 kPa)。手术前对1 岁以上患儿行右心导管检查,测得肺动脉收缩压(sPAP)为(63.2±17.7)mmHg(范围:21~106 mmHg),mPAP 为(46.7±16.0)mmHg(范围:15~86 mmHg),肺循环阻力(吸氧后)为(6.1±5.4)Wood Unit(范围:1.5~20.9 Wood Unit)。
所有患儿在全麻、低温体外循环下完成矫治手术,其中ASO 45 例,Senning 术3 例。43 例完成根治性调转手术(即在完成动脉或心房水平调转的同时修补ASD 或VSD),5 例完成姑息性调转手术(即在完成调转手术的同时保留ASD 或VSD,或行开窗术)。开胸后,分别在体外循环开始前及结束后于主动脉及主肺动脉直接测压。根据2015 年先天性心脏病相关性肺动脉高压诊治中国专家共识[5],将所有患儿分为三组:轻-中度肺动脉高压组(sPAP<70 mmHg 或肺/ 体循环压力比值(P/S PR)<0.75,n=11)、重度肺动脉高压组(sPAP ≥70 mmHg 或0.75 ≤P/S PR<1,n=28)、极重 度肺动脉高压组(P/S PR ≥1,n=9)。
统计学方法:用SPSS 21.0 统计软件进行统计处理。正态分布计量资料以均数±标准差表示(),不符合正态分布计量资料以中位数(P25,P75)表示。分类变量用例和百分比表示。非参数检验Mann-Whitney U 检验比较组间差异,多因素Logistic 回归分析影响术后死亡的危险因素,检验水准α=0.05。P<0.05 为差异有统计学意义。
2 结果
2.1 三组患儿的术前基线资料比较(表1)
表1 三组患儿的术前基线资料比较()
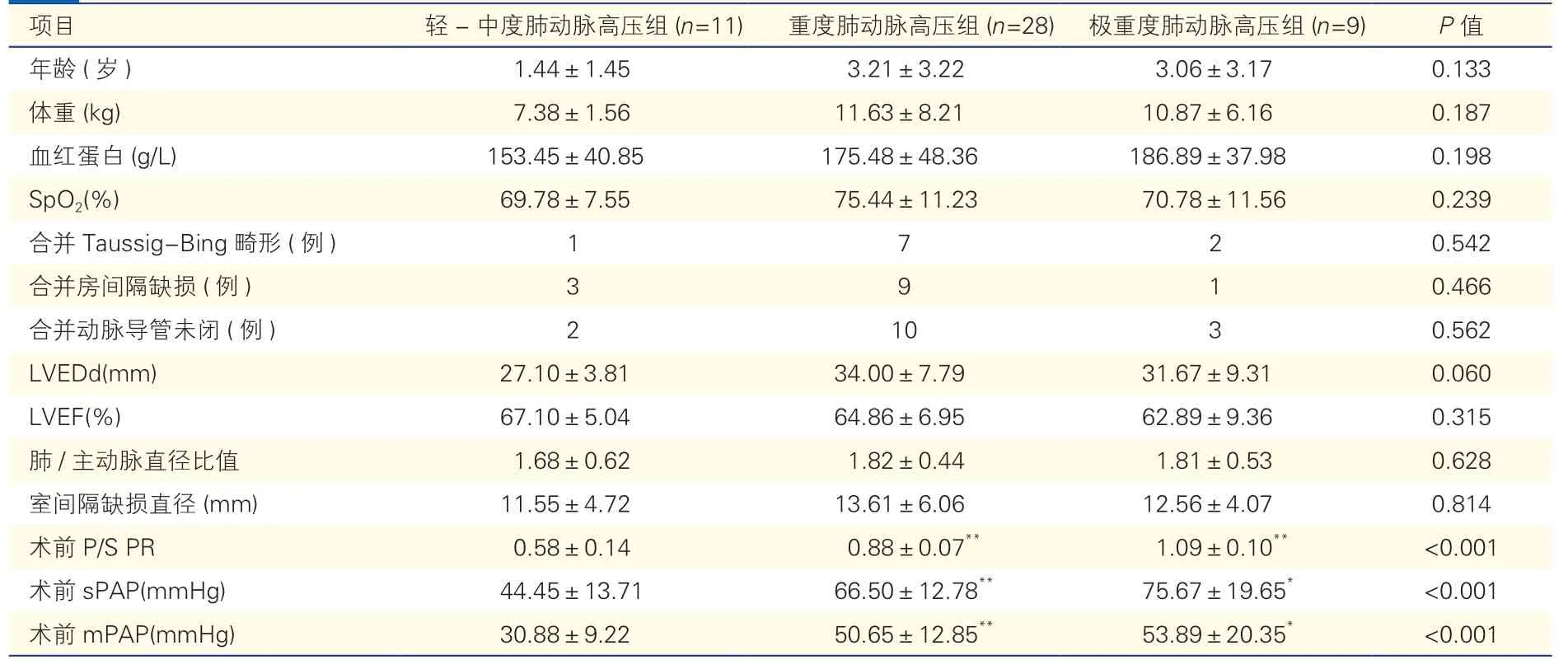
表1 三组患儿的术前基线资料比较()
注:SpO2:动脉血氧饱和度;LVEDd:左心室舒张末期内径;LVEF:左心室射血分数;P/S PR:肺/体循环压力比值;sPAP:肺动脉收缩压;mPAP:肺动脉平均压。与轻-中度肺动脉高压组比较*P<0.05 **P<0.001。1 mmHg=0.133 kPa
轻-中度肺动脉高压组与重度肺动脉高压组的年龄、左心室舒张末期内径(LVEDd)差异均无统计学意义(P均>0.05)。轻-中度肺动脉高压组与极重度肺动脉高压组患儿的血红蛋白水平差异无统计学意义(P>0.05)。重度肺动脉高压组及极重度肺动脉高压组患儿的术前sPAP、mPAP 均较轻-中度肺动脉高压组高,P/S PR 较大(P<0.001 或<0.05)。
2.2 所有患儿及三组患儿手术及术后情况(表2)
表2 三组患儿手术及术后情况()
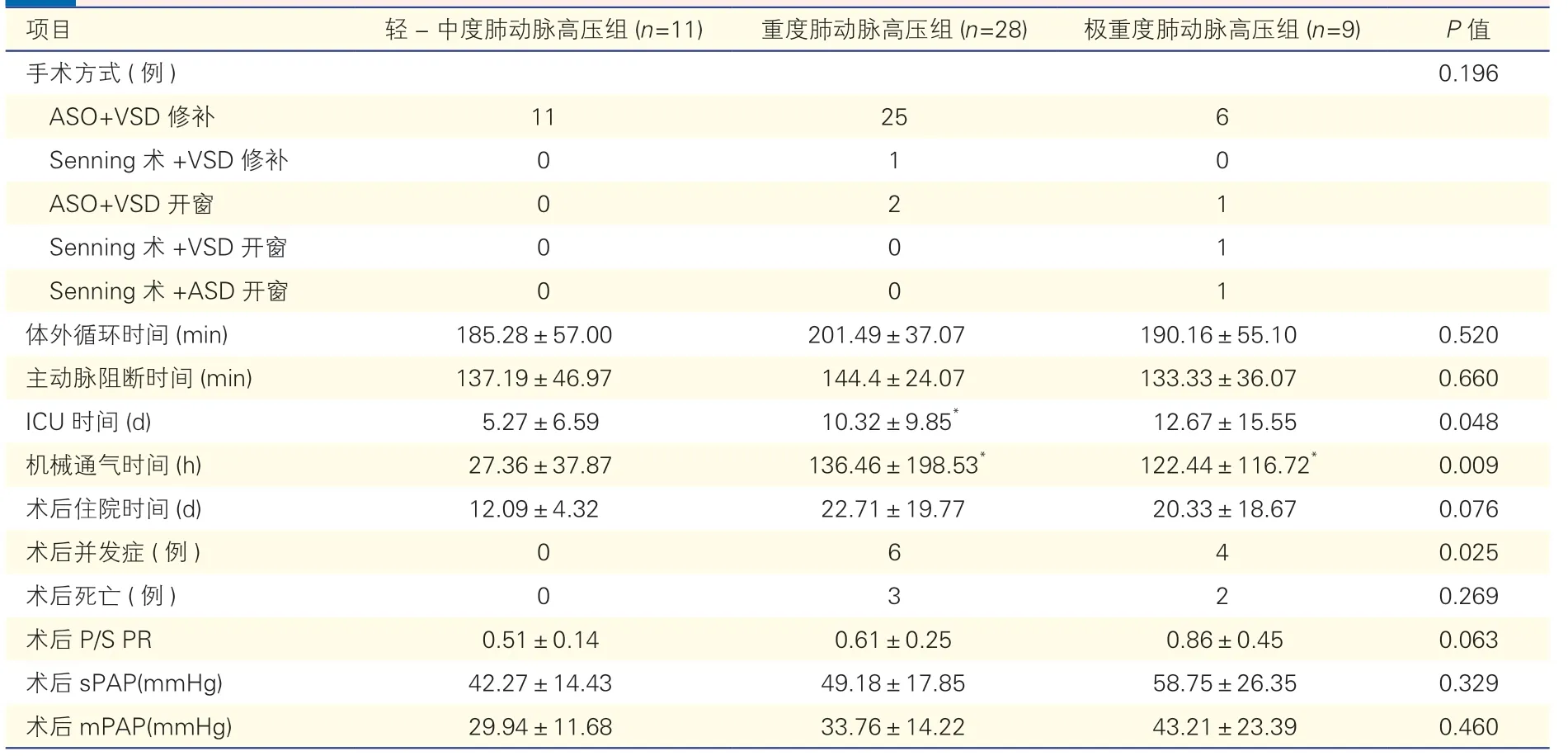
表2 三组患儿手术及术后情况()
注:ASO:大动脉调转术;ASD:房间隔缺损;VSD:室间隔缺损;ICU:重症监护室;P/S PR:肺/体循环压力比值;sPAP:肺动脉收缩压;mPAP:肺动脉平均压。与轻-中度肺动脉高压组比较 *P<0.05。1 mmHg=0.133 kPa
所有患儿中,术中主动脉阻断时间为(140±31)min(范围:56~222 min),体外循环时间(195±45)min(范围:93~320 min)。术后机械通气时间为(108±163)h(范围:5~758 h),术后重症监护室(ICU)时间(9.6±10.5)d(范围:1~4 d)。术后主要并发症包括延迟关胸1 例、二次插管3 例、体外膜肺氧合(ECMO)辅助1 例、腹膜透析3 例、心包开窗2 例。
重度肺动脉高压组及极重度肺动脉高压组的ICU 时间、机械通气时间均较轻-中度肺动脉高压组延长,且术后并发症也较多(P均<0.05)。
2.3 患儿手术前、后肺动脉压力的变化情况(表3)
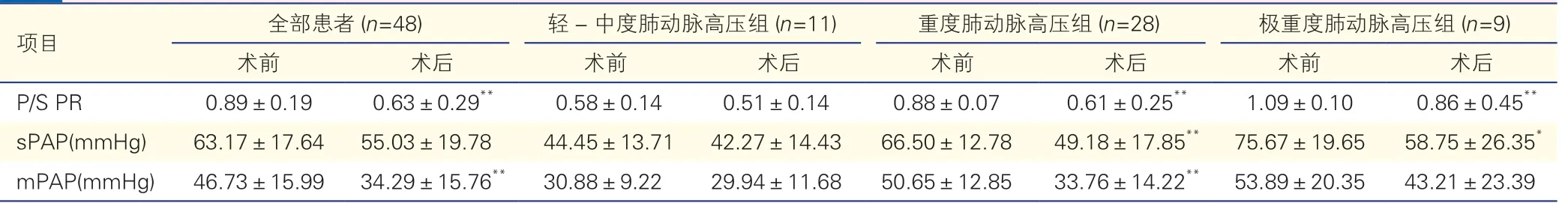
表3 患儿手术前、后P/S PR 及mPAP、sPAP 的比较
本组患儿术后总体肺动脉压力下降满意,P/S PR 和mPAP 均较术前明显下降(P均<0.001)。轻-中度肺动脉高压组术后肺动脉压力下降不明显,术后P/S PR、mPAP、sPAP 与术前相比差异均无统计学意义(P均>0.05),重度肺动脉高压组术后肺动脉压力均有明显降低,术后P/S PR、mPAP、sPAP 较术前显著降低(P均<0.001),极重度肺动脉高压组术后肺动脉压力较术前也有明显降低,术后P/S PR和sPAP 均较术前降低(P<0.001 或<0.05)。
2.4 术后随访结果
本组患儿术后30 d 内死亡3 例(6.25%)。3 个月总体死亡率10.4%(5/48)。5 例死亡患儿中,1岁以下2 例,1~3 岁1 例,3 岁以上2 例。5 例死亡患儿中,3 例为重度肺动脉高压,2 例为极重度肺动脉高压。4 例行根治性调转手术,1 例行姑息性调转手术。2 例患儿分别于术后第8 d、第23 d 死于肺动脉高压危象。1 例患儿术后第18 d 死于心力衰竭。1例患儿术后因肾功能衰竭行腹膜透析后出现腹腔感染,于术后第32 d 死于多脏器功能衰竭。1 例患儿出院1 个月后因肺动脉高压发生右心衰竭,出现胸、腹腔积液及少尿,再次住院后因肺动脉高压危象于术后第75 d 死亡。
43 例存活患儿均完成了长期随访,随访时间(4.8±2.4)年(范围:0.5~10.0 年)。随访患儿中未发生院外死亡。43 例随访患儿术后紫绀均明显改善,SpO2为95%~100%。36 例(83.7%)患儿的心功能均达到NYHA 心功能Ⅰ级,5 例(11.6%)患儿为NYHA 心功能Ⅱ级,2 例(4.7%)患儿NYHA 心功能Ⅲ级。根据超声心动图测量的三尖瓣反流流速估测肺动脉压力,2 例患儿仍残存肺动脉高压并需要长期口服波生坦。3 例患儿存在中度三尖瓣反流(其中1 例残存肺动脉高压),其余随访患儿均为轻度及以下三尖瓣反流。无患儿需再次手术治疗。
2.5 多因素Logistic 回归分析术后死亡的危险因素(表4)
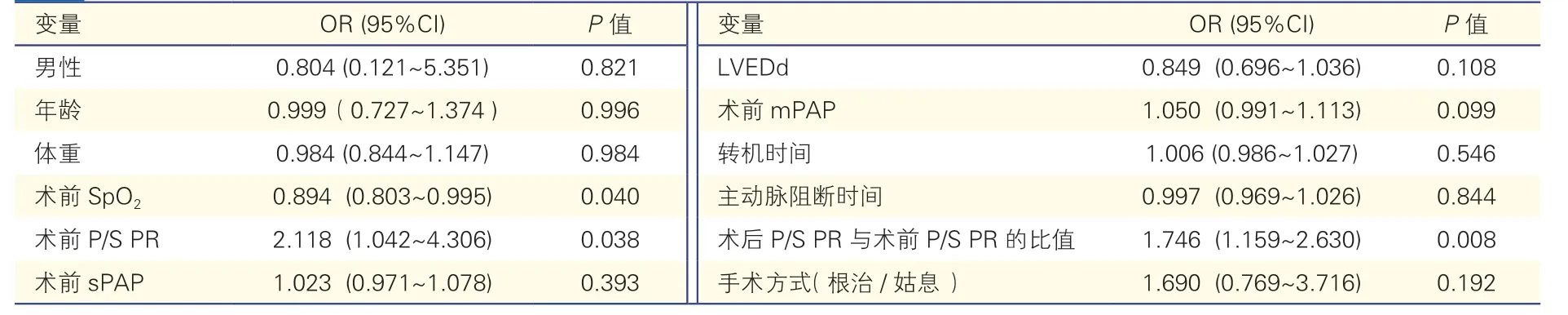
表4 多因素Logistic 回归分析
将患儿术前基线指标包括年龄、体重、性别、术前SpO2、术前肺动脉压力指标(P/S PR、sPAP 及mPAP)、LVEDd 以及手术相关因素(转机时间、主动脉阻断时间、手术方式)、术后P/S PR/术前P/S PR的比值纳入分析。结果显示,术前P/S PR(OR=2.118,95%CI:1.042~4.306,P=0.038)、术前SpO2(OR=0.894,95%CI:0.803-0.995,P=0.018)、术后P/S PR 与术前P/S PR 的比值(OR=1.746,95%CI:1.159~2.630,P=0.008)均是此类患儿术后死亡的危险因素。
3 讨论
对于TGA 合并非限制性VSD 或TBA 的患儿,非限制性VSD 使肺血管处于高流量、高压力及较高的氧含量的状态,造成肺血管梗阻性病变发展迅速,甚至达到不可逆的状态。此类患儿动静脉血液混合后改善了SpO2,而且左心室不退化,虽延长了患儿的寿命,但也致使一部分患儿就诊延迟,不可逆的肺血管梗阻性病变增加手术难度甚至失去手术机会。目前,对于此类患儿,术前紫绀不严重(SpO2>60%),X 线胸片提示肺血多,心导管检查提示肺循环阻力在合适范围内,仍可以接受手术治疗[7]。然而,关于如何在术前评估患儿的肺动脉压力及肺血管阻力,仍存在一定争议。通过经胸超声心动图测量三尖瓣反流的流速评估肺动脉压力仍是术前评估、术后随访的主要方法[8],右心导管检查测量肺动脉压力更精确,但该方法有创,且有人认为此类患儿因为体循环缺氧,体-肺循环间会形成侧支循环。这种侧支循环会影响肺静脉血氧饱和度并将其降低2%左右,最终在计算肺循环阻力时会高估10%~50%[9]。如果合并PDA,这种高估会更明显。因此本研究分析患儿的肺动脉压力时,采用右心导管或术中测压,并证实术后P/S PR 下降不明显甚至升高,是术后死亡的重要危险因素,而单纯通过sPAP 或mPAP 无法精确判断患儿病情严重程度并预测患儿预后。
对于此类患儿手术时机的选择,有研究显示,此类患儿应在出生后3 个月内、不超过6 个月时接受手术治疗,手术死亡率仅为5%~8%[6]。随着外科技术、体外循环技术、心血管麻醉技术以及肺动脉高压靶向药物研究的进展[10],此类患儿的手术适应证逐步拓展。我院前期回顾性分析显示,6 月以上的TGA 合并非限制性VSD 或TBA 患儿术后早期死亡率为7%[4],而且6 个月以上与6 个月以内患儿的早期死亡率无明显差异[7]。但目前已有的中长期随访结果认为超龄是预后不佳的危险因素[11]。张雅娟等[12]对我院115 例TGA 合并VSD 或TBA 的患儿进行术后随访,3 岁以上患儿中期死亡率为37.5%。本研究结果显示,6 个月以上患儿的早期(3 个月内)死亡率10.4%,其中6 个月至3 岁死亡率8.8%(3/34),3 岁以上为14%(2/14),虽然各组间死亡率差异没有统计学意义,但随着年龄增长死亡率仍有增加趋势。
本组患儿的中远期随访预后良好,无死亡患儿。中期随访结果改善的主要原因之一在于加强了此类患儿术后肺动脉高压靶向药物治疗,我院前期报道也证实术后药物治疗对此类患者预后的改善作用[13]。有研究证实,波生坦可有效治疗先心病术后残存肺动脉高压,有助于患儿术后心功能及临床症状的改善。这提示患儿超过3 岁仍具有手术适应证,超龄已不是绝对的手术禁忌证。另一原因在于对于超龄或术前重度肺动脉高压的患儿,更积极地采用保留室间隔缺损/室间隔补片开窗的手术策略。对于有严重肺血管梗阻性病变的此类患儿,是否能采用根治性ASO 治疗存在一定争议。因为很多患儿术后早期仍残余肺动脉高压,若闭合VSD,无法通过右心室泄压的方式预防肺动脉高压危象及猝死。有研究者认为,对于合并严重肺血管梗阻性病变的患儿,可考虑行姑息性Senning 术。Senning 术虽非解剖矫治,其远期心功能衰竭、心律失常等并发症的发生率较高,并不是首选的方案,但其手术操作相对简单,围术期死亡率低,同时术后长期使用靶向药物治疗,可在一定程度上达到改善生活质量、延长生存的目的[14]。我们对于术前肺动脉压力重度增高、预计术后肺动脉压下降不明显的患儿,亦会考虑行Senning 术,以提高患儿体循环血氧饱和度。本组患儿中,有3 例行Senning 术,其中1 例为术前肺动脉压>体循环压力,另2 例为术前肺动脉瓣关闭不全/狭窄,无法作为新主动脉瓣使用,因此选择Senning 术。
另外有人建议,除非有强烈证据证明肺动脉高压可逆,否则8~10 个月以上的患儿应优先采用姑息性ASO,甚至需行肺动脉环缩术[15]。Lei 等[16]分析了21 例采用姑息性ASO+VSD 补片开窗治疗的患儿,室间隔补片开窗直径占新主动脉瓣环大小的50%,术后早期死亡率14.3%,认为姑息性手术可有效避免术后肺动脉高压危象导致的猝死,而且补片开窗可以在远期通过经皮封堵的方式闭合。本研究的48 例患儿中,15 例患儿术后因各种原因存在室间隔水平的分流(室间隔补片开窗4 例、肌部室缺或室缺补片残余分流等11 例)。室间隔水平有分流患者的死亡率为0%(0/15),无分流患者的死亡率为15.2%(5/33),但差异无统计学意义。进一步分析发现3 岁以上患儿室水平分流对术后死亡率有影响(P=0.04),这提示室间隔开窗对3 岁以上患儿的具有保护作用,姑息性ASO 或许是更好的方法。而本组1 例患儿房间隔开窗术后仍因肺动脉高压危象死亡,考虑房水平分流只能部分降低右心系统前负荷,不能有效降低右心室压力、改善预后。因此对于重度及极重度肺动脉高压患儿,尤其是3 岁以上的患儿,姑息性ASO+VSD 补片开窗或许是更好的方法。
6 个月以上TGA 合并非限制性VSD 或TBA 患儿的手术治疗仍是挑战。由于精准化的手术策略及靶向药的使用,目前术后疗效及远期生存已明显改善。年龄已不是绝对禁忌证,而肺动脉高压仍是造成术后不良预后(增加住院时间、ICU 时间,呼吸机时间等)并增加围术期死亡的主要危险因素。对于重度或极重度肺动脉高压患儿或者3 岁以上的患儿,建议行姑息性ASO,部分病例亦可考虑心房调转术。此类患儿主要不良事件均发生于围术期,远期预后良好。
利益冲突:所有作者均声明不存在利益冲突
