吸入用瑞德西韦脂质体的制备及其体外评价
2021-11-07李菁菁尹莉芳
赵 笛,李菁菁,张 凯,秦 超,杨 磊,尹莉芳
(中国药科大学药学院药剂系,南京 210009)
新型冠状病毒肺炎(COVID-19),简称“新冠肺炎”,是由新型冠状病毒(SARS-CoV-2)引起的一种重症急性呼吸综合征。该病毒主要通过呼吸系统进行传播,主要通过作用于肺泡上皮细胞中存在的血管紧张素转换酶-2受体(ACE-2)感染人体[1-2]。目前该病毒已迅速席卷全球,累计确诊超过1亿人,死亡病例超过220万[3-4]。然而由于缺乏有效的治疗措施和治疗药物,新冠肺炎的疫情仍然无法得到完全的控制。各个国家科学家正在积极进行COVID-19疫苗的研发工作,并取得了一定的成果。但是对于目前超过1亿人的新冠肺炎感染患者来说,当务之急是开发出具有明显抗病毒疗效的药物进行针对性治疗。
瑞德西韦(remdesivir)是一种核苷类似物的氨基磷酸酯前药,其体内活性代谢产物核苷三磷酸(NTP)能够与天然ATP竞争性作用于病毒的RNA依赖性RNA聚合酶(RdRp),引起病毒RNA链延伸过程的错配或终止,抑制病毒的复制[5]。该化合物在各项临床前和临床研究中均表示出广谱的抗病毒活性[6-7]。因此,FDA于2020年10月批准了抗病毒药物注射用瑞德西韦的上市,用于COVID-19的治疗。然而由于血浆中存在大量的酯酶等水解酶,瑞德西韦在血浆中极不稳定。实验表明,静脉注射后瑞德西韦在小鼠体内的血浆半衰期小于5 min,恒河猴体内的血浆半衰期仅0.39 h[6,8],在人体血浆中的半衰期为1 h[9]。基于瑞德西韦的物理化学性质及其在组织血浆中的不稳定性,可以预计静脉注射后瑞德西韦在肺部组织中的分布和渗透率较低。在多项动物模型中,肺部均未检测到瑞德西韦,其活性代谢物的浓度也较低。由此可见,尽管瑞德西韦仍是新冠肺炎患者最有希望的治疗方法之一,但仅仅通过静脉给药的方式很大程度上限制了药物的临床疗效。因此,需要进一步研究瑞德西韦的肺部给药方式以期改善药物的肺部蓄积,提高其抗新冠肺炎病毒的临床疗效。
本研究采用脂质体为药物载体制备了瑞德西韦脂质体吸入制剂,并以包封率、粒径和多分散系数等为评价指标对其制备工艺进行筛选和优化,旨在制备具有良好的载药能力和空气动力学性质的吸入用瑞德西韦脂质体,以期改善药物在肺内的分布,提高瑞德西韦的治疗效果。
1 材料
1.1 药品与试剂
瑞德西韦原料药(批号:20200319,含量:97.9%,中国药科大学徐云根教授实验室提供);二棕榈酰磷脂酰胆碱(DPPC,瑞士Corden Pharma公司);胆固醇(大连美仑生物技术有限公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-mPEG 2000,上海艾韦特医药科技有限公司);甘露醇、山梨醇、乳糖、葡萄糖、蔗糖和海藻糖(上海麦克林生化科技有限公司);甲醇(色谱纯,美国Tedia公司),其他试剂均为市售分析纯。
1.2 仪 器
XPR2/A百万分之一天平(梅特勒-特利多仪器上海有限公司);旋转蒸发仪(南京科尔仪器设备有限公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);ZetaPlus电位粒径测定仪(美国布鲁克海文仪器公司);JEM-1200EX型透射电子显微镜(日本电子公司);LGJ-18C型冷冻干燥机(北京四环科学仪器厂有限公司);UV-1800紫外可见分光光度计(日本岛津公司);新一代药用撞击器(NGI)-120(英国Copley Scientific公司)。
2 方法和结果
2.1 瑞德西韦脂质体含量和包封率的测定
2.1.1 紫外全波长扫描 取10µg/mL瑞德西韦甲醇溶液置于紫外-可见光分光光度计中,于200~500 nm波长范围下进行紫外全波长图谱的扫描。结果表明,在246 nm波长处瑞德西韦有最大吸收,且此波长处空白脂质体甲醇溶液无明显干扰,因此选择以246 nm作为瑞德西韦含量测定的检测波长较为合适。
2.1.2 标准曲线的配制 精密称取瑞德西韦原料药5 mg于50 mL量瓶中,甲醇溶解定容作为储备液(100µg/mL)。精密移取适量体积的储备液至10 mL量瓶中,以50%甲醇稀释成质量浓度为2、4、6、8、10、15µg/mL的系列标准溶液,在246 nm波长条件下使用紫外分光光度计进行测定,以吸收度(A)为纵坐标,样品质量浓度c(µg/mL)为横坐标,进行线性回归,得到线性方程A=0.061 6c-0.001 5(R2=0.999 9)。所以,瑞德西韦质量浓度在2~15µg/mL范围内的检测线性良好。
2.1.3 包封率测定 采用超滤离心法除去游离药物,取适量瑞德西韦脂质体混悬液,用甲醇破乳、稀释至10 mL,使用紫外-可见光分光光度计在246 nm波长条件下测定瑞德西韦的含量,计算包封率。
2.2 瑞德西韦脂质体制备方法筛选
分别采用薄膜分散法、乙醇注入法和逆向蒸发法制备瑞德西韦脂质体。以脂质体的粒径、多分散系数、包封率以及稳定性为考察指标,选择合适的制备方法。
2.2.1 薄膜分散法 精密称取处方量瑞德西韦原料药、DPPC、胆固醇以及DSPE-mPEG 2000置于圆底烧瓶中,加入氯仿15 mL,溶解混匀后于45℃水浴条件下使用旋转蒸发仪除去有机溶剂。加入适量pH 6.5 PBS缓冲液进行水化,冰浴条件下将脂质体混悬液进行探头超声分散(200 W,10 min)。
2.2.2 乙醇注入法 精密称取适量DPPC、胆固醇以及DSPE-mPEG 2000,加入无水乙醇5.0 mL溶解。于45℃搅拌状态下将药物的乙醇溶液缓慢注入缓冲液中。在45~50℃水浴条件下使用旋转蒸发仪除去有机溶剂,加入适量pH 6.5 PBS缓冲液定容至5.0 mL,冰浴探头超声分散(200 W,10 min)。
2.2.3 逆向蒸发法 精密称取处方量瑞德西韦原料药、DPPC、胆固醇以及DSPE-mPEG 2000置于圆底烧瓶中,加入氯仿15 mL溶解,混匀后加入少量pH 6.5 PBS缓冲液探头超声分散(200 W,5 min)形成乳化剂。在45℃条件下使用旋转蒸发仪除去有机溶剂,加入适量pH 6.5 PBS缓冲液水化后,冰浴探头超声分散(200 W,10 min)。
不同方法制备得到的脂质体结果如表1所示,不同工艺制备的脂质体包封率无明显差异,然而使用薄膜分散法得到的脂质体粒径较小。从外观稳定性来看,使用逆向蒸发法制备的脂质体在24 h内出现大量沉淀,稳定性较差;而采用薄膜分散法制得的脂质体混悬液在48 h内几乎无明显沉淀产生。综合考虑以上因素,确定采用薄膜分散法制备瑞德西韦脂质体。
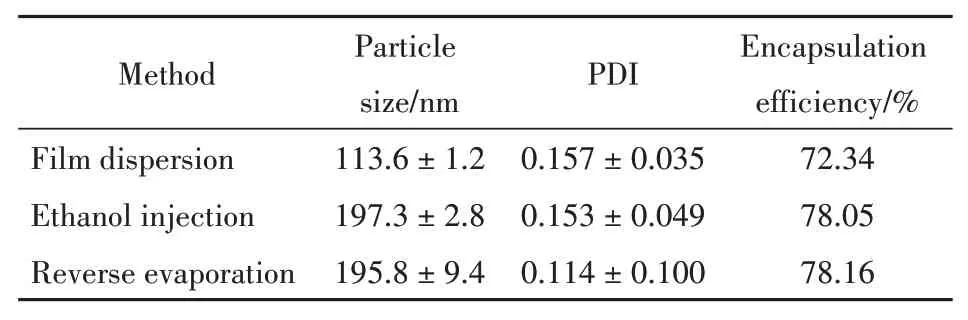
Table 1 Characterization of remdesivir-loaded liposomes prepared by different methods(xˉ±s,n=3)
2.3 瑞德西韦脂质体处方工艺单因素考察
2.3.1 药物与磷脂材料的比例 控制处方中稳定剂DSPE-mPEG 2000和胆固醇的用量一致,仅调整药物与磷脂的比例分别为1∶5、1∶15、1∶20、1∶30,按照“2.2”项下薄膜分散法制备瑞德西韦脂质体,以粒径及包封率作为考察指标对其进行评价。结果见图1,随着瑞德西韦脂质体中磷脂DPPC用量的增加,脂质体的粒径减小、包封率提高;当药脂比小于1∶20,包封率几乎无明显变化。因此,确定处方中药物与磷脂的比例为1∶20。
2.3.2 胆固醇的用量 控制制备的脂质体中总脂材用量以及药物用量不变,分别加入0%、10%、20%、30%、40%的胆固醇,按照“2.2”项下薄膜分散法制备脂质体,以粒径及包封率作为考察指标对其进行评价。结果如图2所示,脂质体中胆固醇比例主要对瑞德西韦的包封率有影响,随着胆固醇占比的提高,其药物包封率显著下降。由于适量的胆固醇具有提升脂质体膜结构稳定性的作用[10],从而减少载药脂质体的药物泄露,因此在保证脂质体良好的包封率的前提下选择加入的胆固醇比例为10%。

Figure 1 Influence of the weight ratio of drug to phospholipid on encapsulation efficiency(EE)and particle size of remdesivir-loaded liposomes(±s,,n=3)

Figure 2 Influence of the weight ratio of cholesterol on EE and particle size of remdesivir-loaded liposomes(±s,,n=3)
2.3.3 稳定剂DSPE-mPEG 2000的用量 实验过程中发现,仅以磷脂和胆固醇为组成成分的脂质体包载瑞德西韦后其粒径可达576 nm,标准差较大,并且24 h内脂质体混悬液有明显沉降,无法维持混悬状态,稳定性极差。因此,选择加入一定量的DSPE-mPEG 2000作为稳定剂。设计比例分别为0%、5%、10%、20%,按照“2.2”项下薄膜分散法制备脂质体,以粒径、包封率和稳定性作为考察指标对其进行评价,结果见图3。实验表明,加入DSPE-mPEG 2000后,随着其比例增加,脂质体的稳定性和载药量都有明显提升,因此选择稳定剂占比为20%。

Figure 3 Influence of the weight ratio of DSPE-mPEG 2000 on EE and particle size of remdesivir-loaded liposomes(±s,,n=3)
2.3.4 水化介质种类筛选 分别以纯化水、生理盐水、pH 4.0醋酸盐缓冲液、pH 6.5 PBS缓冲液以及pH 7.4 PBS缓冲液作为水化介质,考察其对脂质体混悬液的包封率、粒径及外观稳定性的影响。结果如图4所示,水化介质主要对脂质体的外观稳定性和包封率产生影响。其中纯化水水化得到的脂质体虽然72 h内无沉淀产生,但是包封率较低(<50%)。pH 4.0醋酸盐缓冲液水化后脂质体的包封率最优,但在24 h内有明显沉淀,而pH 6.5的PBS缓冲液水化后的脂质体48 h内几乎无明显沉淀。因此,综合考虑水化介质对粒径、稳定性以及包封率的影响,选择pH 6.5 PBS缓冲液。

Figure 4 Influence of different hydration medium on EE and particle size of remdesivir-loaded liposomes(±s,,n=3)
2.4 冻干工艺考察
由于冷冻干燥是一个较为复杂的过程,会对脂质体和药物的活性产生一定的破坏,因此需要加入适量冻干保护剂以减轻冻干造成的应力损伤。因此,分别考察甘露醇、山梨醇、乳糖、葡萄糖、蔗糖和海藻糖等冻干保护剂对瑞德西韦脂质体冻干的保护作用,暂定其加入量为5%(每100毫升加入5 g)。将冻干制剂的外观、复溶时间及复溶后的粒径、包封率作为评价的指标。
结果表明,无冻干保护剂的脂质体冻干后复溶时间长(67 s),粒径明显增大,稳定性较差,24 h内有大量沉淀。而加入冻干保护剂之后,脂质体冻干前后的粒径变化较小,超声复溶时间明显缩短(5~12 s),稳定性得到明显提升(图5-A)。从外观上看,以甘露醇、乳糖和海藻糖作为保护剂的冻干制剂呈现为皱缩海绵状固体,具有较好的形态,其中以海藻糖为冻干保护剂的脂质体复溶后粒径变化较小,因此最终选择海藻糖作为脂质体冻干保护剂。
在此基础上,进一步对海藻糖加入的量进行筛选。实验表明,加入不同浓度的海藻糖作为冻干保护剂制得的样品复溶后脂质体混悬液的粒径无明显差异,且包封率和稳定性均较好。其中,加入冻干保护剂的量为2%时,复溶时间较长(27 s)并且冻干的固体外观形态较差。而按4%~10%的量加入冻干保护剂的制剂各项参数均无明显差异(图5-B),因此确定海藻糖加入的量为4%。
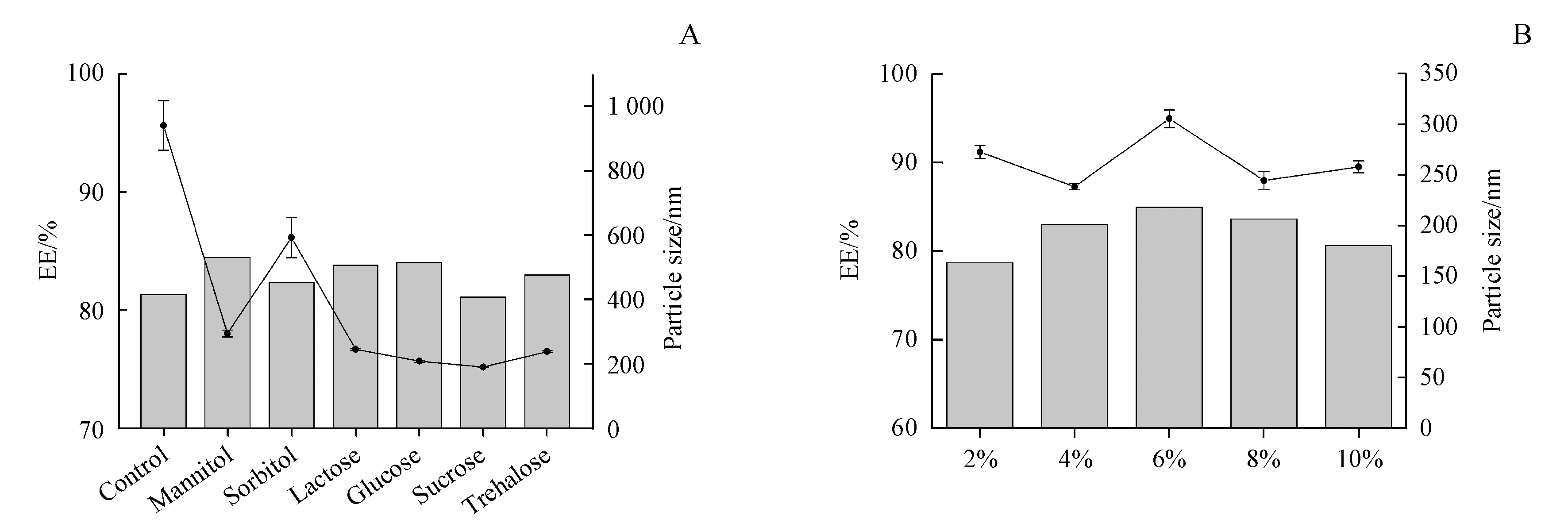
Figure 5 Influence of lyoprotectants(A)and trehalose concentration(B)on EE and particle size of remdesivir-loaded liposomes(±s,,n=3)
2.5 制剂学评价
2.5.1 形态学表征 采用透射电子显微镜(TEM)观察瑞德西韦脂质体的外观形态。取复溶后的瑞德西韦脂质体混悬液10µL滴在铜网上,静置3~5 min后用滤纸吸去多余的水分,向铜网表面滴加2%磷钨酸溶液,负染5 min,烘干后将样品放置在TEM下观察并拍摄电镜照片。如图6所示,微观状态下脂质体外观呈圆整球形,表面光滑,分布均匀。

Figure 6 TEM images of remdesivir-loaded liposomes
2.5.2 复溶溶剂的选择及稳定性考察 适宜的复溶溶剂有利于维持脂质体混悬液的粒径大小、均一性和混悬状态。本实验中分别以纯化水、0.9%生理盐水和pH 6.5 PBS缓冲液作为脂质体冻干制剂的复溶溶剂,以复溶后脂质体的粒径、PDI作为评价指标,考察复溶后脂质体混悬液在25℃和4℃条件下的稳定性。由图8可知,不同溶剂复溶后的脂质体均具有良好的粒径大小和均一性。25℃(图7-A)和4℃(图7-B)条件下,制剂在10 d内的粒径、PDI均无明显变化,稳定性良好。因此,上述3种溶剂均可用于瑞德西韦脂质体冻干制剂的复溶。
2.5.3 体外释放行为的考察 精密称取相当于瑞德西韦0.5 mg的脂质体冻干制剂3份,以生理盐水2 mL复溶后置于截留相对分子质量为3 500的透析袋中,以新配制模拟肺液200 mL作为溶出介质,37℃下进行药物释放考察。分别于0.25、0.5、1、2、4、6 h时间点取样1 mL,同时补加等温、等体积的模拟肺液。测定瑞德西韦的含量,计算药物的累积释放度并绘制释放度-时间曲线。
收集经雾化器雾化后得到的样品,同法进行释放度测定并绘制释放度-时间曲线,并与未雾化的样品释放行为进行比较。如图8所示,瑞德西韦脂质体在该释放介质中4 h左右即能够释放90%以上。经雾化后虽然脂质体释放略有降低,但是释放趋势与雾化前基本一致。说明载药脂质体经雾化后未发生团聚且仍然呈缓慢释放,雾化过程对脂质体的质量无明显影响。
2.5.4 吸入剂的空气动力学粒径分布测定 参照2020版《中华人民共和国药典》四部通则0951项下的要求[11],使用雾化器对瑞德西韦脂质体混悬液进行雾化,采用新一代撞击器(next generation impactor,NGI)对吸入用瑞德西韦脂质体混悬液的空气动力学粒径分布(aerodynamic particle size distribution,APSD)进行研究。具体操作如下:将NGI置于55℃条件下预冷并连接真空泵以15 L/min的流量运行90 min。将脂质体混悬液4 mL加入到雾化杯中。雾化10 min后,以50%甲醇洗涤各层级收集杯和微孔收集器(MOC)的滤纸,收集各层级的样品并置于20 mL量瓶中,以50%甲醇稀释定容,作为供试品溶液。
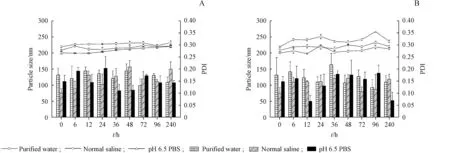
Figure 7 Stability of remdesivir-loaded liposomes at 25°C(A)and 4°C(B)after reconstitution in different solvent(±s,,n=3)

Figure 8 Drug release curve of remdesivir-loaded liposomes before and after nebulization(±s,,n=3)
吸入瑞德西韦脂质体混悬液经雾化后的药物沉积量分布如图9所示,超过64%的雾化液滴主要沉积在stage-3、stage-4和stage-5。
使用科普利吸入制剂测试数据分析软件(CITDAS)软件计算相关参数:微细粒子百分比(FPF)、质量中值空气动力学粒径(MMAD)和几何标准偏差(GSD)。结果表明,雾化气溶胶颗粒的FPF为(54.31±2.74)%,MMAD为(4.50±0.38)µm;GSD为(2.06±0.34)%。以上数据说明,雾化后脂质体混悬液可能在肺部沉积的微细粒子所占比大于50%,并且雾化液滴符合药典规定的粒径大小,具有较窄的粒径分布,表现出理想的肺部沉积性。

Figure 9 Drug deposition ratio of remdesivir-loaded liposomes(±s,,n=3)
3 讨论
新型冠状病毒的主要通过飞沫传播由呼吸道感染人体,临床主要表现为轻度、中度、重度肺炎和广泛的肺实质损伤。2020年10月FDA批准吉利德公司上市了一款用于静脉注射的瑞德西韦制剂[12],尽管在目前的临床数据中显示出了益处[13],其疗效仍然是有限的。由于血液中含有大量的水解酶,经静脉注射的前药瑞德西韦在血浆中极不稳定,从而影响药物及其活性代谢物在肺部的蓄积,限制了药物的疗效。因此,直接肺部给药可能是理想的给药方式,能够有效避免药物在血浆中的降解,使药物快速分布于肺部并提高靶部位药物浓度,降低COVID-19患者的全身毒性。
脂质体是一种可用于肺部靶向给药的理想载体,它可以制备成不同的粒径、不同的形式以满足给药需求并且能极大程度地改善药物的稳定性。DPPC是肺表面活性剂的主要成分之一[14],在肺部给药方面具有显著的应用前景优势,同时也是美国FDA批准的吸入赋形剂之一。已上市的阿米卡星脂质体吸入混悬液(ARIKAYCE®)即以DPPC、胆固醇为主要赋形剂[15],用于罕见肺病的治疗。因此,本研究以DPPC作为脂质体的磷脂材料包载瑞德西韦,对其处方工艺进行筛选并进行初步的体外评价。
瑞德西韦的溶解度较差,通过脂质体包封可显著改善其溶解度,而脂质体包封率主要受到处方中磷脂和胆固醇用量的影响。因此,本研究主要以单因素试验对脂质体处方组成进行优化。结果表明,包封率随磷脂占比的增加而增加,随胆固醇用量的增加而减少。由于胆固醇可嵌入磷脂双分子层中,改善磷脂膜的刚性和稳定性,减少药物在雾化过程的渗漏[10],因此,最终处方在保证药物包封率的前提下加入少量胆固醇以减少药物的渗漏。此外,DSPE-mPEG 2000的加入可显著改善脂质体混悬液的稳定性,减少脂质体团聚和沉淀的现象。
由于瑞德西韦在水溶液中不稳定[16],采用冷冻干燥技术将其制备成冻干制剂可延长贮存期限。冻干保护剂的加入能保证获得的冻干制剂具有良好的外观,复溶前后粒径、包封率等参数无显著性差异。此外,复溶后的混悬液在4℃或25℃条件下良好的稳定性表明在雾化过程中药物几乎不会出现沉淀和聚集的现象。雾化前后脂质体的体外释放曲线无明显变化,进一步证实了雾化过程对脂质体混悬液的质量无明显影响。
雾化吸入剂的气溶胶微粒的大小直接影响药物在呼吸系统中的沉积部位和沉积量,进而影响临床药效。微粒的沉积主要由惯性碰撞、重力沉积和扩散运动所决定的。通常惯性碰撞是粒径大于5µm的气溶胶颗粒沉积的主要机制,此时颗粒主要沉积于主气道和口咽部;粒径在1~5µmol/L范围内的微粒可以轻松到达下呼吸道,并沉积在气管、支气管和肺泡;小于0.5µm的微粒则主要通过布朗扩散作用在呼气过程中被排出肺部。故本研究选择采用NGI测定吸入剂的ASPD,NGI是2015年《中华人民共和国药典》新引入的装置,它能测定不同粒径大小范围内的药物沉积量,获得较双级撞击器更全面的雾化特性数据[17]。本研究以FPF、MMAD、GSD为指标对其空气动力学性质进行评估。其中,FPF反映了粒径小于5µm的微粒量占总药液的比例,反映了可能进入肺部的药量。MMAD是质量中值空气动力学粒径,是衡量微粒能否有效沉积在肺部的重要参数。几何标准偏差GSD反映了气溶胶颗粒的分布情况,理想气溶胶的GSD为1,但多数药物气溶胶是非均相的,GSD一般小于3.0即可[18]。
以上实验表明,本研究开发的吸入用瑞德西韦脂质体能够高效地包载瑞德西韦,体外稳定性良好。对其空气动力学性质的评估表明,雾化后的吸入剂气溶胶微粒满足肺部给药所需的粒径要求,有利于药物经呼吸道直接到达肺部病灶部位,为药物的体内有效性研究奠定了基础。
