调控鸡胚肝脏组织抗氧化功能差异基因的筛选
2021-11-07李春晖何程实吴建鑫韦张其杨少华刘国庆
李春晖, 何程实, 吴建鑫, 韦张其, 杨少华, 刘国庆
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
鸡胚在孵化过程中是以半封闭形式进行,其代谢产物只能依靠自身进行分解,如在生长发育过程中呼吸作用产生的自由基。鸡胚在发育过程中需要大量的氧气提供能量以维持机体的快速代谢等生命活动,从而导致产生更多的活性氧,而高水平的活性氧会造成蛋白质、脂质过氧化以及 DNA损伤[1]。因此存在于鸡胚内部的超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)、过氧化物酶(POD)等酶发挥作用清除活性氧,以保证发育过程中的氧化应激平衡。已有研究表明,在鸡胚的发育过程中,不同组织中的相应抗氧化酶是不断变化的[2-4],其中肝脏组织是鸡胚中发挥抗氧化作用最显著的器官。然而关于这些抗氧化相关的mRNAs研究却报道不多,因此基于转录组测序技术筛选抗氧化相关的mRNAs并对其进行功能分析具有重要的研究意义。
近年来,随着新一代转录组测序技术的发展,转录组测序(RNA-seq)技术逐渐成为大规模研究转录组的一种新的且更为有效的方法[5]。RNA-seq技术是利用大规模测序技术直接对cDNA序列进行测序,产生数以千万计的测序序列数量,从而使得一段特殊的基因组区域的转录水平可以直接通过比对到该基因组区域的测序序列数量来衡量[6]。文献[7]研究表明不同发育时期牛胚胎的转录本与牛的基因组对比后发现了1 785个新的转录本;文献[8]研究表明禽白血病病毒感染汶上芦花鸡和正常汶上芦花鸡肝脏转录组对比得到了1 446个新基因,其中1 058个新基因功能得到注释;文献[9]研究表明小尾寒羊和多赛特羊脂肪组织的转录组对比研究发现了2个样本之间存在602个差异表达基因。
目前,RNA-seq技术已经用于研究鱼[10-11]、小鼠[12]等各种类型的转录组,但对于鸡胚转录组研究报道较少。基于抗氧化机制在鸡胚发育过程中的重要作用,本研究以黑山鸡胚肝脏组织作为研究对象,对转录组测序结果进行筛选及富集功能分析,从而揭示在鸡胚发育过程中调控抗氧化酶活力的关键候选基因。
1 材料与方法
1.1 主要材料
孵化至12、13、14、15、16、17、18 d的黑山鸡胚蛋,每天的样品做3次重复。
1.2 主要试剂与仪器
蛋白定量检测试剂盒,超氧化物歧化酶(SOD)检测试剂盒,谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒,组织匀浆机,酶标仪,台式高速冷冻离心机,实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪,Nanodrop核酸蛋白检测仪,凝胶成像系统,电泳仪,反转录试剂盒,DNA Marker,核酸染料等。
1.3 鸡胚肝脏组织制备及其酶活测定
取出孵化至一定天数的鸡胚蛋,消毒后置于无菌操作台中取出肝脏组织,清洗,转移至冻存管中,置于-80 ℃环境中保存,作为待测样品。
制成10%组织匀浆,按照超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒说明进行测定。
1.4 RNA提取及质量检测
使用TRIZOL法提取12、16 d鸡胚肝脏组织总RNA,在1%琼脂糖凝胶上检测RNA降解和污染。RNA纯度采用超微量紫外分光光度计测定,以OD260、OD280、OD320值表示RNA纯度。使用生物分析仪2100系统检查完整度,测序要求动物样品RNA完整值均需大于7,且电泳条带中有清晰的28S和18S条带,28S/18S大于1。
1.5 cDNA文库的构建和测序
样本RNA经过质量检测合格后,取3 μg作为cDNA文库构建的输入材料。采用专门用于Illmina测序系统建库。
1.6 实时荧光定量PCR检测
获得差异表达基因后,从中随机挑选5个基因,从NCBI上下载对应基因的cDNA序列,进行引物设计,同时使用GAPDH作为内参基因,引物设计使用软件Primer5.0进行。引物设计完成后委托联川生物有限公司合成。采用SYBR GREEN Ⅰ检测样品中靶标基因的表达量。
1.7 实验数据分析
1.7.1 数据产出情况分析
高通量测序得到的原始图像数据文件经CASAVA碱基识别(base calling)分析转化为原始测序序列(sequenced reads),即为原始测序序列(raw reads),其中包含测序序列(reads)的序列信息以及对应的测序质量信息。为了保证后续数据分析的质量,需要将原始测序序列(raw reads)中带接头的、碱基信息无法确定率大于10%的以及低质量的测序序列(reads)进行过滤,得到的序列信息为过滤后测序序列(clean reads),继而在过滤后测序序列(clean reads)基础上进行差异表达基因鉴定以及功能富集分析。
1.7.2 差异表达基因的鉴定
测序数据通过DESeq R软件包进行差异分析,达到精确对比测序样本间的差异表达。使用Benjamini和Hochberg的方法调整所得的P值以控制错误发现率。
1.7.3 差异表达基因的功能富集分析
GO富集可分为分子功能(molecular function)、生物过程(biological process)和细胞组成(cellular component)3个部分。GO富集分析原理为超几何分布,根据挑选出的差异基因计算这些差异基因与GO分类中某几个特定的分支的超几何分布关系,通过假设验证得到一个特定P值,进而判断差异基因是否在该GO中出现了富集。筛选差异表达基因后,通过GO功能富集分析能确定差异表达基因行使的主要生物学功能。以P≤0.05为阈值,筛选满足此阈值的差异表达基因显著富集的GO条目。
KEGG(Kyoto Encyclopedia of Genes and Genomes)是一个整合了基因组、化学和系统功能信息的综合数据库。可借助KEGG 通路进行分析基因功能及表达信息,进而作为一个整体网络进行研究。通路显著性富集分析应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著性富集的通路。
2 实验结果与讨论
2.1 鸡胚肝脏组织中抗氧化酶活性测定结果
2.1.1 SOD测定结果
对孵化至各天数的黑山鸡胚肝脏组织按照试剂盒检测标准进行测定,结果如图1所示。图1中,a、b、c表示显著性差异,相同字母表示无显著性差异,下同。

图1 SOD活力测定结果
从图1可以看出,鸡胚在孵化后期肝脏组织中的SOD酶活性差异性变化趋势。在鸡胚基本成型的12 d时,达到(424.41±24.24) U/mg,后期逐渐下降,在孵化至16 d时达到最小值(329.48±11.22) U/mg。
2.1.2 GSH-Px测定结果
对孵化至各天数的黑山鸡胚肝脏组织按照试剂盒检测标准进行测定,结果如图2所示。
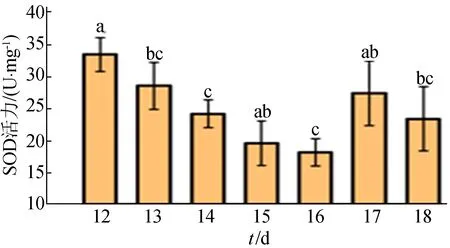
图2 GSH-Px活力测定结果
从图2可以看出,鸡胚在孵化后期肝脏组织中的GSH-Px活性呈现出差异性变化趋势,孵化至12 d时酶活达到(33.44±2.65) U/mg,且与后期各天均具有显著差异(P<0.05),16 d的鸡胚肝脏组织GSH-Px酶活性最小,达到(18.19±2.09)U/mg。
酶活测定结果表明,12、16 d 的SOD酶活性与GSH-Px酶活性显著差异,具有明显表型极端值。因此,选取孵化至12、16 d鸡胚肝脏组织作为后期转录组测序实验对象最合理。
2.2 总RNA检测结果
TRIZOL法提取12、16 d各3个样品(编号为1~6)的总RNA,使用1%琼脂糖凝胶电泳进行降解和污染程度检测,结果如图3所示,图3中,M代表Marker;1~6分别代表Day12-1、Day12-2、Day12-3、Day16-1、Day16-2、Day16-3。
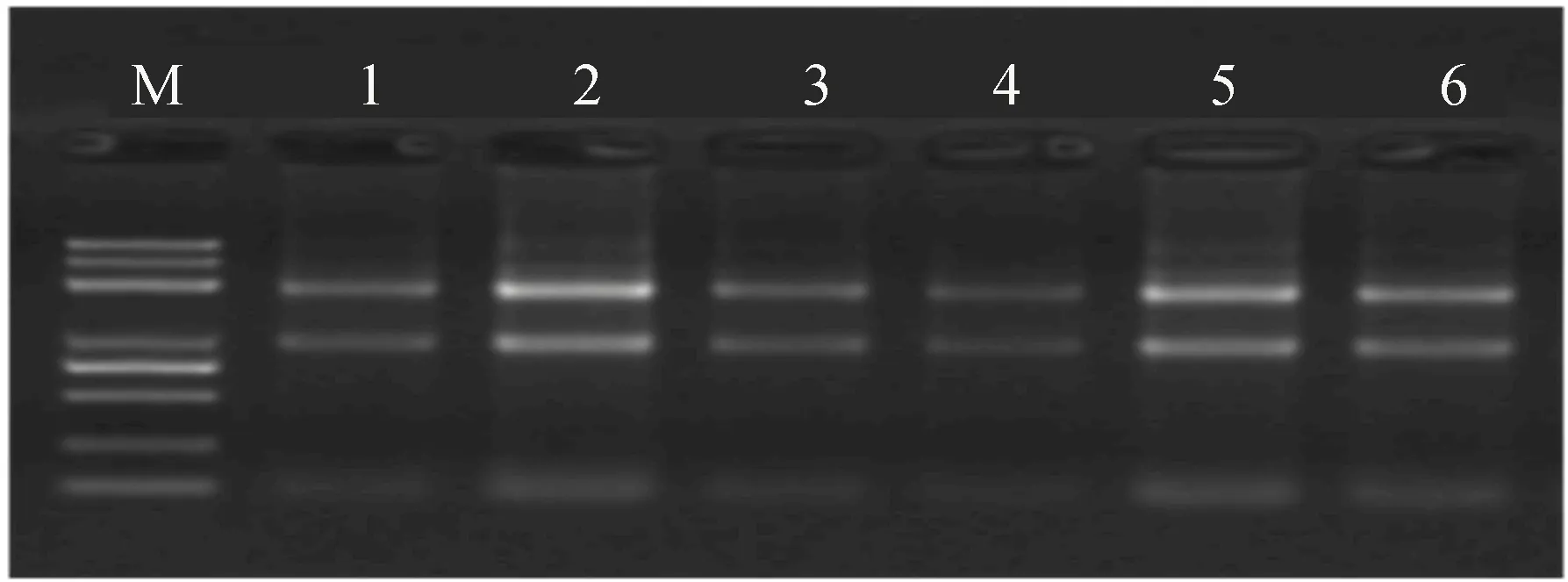
图3 1%琼脂糖凝胶检测结果
图3中的6个样品均有2条清晰条带,即28S和18S条带,6个样品的OD260/OD280值均大于1.9、OD260/OD230值均大于2.1,RNA完整值均大于9.5,表明总RNA完整性好、总RNA纯度高,总RNA质量检测结果见表1所列,检测结果合格,能达到建库要求。

表1 总RNA质量检测结果
2.3 转录组测序结果
通过Illumina测序平台对6个样品进行深度转录组测序。对测序结果进行测序数据质量评估,包括测序错误率分布检查、A/T/G/C含量分布检查。将原始数据序列中含有带接头、低质量的测序序列等进行过滤获得过滤后测序序列。测序结果见表2所列。
本次测序每个样本获得了90 699 174~106 556 962个配对测序序列,去除带接头的、碱基信息无法确定率大于10%的以及低质量的测序序列后,获得了594 016 590个过滤后测序序列,6个样品的总读取长度为89.1×109碱基。

表2 样品的基本测序数据
2.4 差异基因表达分析
将P≤0.05作为筛选差异基因的标准,检查了12、16 d 2个样本之间的差异表达基因表达谱。2组样本间共获得216个差异表达基因,其中81个上调基因,135个下调基因。部分显著差异基因结果见表3所列。
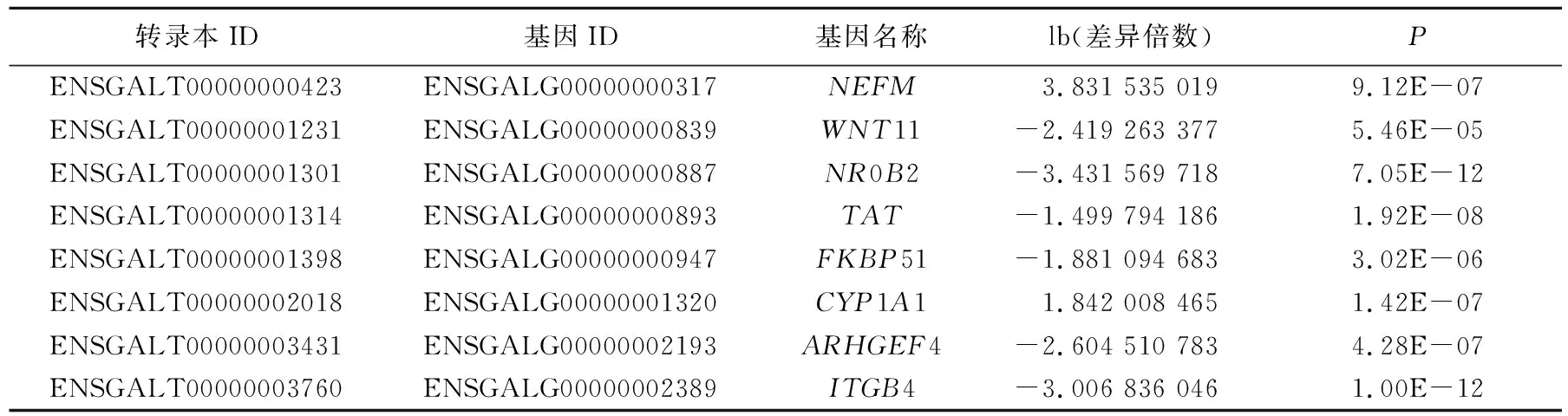
表3 部分显著差异基因
12、16 d 2个样本之间的差异表达火山图如图4所示。

图4 差异表达基因的火山图
2.5 差异基因GO富集和KEGG通路分析
为了进一步评估差异表达基因的功能,进行差异基因GO富集功能分析。在列出的216个差异表达基因中,GO分析结果表明,3 140个GO terms里有421个GO terms显著富集,可按照细胞成分、生物过程、分子功能分类,在这些GO terms中,与抗氧化有关的20个GO生物过程项显着富集(P≤0.05)。其中包括:氧转运体活性(GO:0005344)、氧气输送(GO:0015671)、氧结合(GO:0019825)、单加氧酶活性(GO:0004497)、氧化还原酶活性(GO:0016712)、氧化还原酶活性,作用于成对供体,与分子氧结合或还原(GO:0016705)、氧化还原法(GO:0055114)、氧化还原酶活性(GO:0016491)、谷胱甘肽转移酶活性(GO:0004364)等。部分通路详细信息见表4所列。
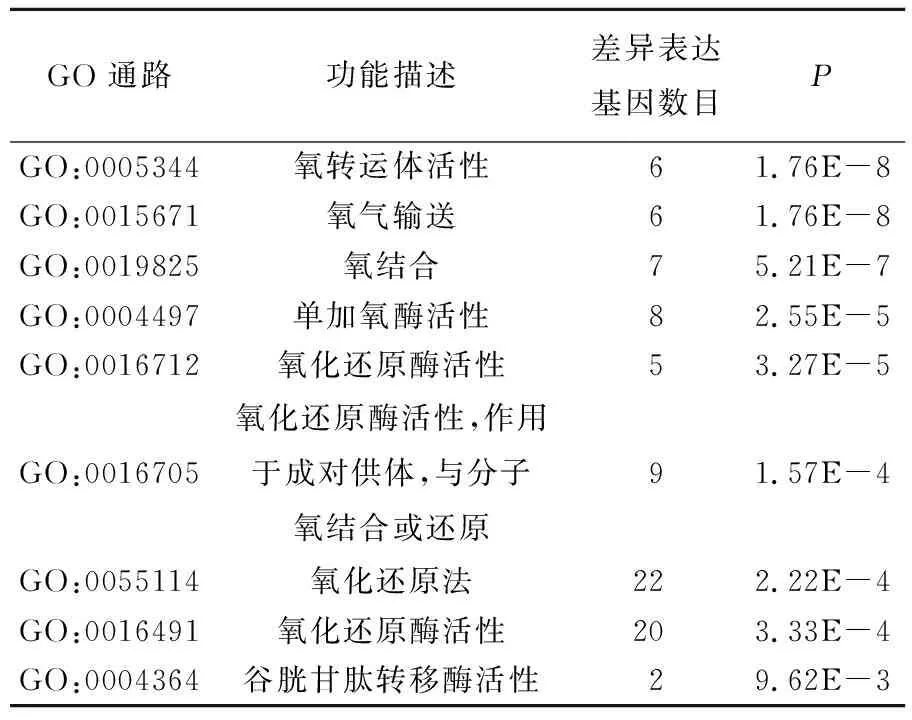
表4 差异表达基因的GO分析
同时对KEGG通路进行分析,对富集情况以散点图表示,如图5所示。得到的71个通路中有8个通路被显著富集(P≤0.05),其中包括“药物代谢细胞色素p450”(gga00982)、“谷胱甘肽代谢”(gga00480)、“细胞色素p450对外源物质代谢的影响”(gga00980)等通路与抗氧化酶活性相关。
2.6 实时荧光定量PCR测定
从测序结果筛选出的216个差异表达基因中随机挑选5个差异表达基因进行实时荧光定量PCR测定,以验证转录组测序结果的准确性,结果如图6所示。

图6 实时荧光定量PCR验证差异基因表达
从图6可以看出,实时荧光定量PCR测得的基因表达水平与RNA-seq得到的基因表达水平一致,从而证实了转录组测序平台得到的数据是准确的。
3 讨 论
本研究的目的是通过转录组测序技术寻找影响鸡胚发育过程中抗氧化酶活性变化的关键候选基因。本文以鸡胚肝脏组织作为研究对象,选取孵化至12、16 d的鸡胚为研究材料,提取RNA,建立cDNA文库,对转录本进行深度测序,并进行差异分析、功能分析,获得了216个显著差异表达基因,而一些基因具有已知的功能,例如HMOX2、CYP1A4、MAOA、GSTA、TTPA、MAT1A、GSTA3、MGST3等,也有研究报道这些基因与抗氧化酶活性有关[13-16]。在这些差异表达基因中,GSTA3(明显下调)、GSTA(明显下调)、TTPA(明显上调)、MGST3(明显下调)、HMOX2(明显上调)等被认为是影响鸡胚发育过程中抗氧化酶活力的关键候选基因。
血红素加氧酶(HO)是唯一已知的催化血红素降解和一氧化碳(一种气体信号分子)的哺乳动物酶[17]。血红素代谢对于细胞来说至关重要,血红素是许多氧转运和氧化还原酶的蛋白质的必要假体基因[18]。血红素加氧酶有HO-1、HO-2和HO-3 3种同工型血红素加氧酶2(HMOX2)在氧化还原、氧化还原酶活性、氧酸代谢等GO中都存在富集,且表达量明显上调。在细胞应激状态下,血红素加氧酶发挥着重要作用,HO基因缺失的个体不能正常发育并且会增加对氧化损伤的敏感性[19]。 HO-1和HO-2具有相似的物理和动力学特性,但具有不同的生理作用和组织分布。HO-1是一种抗氧化和细胞保护酶[20],与缺少半胱氨酸残基的HO-1不同,HO-2包含3个Cys-Pro标记,称为血红素调节基序(HRM),已知这些特征可控制细菌和人类有机体中铁和氧化代谢有关的过程[21]。
谷胱甘肽S-转移酶(GSTA)和谷胱甘肽S-转移酶3(GSTA3)是谷胱甘肽S-转移酶(GSTs)家族的成员,在谷胱甘肽转移酶活性、氧酸代谢过程等GO存在富集,参与抗氧化功能调节。GSTA编码属于α类的谷胱甘肽S-转移酶,为肝脏和肾脏中细胞抗氧化剂防御机制的重要组成部分[22]。GSTA在使反应性亲电试剂和脂质过氧化产物解毒中起重要的细胞保护作用[23],包括GSTA在内的GST先前已被确定为应激激酶的活性抑制剂,最著名的是c-Jun N端激酶[24]。GSTA3被称为抗氧化蛋白酶,文献[25]指出GSTA3敲除小鼠表现出增加的氧化损伤,并且一般认为GSTA3在体内表现出氢过氧化物酶活性,其表达量的下调随氧化应激水平而变化。
在微粒体谷光甘肽硫转移酶,MGST作为膜结合蛋白之一,具有谷光甘肽转移酶和过氧化物酶活性在细胞及细胞器的抗氧化胁迫中扮演着重要角色[26]。微粒体谷胱甘肽S-转移酶3(MGST3)属于MGST家族,主要是催化外源性物质及其活性亲电子代谢产物与GSH亲核巯基结合,起到解毒及保护机体的重要作用,并且可作为GSH-Px通过还原膜脂质氢化物起到抗脂质过氧化的作用[27]。
α生育酚转移蛋白(TTPA)是一种约32 kDa的胞质蛋白,具有明显的配体特异性并选择性识别α生育酚,后者是维生素E的最活跃形式[28],维生素E是大多数动物中主要的脂溶性抗氧化剂。有研究表明,永生化的人类肝细胞中TTPA基因的转录是由氧化应激和缺氧,核受体PPARα和RXR的激动剂以及cAMP水平升高引起的[29]。
4 结 论
本研究通过RNA-seq技术对孵化至12、16 d的鸡胚蛋肝脏组织进行深度测序,获得大量原始测序序列数据,再对数据进行过滤、处理、筛选,共找出216个显著差异表达基因。通过综合分析差异表达基因、通路分析和基因功能分析,最后确定GSTA3、GSTA、TTPA、MGST3、HMOX2、GSTA1、ODC1、MAOA和GST可能是影响鸡胚发育过程中抗氧化酶活力的候选基因,为后期的研究提供了一定的理论依据。
