超声引导下胸椎旁神经阻滞复合右美托咪定在肝癌微波消融术中应用效果观察
2021-11-06郎凤娇严京哲
陈 莉, 唐 涛, 郎凤娇, 严京哲
1.大连市友谊医院 麻醉科,辽宁 大连 116001;2.吉林省肿瘤医院 腹部肿瘤二科,吉林 长春 130012
微波消融术是一种治疗临床局部肿瘤的微创技术。超声引导下肝癌微波消融术因具有创伤小、疗效确切、操作方便等优点,常被用于治疗各种原因不能手术或不愿手术的原发性或继发性肝癌患者。微波消融术既往多在局部麻醉下进行,但常因不能很好地抑制术中肝包膜牵张和消融产热时引发的疼痛而导致患者出现烦躁不安、恶心呕吐,甚至血压升高、心率增快等一系列不良反应,给患者带来极大痛苦,更有甚者因反应过于强烈、疼痛难忍而终止治疗。静脉全身麻醉可有效抑制术中疼痛,但镇痛程度难以把握,易出现镇痛不足,导致患者肢体出现不自主扭动,妨碍手术操作[1],还可能镇静和镇痛过深,使患者出现严重呼吸抑制和血压下降[2]。本研究旨在观察超声引导下胸椎旁神经阻滞(thoracic paraspinal nerve block,TPVB)复合右美托咪定在肝癌微波消融术中的应用效果。现报道如下。
1 资料与方法
1.1 一般资料 选取大连市友谊医院2019—2020年收治的择期行超声引导下肝癌微波消融术的60例患者为研究对象。排除标准:既往精神疾病史;近期抗凝药、止痛药摄入史及药物滥用史;存在神经系统合并症,严重心、肺、肝、肾功能不全,胸廓或脊柱畸形,穿刺部位感染,出血或凝血功能障碍等。将患者随机分入C组和P组,每组各30例。C组中,男性18例,女性12例;平均年龄(66±5)岁;平均身高(165±8)cm;平均体质量(69±7)kg;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ级16例,Ⅲ级14例;平均肿瘤直径(3.1±1.2)cm;平均与肝被膜距离(2.6±0.7)cm;平均治疗时间(31.5±4.2)min。P组中,男性20例,女性10例;平均年龄(67±5)岁;平均身高(163±9)cm;平均体质量(67±12)kg;ASA分级Ⅱ级17例,Ⅲ级13例;平均肿瘤直径(2.9±0.9)cm;平均与肝被膜距离(2.5±0.6)cm;平均治疗时间(32.3±5.7)min。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者及其家属均签署知情同意书。本研究经医院伦理委员会批准。
1.2 治疗方法 所有患者术前常规禁食、禁饮,入室后(T0)开放外周静脉,面罩吸氧,连接多功能监护仪,备口咽通气道、喉罩、喉镜、气管导管等气管插管设备。C组采用靶控输注(target controlled infusion,TCI)瑞芬太尼复合右美托咪定,P组采用TPVB复合右美托咪定。C组:静脉泵注右美托咪啶1.0 μg/kg,10 min泵注完毕后以0.5 μg/(kg·h)术中维持;同时,TCI瑞芬太尼2.0 μg/L(效应室浓度)。P组:术前30 min先在超声引导下实施患侧TPVB;患者取侧卧位,手术侧朝上,弓背屈曲,用Sonosite便携式超声仪定位T7棘突下缘旁开2 cm区域为穿刺点;将超声探头垂直于脊柱中线,在穿刺点旁扫查可见横突和肋骨为强回声结构并有声影在其下方,横突旁可见随着呼吸运动的强回声亮线,即壁层胸膜,椎旁间隙在图像上显示为楔形低回声;1%利多卡因穿刺点局部浸润,采用平面内进针法,在超声实时引导下将20 G阻滞针缓慢进针,回抽无血、气和脑脊液后,将0.375%罗哌卡因20 ml注射至椎旁间隙,可见局部麻醉药将壁层胸膜下压,观察扩散范围;15 min后测试麻醉平面,阻滞范围不小于T7~T9为穿刺成功;泵注右美托咪定,方法同C组。
1.3 观察指标 比较两组T0、穿刺时(T1)、微波消融开始后5 min(T2)、微波消融结束退针时(T3)、术后30 min(T4)的平均动脉压、心率、血氧饱和度(oxyhemoglobin saturation,SpO2)、脑电双频指数(bispectral index,BIS)、Ramsay评分[3],术中舒芬太尼用量,围术期不良反应发生率,以及T4、术后1 h(T5)、术后2 h(T6)、术后3 h(T7)的视觉模拟评分法(visual analogue scale,VAS)评分。
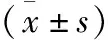
2 结果
2.1 两组各时间点平均动脉压比较 C组:与T0比较,T1时的平均动脉压升高,差异有统计学意义(P<0.05)。P组:T0、T1、T2、T3、T4时的平均动脉压两两比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组各时间点平均动脉压比较
2.2 两组各时间点心率比较 C组:与T0比较,T1时的心率升高,差异有统计学意义(P<0.05)。P组:T0、T1、T2、T3、T4时的心率两两比较,差异均无统计学意义(P>0.05)。见表2。

表2 两组各时间点心率比较
2.3 两组各时间点SpO2、BIS及Ramsay评分比较 P组T1、T2、T3时的SpO2均大于C组,差异有统计学意义(P<0.05)。P组T1、T2、T3时的BIS均大于C组,差异有统计学意义(P<0.05)。P组T1、T2、T3、T4时的Ramsay评分均大于C组,差异有统计学意义(P<0.05)。
2.4 两组术中舒芬太尼用量比较 P组术中舒芬太尼用量明显少于C组[(3.1±2.6)μg比(5.6±2.6)μg],差异有统计学意义(P<0.05)。
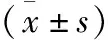
表3 两组各时间点SpO2、BIS及Ramsay评分比较
2.5 两组围术期不良反应发生率比较 C组术中出现5例(16.7%)呼吸抑制,经面罩辅助通气后恢复,术后3 h内出现4例(13.3%)恶心(其中1例呕吐);P组未出现不良反应。P组围术期不良反应发生率低于C组,差异有统计学意义(P<0.05)。
2.6 两组各时间点VAS评分比较 C组静息状态下、咳嗽状态下T4、T5、T6、T7时的VAS评分均高于P组,差异有统计学意义(P<0.05)。见表4。

表4 两组各时间点VAS评分比较分)
3 讨论
静脉麻醉下行肝癌微波消融术常需要追加全身麻醉药达到较深的镇痛水平以维持麻醉深度,因此,易出现术中血流动力学波动,甚至呼吸抑制等情况;而对于特殊部位的肿瘤,术中常需要患者与术者配合完成吸屏气动作,静脉麻醉很难达到。此外,肝癌微波消融术后部分患者疼痛明显,单纯静脉麻醉难以达到良好的术后镇痛效果。有研究表明,静脉应用阿片类药物对术后疼痛有明显改善作用,但要达到完善的术后镇痛,需要增加长效阿片类药物的剂量,而与之伴随的是不良反应的增加,如恶心呕吐、呼吸抑制、痛觉过敏、嗜睡等[4]。因此,如何更好地维持术中麻醉和控制术后疼痛是麻醉医师面临的一个难题。虽然目前阿片类药物仍然是临床医师用于镇痛的主导药物之一,但随着对阿片类药物不良反应及其药物耐受性方面的认识逐渐增多,平衡镇痛和多模式镇痛治疗理念被越来越多的临床医师采纳。多模式镇痛是联合应用不同作用机制的镇痛药物或不同的镇痛措施发挥增强镇痛、减少不良反应和药物用量的作用。持续的多模式镇痛方式可覆盖整个围术期,减轻甚至消除术中应激创伤引起的疼痛及术后疼痛,从而取得完全、长时间的有效镇痛。多模式镇痛被看作是传统镇痛模式的变革和镇痛“快通道”[5],可以提供良好镇痛和确保围术期安全[6]。
Piccioni等[7]研究报道,TPVB应用于肝肿瘤射频消融术安全有效。其原因在于:TPVB只产生一侧邻近多个节段的躯体和交感神经阻滞,对心血管功能影响较小,阻滞区域局限,血管扩张不明显,血流动力学稳定[8-9]。0.375%罗哌卡因20 ml用于TPVB能够提供良好的镇痛效果,且不会阻滞肋间肌和膈肌,不影响呼吸运动。右美托咪啶是一种选择性的α2受体激动剂,具有镇痛、镇静、抗交感作用,且呼吸抑制作用轻微[10],可提高患者手术满意度,减少阿片类药物的用量,降低其对手术刺激的应激反应,有助于维持患者血液动力学稳定,目前被广泛应用于各科手术的清醒镇静麻醉[11]。
综上所述,在超声引导下肝癌微波消融术中采用TPVB复合右美托咪定可改善术中镇痛镇静效果,稳定血流动力学,降低不良反应发生风险。
