1-磷酸鞘氨醇对大鼠血管平滑肌细胞增殖与凋亡水平影响
2021-11-06赖晓蕊徐境一李嘉宝
张 茜, 张 丹, 周 楠, 赖晓蕊, 徐境一, 李嘉宝, 王 鑫, 杨 蕾
北部战区总医院 营养科,辽宁 沈阳 110016
血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖与凋亡在动脉粥样硬化等一系列心血管疾病中起关键作用,血管重塑是其最主要的机制之一,主要来源于血管损伤后VSMC的增殖和凋亡水平异常[1]。细胞增殖和凋亡涉及多种细胞内信号分子。有研究报道,鞘磷脂在心肌梗死、高血压、中风、2型糖尿病和肥胖症等多种疾病的发病机制中起着关键作用[2-3]。鞘磷脂是细胞膜的生物活性成分,也是细胞信号转导的重要因子,参与细胞增殖、成熟和凋亡等多个过程。常见的鞘磷脂家族包括神经酰胺、鞘氨醇和1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P),均已经被证明在细胞中发挥重要的结构和调节作用[4]。近年来,神经酰胺和S1P已成为许多研究的靶点。S1P是一种神经酰胺衍生物,具有抗炎和促有丝分裂的功能,在心脏保护中起重要作用。S1P调节多种生理过程,包括免疫监视、免疫细胞转运、血管发育、细胞存活、血管生成、细胞分化和胚胎神经发生,并被证明参与类固醇合成的调节[5]。S1P是控制细胞存活、炎症和细胞迁移的关键代谢产物。在血液中观察到高水平的S1P,特别是在高密度脂蛋白和红细胞中[6]。在心血管系统内,S1P介导各种活动,包括缺血/再灌注损伤后的心肌保护、改善内皮功能、缓解氧化应激和抗血栓[7]。患者来源的内皮细胞在后肢缺血的小鼠模型中显示新生血管能力显著受损,在静脉输注前用S1P预处理2 h后,患者来源的内皮细胞显著促进了缺血后肢的血流恢复[8]。但关于S1P对VSMC的作用机制尚未阐明。本研究初步检测了大鼠VSMCS1P受体的表达情况,并探讨了S1P对大鼠VSMC增殖和凋亡的影响。现报道如下。
1 材料与方法
1.1 实验材料 实验动物:雄性Wistar大鼠10只,体质量120~160 g,由北部战区总医院动物中心提供。青霉素-链霉素购自Solarbio公司;DMEM细胞培养液、胎牛血清购自康宁公司;胰蛋白酶购自美国Gibco公司;Trizol裂解液购自日本Takara公司;所有一抗均购自Abcam公司;电化学发光检测试剂盒购自Millipore公司;S1P购自Sigma公司;胰蛋白酶购自Gibco公司。
1.2 研究方法
1.2.1 大鼠VSMC分离和培养 颈椎脱臼处死大鼠,无菌条件下打开胸腔,分离胸腹主动脉并放入盛有无菌PBS的细胞培养皿中,用镊子轻轻剥离血管外结缔组织,放入另一盛有无菌PBS的培养皿中。用眼科剪沿纵轴剪开血管条,无菌镊轻轻刮除内膜,放入含20% FBS的高糖培养基中。用眼科剪剪碎血管条,使组织块大小约1 mm×1 mm×1 mm,用无菌滴管将组织块吸入细胞培养瓶,使其均匀贴壁,间距0.2~0.5 cm。向瓶内注入适量培养液,于37℃孵箱内直立放置4~5 h后,将培养瓶慢慢翻转平放,此后每3 d换液1次,生长至3~8代用于实验研究。
1.2.2 大鼠VSMC鉴定 在24孔板中铺片,接种大鼠VSMC,待细胞融合度约为60%~70%时弃去培养基,PBS清洗玻片,4%多聚甲醛固定,0.1% TritonX-100破膜,5% BSA封闭,加入工作浓度的抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体,孵育过夜;PBS洗3次,加入工作浓度的荧光二抗,室温避光孵育45 min,PBS冲洗后染DAPI,荧光显微镜下观察结果并拍照。
1.2.3 实验分组及处理 大鼠VSMC以每孔1×106个细胞的密度接种于6孔板中,每孔2 ml。细胞分组:对照组、S1P 20 nmol/L组、S1P 100 nmol/L组、S1P 500 nmol/L组、S1P 2 500 nmol/L组及S1P 12 500 nmol/L组,每组设2个复孔,实验各组加入S1P培养24 h,然后进行后续实验。以400 μM浓度的H2O2诱导凋亡。
1.2.4 四甲基偶氮唑盐法测定细胞活性 将细胞以1×103个/cm2的密度接种于96孔板中,边缘孔用无菌的PBS填充,每孔加入20 μl四甲基偶氮唑盐(methyl thiazolyl diphenyl-tetrazolium bromide,MTT)溶液,在细胞培养箱培养4 h后去除培养基,每孔加入150 μl二甲基亚砜溶液,待结晶充分溶解后,用微板分光光度计测定490 nm处的光密度值,计算细胞存活率。
1.2.5 原位末端标记法检测细胞凋亡 PBS洗涤细胞,4%多聚甲醛固定30 min,PBS清洗后0.3% Triton X-100室温孵育5 min;按照TdT酶:荧光标记液以5∶45的比例配制原位末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay,TUNEL)检测液,PBS洗涤后加检测液,避光孵育1 h;PBS洗3次,DAPI孵育5 min复染细胞核,PBS清洗后使用防猝灭封片液封片,荧光显微镜下观察并摄片。
1.2.6 Western blot 细胞离心后加入裂解液,冰上裂解后再次离心,采用BCA法测定蛋白浓度。根据样本浓度加入Loading buffer制备蛋白样本,进行蛋白电泳。一抗浓度分别为Bax抗体(1∶500)、Bcl-2抗体(1∶1 000)、cleave-caspase-3 抗体(1∶500)、cleaved caspase-3抗体(1∶1 000)及β-actin抗体(1∶1 000),4℃孵育过夜。PBST洗膜,HRP标记的山羊抗兔二抗(1∶10 000)室温孵育60 min,滴加电化学发光液显影,采用Tanon凝胶成像系统采集蛋白表达信号,并用ImageJ软件分析蛋白条带强度。
1.2.7 RT-PCR 逆转录聚合酶链反应按照TRIzol试剂说明书的步骤进行,引物序列如下:S1P受体(S1P receptor,S1PR)1,F:AACTTTGCGAGTGAGCTGGT,R:CTAGAGGGCGAGGTTGAGTG;S1PR2,F:ATAGACCGAGCACAGCCAAC,R:GAGGTGGTCTCCTGCATGTC;S1PR3,F:AAGCCTAGCGGGAGAGAAAC,R:TCAGGGAACAATTGGGAGAG;S1PR4,F:GGACTTCTCGGTCACTCAGC,R:GGCTTGCTGTCATGTTCTCA;S1PR5,F:GGAGGGACTCTCCTGGATTC,R:TTCCTCTGTAGCCAGCCACT。PCR反应条件:95℃ 2 min,60℃ 30 s,72℃ 40 s,共40个循环,72℃ 10 min,检测大鼠VSMC中S1P受体的表达。

2 结果
2.1 原代细胞鉴定 大鼠VSMC的主要分子标志为α-SMA,利用细胞免疫荧光法检测大鼠VSMC中α-SMA的表达情况,结果显示,提取的原代大鼠平滑肌细胞上α-SMA蛋白呈高表达。见图1。
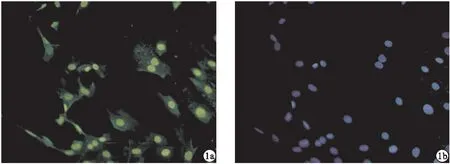
图1 大鼠VSMC免疫荧光化染色结果(a.α-SMA抗体染色;b.DAPI)
2.2 MTT检测S1P对大鼠VSMC增殖的影响 不同浓度的S1P处理组与对照组比较,S1P浓度<500 nmol/L对细胞的增殖活性无明显的抑制作用,反而有一些促进作用,但差异无统计学意义(P>0.05);在S1P 500 nmol/L时,细胞增殖活性达到最高,而S1P浓度在2 500 nmol/L和 12 500 nmol/L对细胞的增殖活性存在一定的抑制作用,差异有统计学意义(P<0.05)。因此,本研究采用的S1P浓度为 500 nmol/L,后续研究不会受到 S1P浓度的影响。见图2。

图2 MTT法检测加药S1P对大鼠VSMC增殖的影响
2.3 S1P受体的表达情况 S1P按500 nmol/L浓度加药处理细胞24 h后,收集细胞进行RNA提取、cDNA反转录和RT-PCR检测S1P受体基因的表达情况。大鼠VSMC主要表达受体S1PR1、S1PR2、SIPR3,而S1PR4和S1PR5表达量很低。S1PR2的基因表达量最高,而S1PR1基因表达量相对较少。见图3。
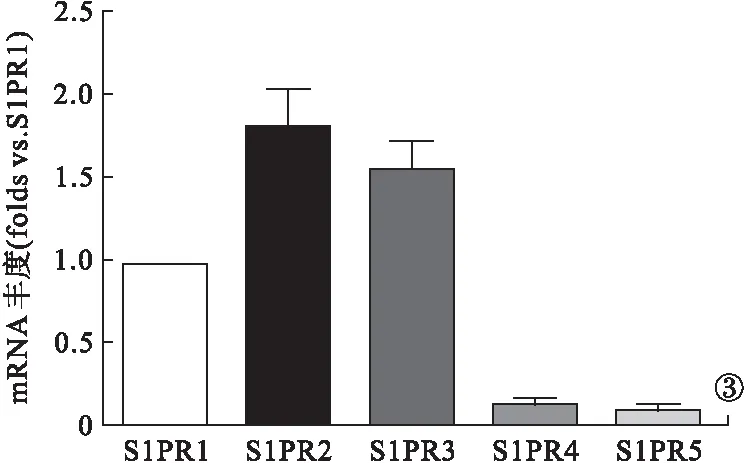
图3 RT-PCR检测大鼠VSMC受体表达情况
2.4 TUNEL染色检测S1P对大鼠VSMC凋亡的影响 TUNEL染色结果显示,400 μM的H2O2溶液能明显诱导VSMC凋亡。与H2O2处理组比较,在H2O2+S1P处理组中,TUNEL染色阳性率明显下降,提示S1P可减弱大鼠VSMC中凋亡水平。见图4。

图4 TUNEL检测S1P对大鼠VSMC凋亡的影响(a.H2O2处理组;b.H2O2+S1P处理组)
2.5 Western blot检测S1P对大鼠VSMC增殖及凋亡水平的影响 以PCNA蛋白表达情况观察S1P对大鼠VSMC增殖的影响,结果发现,S1P处理后PCNA的表达量明显高于对照组,差异有统计学意义(P<0.05),提示S1P可提高大鼠VSMC的增殖能力。见图5。以Bax及Bcl-2蛋白比值和cleave-caspase-3及总caspase-3蛋白比值的变化观察S1P对大鼠VSMC凋亡水平的影响,结果发现,与对照组比较,S1P处理后的大鼠VSMC中Bax与Bcl-2的比值明显降低,差异有统计学意义(P<0.05);cleave-caspase-3与caspase-3总蛋白的比值也显著下降,差异有统计学意义(P<0.05);提示S1P可抑制大鼠VSMC的凋亡水平。见图6。

图5 Western blot检测加药S1P对大鼠VSMC增殖的影响
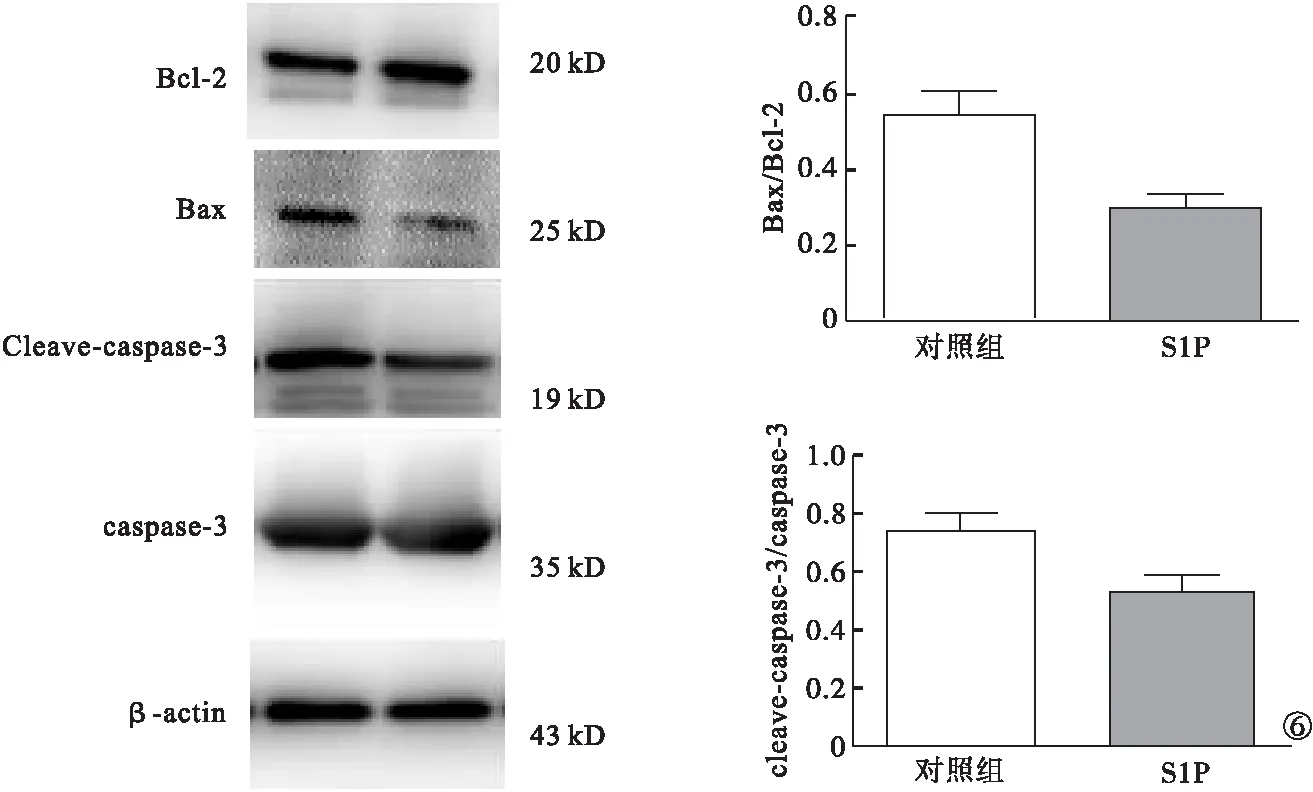
图6 Western blot检测加药S1P对大鼠VSMC凋亡的影响
3 讨论
由高血压、高血糖和高脂血症引起的心血管疾病是全球死亡的主要原因之一。VSMC不仅是血管的主要组成成分,也是动脉粥样硬化斑块的主要细胞成分[9],受血流施加的恒定机械应力的影响。因此,VSMC的增殖、凋亡、迁移、炎症、分化和表型改变与血管重构和动脉粥样硬化等疾病密切相关[10]。然而,引起VSMC病理生理表现的机械力的潜在机制仍不清楚。
鞘磷脂代谢产物神经酰胺、S1P和神经酰胺磷酸盐是调节细胞增殖、存活、胚胎发育、器官发生或免疫细胞运输等关键生理功能的主要信号分子,并参与多种病理过程。S1P是一种有生物活性的鞘磷脂,在不同的器官系统中调节着不同的生理功能。S1P具有5种特异性的细胞表面G蛋白偶联受体(S1PR1、S1PR2、S1PR3、S1PR4、S1PR5),在心血管系统中的作用多种多样,这取决于其产生的细胞类型。S1P对单核细胞的粘附和迁移以及平滑肌细胞的细胞活力有不同的影响,这对动脉粥样硬化的发展至关重要[11]。S1P、S1P受体、Src激酶、CXCR4受体介导的信号对于内皮祖细胞归巢和功能整合到缺血组织是必不可少的[12]。Lee等[13]研究发现,FTY720的S1P受体激动剂促进基质细胞衍生因子-1诱导的人CD34+祖细胞迁移和骨髓归巢。有研究报道,S1P通过rac1和Cdc42信号通路恢复骨髓来源的祖细胞诱导的内皮屏障保护功能[14]。此外,S1P可抑制白细胞与内皮细胞的粘附和随后的迁移,以及内皮细胞中促炎介质的产生。S1P通过S1PR3/PDGFR-β/AKT信号通路诱导内皮祖细胞迁移和血管生成[12]。
VSMC是构成血管壁的主要细胞,心血管疾病(包括高血压、动脉硬化和血管狭窄)与VSMC功能障碍密切相关[15-16]。本研究结果表明,一定浓度的S1P可使VSMC PCNA蛋白表达水平升高,Bax/Bcl-2水平下降。PCNA是一种与细胞增殖相关的蛋白质,可促进DNA损伤耐受,减少细胞凋亡。Bcl-2家族参与细胞凋亡,Bcl-2蛋白为抗凋亡标志物,Bax为促凋亡标志物,Bcl-2/Bax平衡失调可诱导VSMC发生凋亡,参与心血管疾病的发生发展。VSMC增殖和凋亡是心血管发生病变的主要病理基础。本研究结果显示,适量S1P可促进大鼠VSMC增殖,抑制凋亡发生,为 S1P可作为干预靶点治疗以 VSMC为发病核心环节的心血管疾病提供新的思路和实验基础。但由于S1P具有5种特异性细胞表面受体,了解具体哪种受体在改善VSMC的生物学特性中起重要作用还有待进一步研究。
综上所述,S1P信号是众多促血管生长因子的一种重要信号转导分子,可被看作是一种脂类促血管生长因子,在调节血管生成中发挥重要作用。一定浓度的S1P可使VSMC增殖水平升高,凋亡水平下降。
