甲胎蛋白AFP的原核表达、纯化及鉴定
2021-11-06王桂玲吴胜昔谷志鹏龚吕鸿
王桂玲,冉 皑,吴胜昔,谷志鹏,黄 蕾,龚吕鸿
(重庆理工大学 药学与生物工程学院, 重庆 400054)
肝细胞癌(hepatocellular carcinoma,HCC)又称“癌中之王”,是一种常见且致死率极高的恶性肿瘤,在全球恶性肿瘤死亡率中高居第三,严重威胁人类的健康和生命[1]。我国每年约39万人罹患肝癌死亡,数量超过全球肝癌死亡人数的一半。肝癌侵袭力强,经手术切除、肝移植后,患者5年的生存率仅为70%,加上肝癌的预后较差,复发风险较高,因此HCC的早期诊断意义重大[2]。
人甲胎蛋白(alpha-Fetoprotein,AFP)是1个分子量约为70 kDa的糖蛋白,含有591个氨基酸,属白蛋白家族,源于胚胎内胚层组织细胞,主要由胎儿肝细胞及卵黄囊合成[3]。当胎儿发育至12~16周时,可在胎儿的血液循环中检测到高达3 g/L的AFP,妊娠30周达到最高峰,之后逐渐下降。胎儿出生2~3月后,随着干细胞表达下降,体内的AFP转变为白蛋白且在血清中只能检测到微量的AFP蛋白,出生后的第二年接近成人水平,正常人血清中AFP的含量会维持在1个较低水平(<20 μg/L)[4-6]。1964年,前苏联专家Wong等[7]在肝癌患者血清中首次发现AFP,截至目前,AFP被认为是肝癌诊断的最佳生物标志物。肝癌患者表现出临床症状的前8个月时,血清中AFP的含量已经显著升高,因此AFP在临床上广泛用于原发性肝癌的诊断及疗效监测。AFP具有很多重要的生理功能,如运输功能、免疫抑制、T淋巴细胞诱导凋亡、作为生长调节因子的双向调节功能等[8]。血清中AFP浓度的异常增高与多种恶性疾病的发展有密切关系,血清中AFP>400 μg/L并持续一个月以上则提示肝癌高风险。AFP可用于评估肝癌的预后性,浓度升高则提示预后不良。此外,AFP还可用于肝癌高危人群的筛查[9],乙型肝炎性或丙型肝炎性、肝硬化患者每6个月进行一次血清AFP的跟踪随访和腹部超声。目前,肝癌血清标志物AFP的检测方法主要以抗原抗体发生免疫结合反应为基础,然而国内生产的AFP检测试剂的质量不一,国外进口价格昂贵。因此,制备纯度高、特异性强、成本较低的AFP蛋白可为肝癌的早期快速检测提供有效试剂。
1 材料与方法
1.1 菌株与质粒
BL21(DE3)感受态细胞购于上海唯地生物科技有限公司;pET28a(+)质粒载体由重庆理工大学基因工程实验室赠予;pET28a(+)-AFP质粒、pET28a(+)-AFP/DH5α甘油菌是由苏州金唯智生物科技有限公司构建。
1.2 主要试剂及仪器
DNA Marker、QuickCut NdeI、QuickCut XholI限制性内切酶购自TaKaRa;小型质粒提取试剂盒购自北京博迈德基因技术有限公司;6×Loading Buffer购自北京金克隆生物技术有限公司;蛋白质分子质量标准购自安诺伦(北京)生物科技有限公司;卡那霉素和IPTG分别购自赛国生物科技有限责任公司和美国Genview公司;5×SDS-PAGE蛋白上样缓冲液购自biosharp公司;HRP-羊抗小鼠IgG购自美国Proteintech公司;BCA蛋白定量测定试剂盒购自北京鼎国昌盛生物技术有限责任公司;NGC蛋白纯化系统购自美国伯乐生命医学(上海)分公司;Nano-300微量核酸蛋白检测仪购自上海嘉鹏科技有限公司;Amersham Imager 600超灵敏多功能成像仪购自美国GE公司。
1.3 序列分析与合成
根据GenBank上发布的AFP全基因序列(GenBank登录号:NM_001134.2),对AFP基因序列分析及大肠杆菌密码子偏好性优化,在AFP全长基因序列的C-端及N-端各加一组6×His-Tag,以pET28a(+)作为原核表达载体。交由苏州金唯智公司进行基因构建与合成。
1.4 pET28a(+)-AFP重组质粒的酶切与鉴定
用接种环蘸取少量pET28a(+)-AFP/DH5α甘油菌,划线接种于LB固体培养基(含有50 μg/mL卡拉霉素),37 ℃培养30 min后倒置培养过夜。次日,挑取单菌落并接种于5 mL的LB液体培养基试管(含50 μg/mL卡拉霉素),37 ℃,180 rpm,振荡培养12 h,测量菌液的OD600值达0.6~0.8时,利用质粒小量提取试剂盒进行重组质粒的提取。测定pET28a(+)-AFP重组质粒的浓度,确保在下述酶切反应体系中质粒数量可达500~1 000 ng。利用快切酶NdeI、XholI进行双酶切鉴定,反应体系如表1所示,37 ℃酶切反应30 min。对双酶切产物进行0.7%琼脂糖凝胶电泳鉴定,100 V,80 mA,电泳30 min。

表1 pET28a(+)-AFP的双酶切体系
1.5 重组质粒的转化及重组菌的保存
将重组质粒以热激法转入大肠杆菌感受态细胞,具体操作参照文献[10-11]。将转化成功后的pET28a(+)-AFP/BL21(DE3)进行菌种保存,具体操作步骤如下:挑取平板上大而饱满的单菌落,接种到5 mL的LB液体培养基,37 ℃,180 r/min恒温振荡培养过夜,次日,将试管中的菌液同30%甘油溶液(经高压灭菌)按1∶1的比例混匀,长期保存于-80 ℃。
1.6 pET28a(+)-AFP/BL21(DE3)重组蛋白的表达与鉴定
按上述步骤对pET28a(+)-AFP/BL21(DE3)重组工程菌进行单菌落培养并接种至5 mL LB液体培养基,待菌液培养至指数生长期,加入适量浓度的IPTG,150 r/min,诱导扩增8 h。对诱导表达的菌液进行超声破碎,10 000 r/min离心2 min,弃上清,将菌体沉淀用适量的灭菌水重悬,取20 μL沉淀悬液与5 μL 5×SDS上样缓冲液混匀,100 ℃煮沸变性10 min,进行SDS-PAGE电泳鉴定。空载体按照相同条件处理。
1.7 pET28a(+)-AFP重组蛋白诱导表达条件筛选
pET28a(+)-AFP/BL21(DE3)重组工程菌划线接种并培养至5 mL试管,37 ℃振荡培养至菌液的OD600值达0.6~0.8时,将各试管按诱导温度梯度(16、25、30、37 ℃)、IPTG浓度梯度(0.1、0.3、0.5、0.75、1 mmol/L)及时间梯度(2、4、6、8、10、12 h)进行诱导条件筛选。利用SDS-PAGE电泳对样品进行鉴定,从而得到AFP重组蛋白大量表达的最佳诱导表条件。
1.8 pET28a(+)-AFP/BL21(DE3)重组工程菌的扩大培养
按照上述步骤扩大培养AFP重组基因工程菌后,根据筛得的最佳诱导条件使菌液大量表达AFP重组蛋白。
1.9 重组蛋白pET28a(+)-AFP包涵体的处理及纯化AFP重组蛋白
1.9.1包涵体处理
按上述步骤对pET28a(+)-AFP/BL21(DE3)工程菌进行二次活化,以最佳诱导条件大量表达AFP重组蛋白,10 000 rpm,4 ℃离心10 min后弃上清,向沉淀中加入PBS(1∶30)。10 000 rpm,4 ℃离心10 min后弃上清,向沉淀中加入裂解液(1∶20)和PMSF(1∶100),超声破菌,14 000 rpm,4 ℃低温离心15 min后弃上清并收集包涵体沉淀。向沉淀中加入裂解液(1∶30),涡旋至沉淀溶解。14 000 rpm,4 ℃离心15 min后弃上清。向沉淀中加入8M尿素(1∶30),4 ℃低速搅拌15 h。将溶解的产物离心(14 000 rpm,4 ℃离心10 min)并收集上清(包涵体粗提液)。
1.9.2亲和层析镍柱纯化AFP重组蛋白
利用NGCTMChromatography System对pET28a(+)-AFP重组蛋白包涵体进行亲和层析纯化,具体操作步骤见文献[12]。
1.10 AFP重组蛋白的Western blot鉴定
取20 μL纯化后的蛋白样品与5 μL 5×SDS上样缓冲液,涡旋仪混匀后置沸水中变性10 min,然后进行SDS-PAGR电泳鉴定。按照Western blot步骤[13]对纯化后的蛋白样品进行特异性鉴定。
1.11 AFP重组蛋白样品的浓度测定
按照北京鼎国昌盛BCA蛋白浓度测定试剂盒的步骤测定AFP重组蛋白样品的浓度,具体操作如下:
1) 配制BSA蛋白标准品溶液:用灭菌的双蒸水稀释蛋白标准品至0、0.1、0.2、0.4、0.6、0.8、1 mg/mL;
2)稀释后的蛋白标准品按照10 μL/孔逐次加到96孔板中,加入10 μL待测蛋白样品,每个样品做3个平行组;
3) 将试剂盒中A液和B液按照50∶1的比例配制工作液,200 μL/孔,将96孔板置37 ℃恒温培养箱中孵育30 min;
4) 提前预热MULTISKAN GO分光光度仪,在562 nm下测得该样品的OD562值,绘制标准曲线以测定AFP重组蛋白的浓度。
2 实验结果
2.1 酶切鉴定结果
用限制性核酸内切酶Nde I和Xhol I对重组质粒pET28a(+)-AFP进行双酶切鉴定,结果如图1所示,在1 875 bp(目的基因)及5 369 bp(空载体pET28a(+))处均出现了核酸电泳条带,此结果与预期相符合,证明pET28a(+)-AFP重组质粒构建成功。测序结果表明该克隆序列各连接位点及阅读框架正确,与预期相符合。
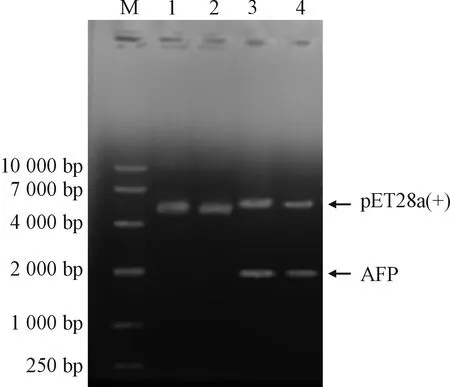
M:DNA分子质量标准;1-2:未酶切质粒;3-4:重组质粒经Nde I、Xhol I双酶切图1 重组质粒pET28a(+)-AFP的酶切鉴定
2.2 重组蛋白pET28a(+)-AFP的诱导表达鉴定
挑取5个pET28a(+)-AFP/BL21(DE3)单菌落,以pET28a(+)/BL21(DE3)菌株作对照,在相同条件下(37 ℃,IPTG浓度为1 mmol/L,150 rpm诱导8 h)诱导表达,诱导后的菌液经超声破碎和离心,用适量的灭菌水对菌体沉淀重悬,SDS-PAGE电泳鉴定结果如图2所示,5个AFP重组单菌落在经过相同条件诱导后,在75 kDa处均出现诱导表达的蛋白条带,pET-28a(+)/BL21(DE3)菌株在此处没有出现相应的蛋白条带,未诱导对照组只是少量表达,此结果与预期计算的分子量大小一致,说明该重组菌可成功表达AFP重组蛋白。
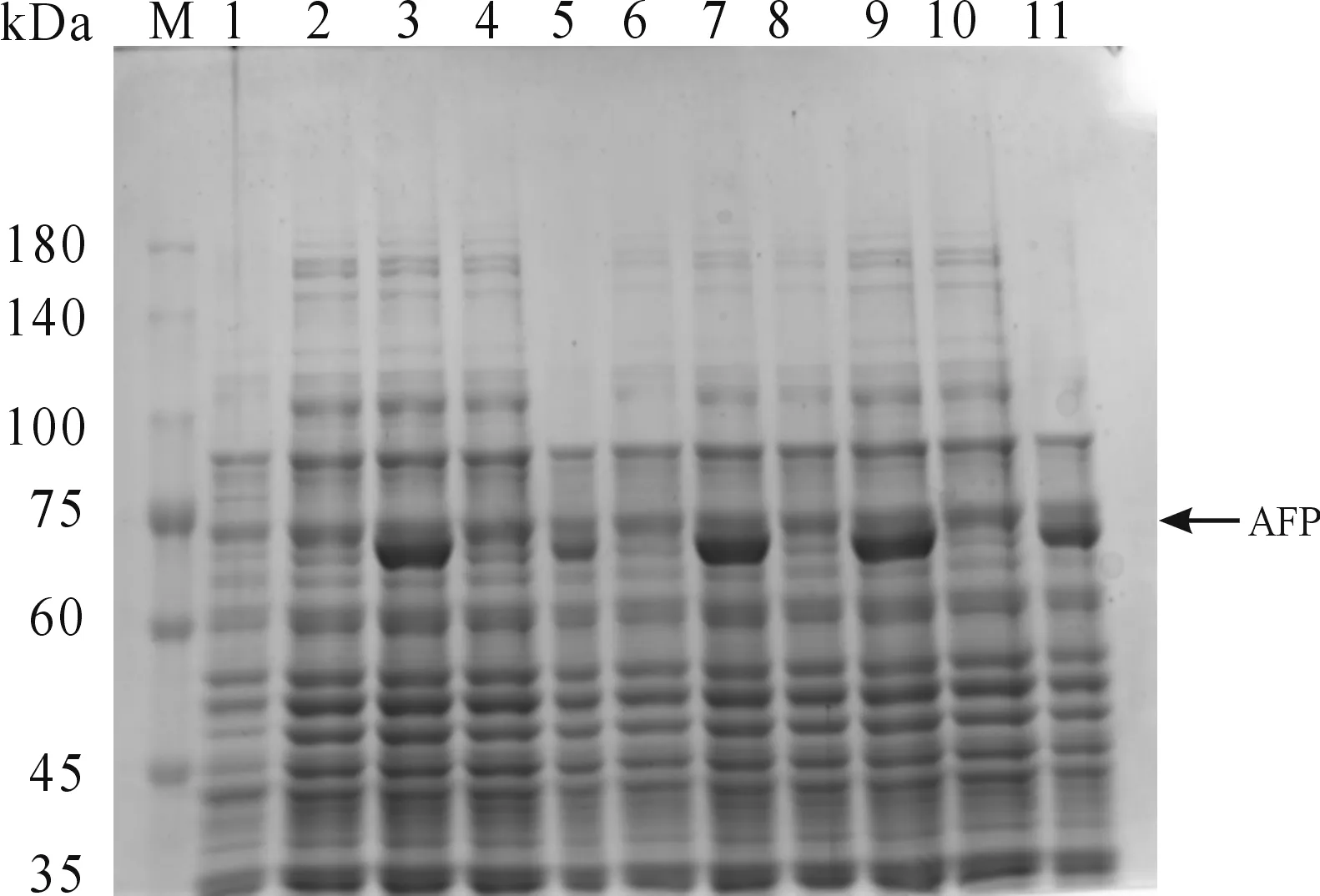
M: 蛋白质分子质量标准;1:pET-28a(+)/BL21(DE3)空白组;2:1号菌诱导前;3:1号菌诱导后4: 2号菌诱导前;5:2号菌诱导后;6:3号菌诱导前;7:3号菌诱导后;8:4号菌诱导前;9:4号菌诱导后;10: 5号菌诱导前;11:5号菌诱导后图2 AFP重组蛋白的鉴定
2.3 pET28a(+)-AFP重组蛋白的最佳诱导条件的筛选
通过对诱导温度,诱导剂IPTG浓度,诱导时间的筛选,获得AFP重组蛋白大量表达的最佳诱导条件:30 ℃,0.1 mM IPTG,诱导8 h。
1) 设定IPTG浓度为1 mmol/L,在4个温度条件(16、25、30、37 ℃)中,150 r/min振荡诱导6 h。结果如图3所示,当诱导温度为30 ℃,AFP重组蛋白的表达量更高,故选择30 ℃为AFP重组蛋白的最佳诱导温度。
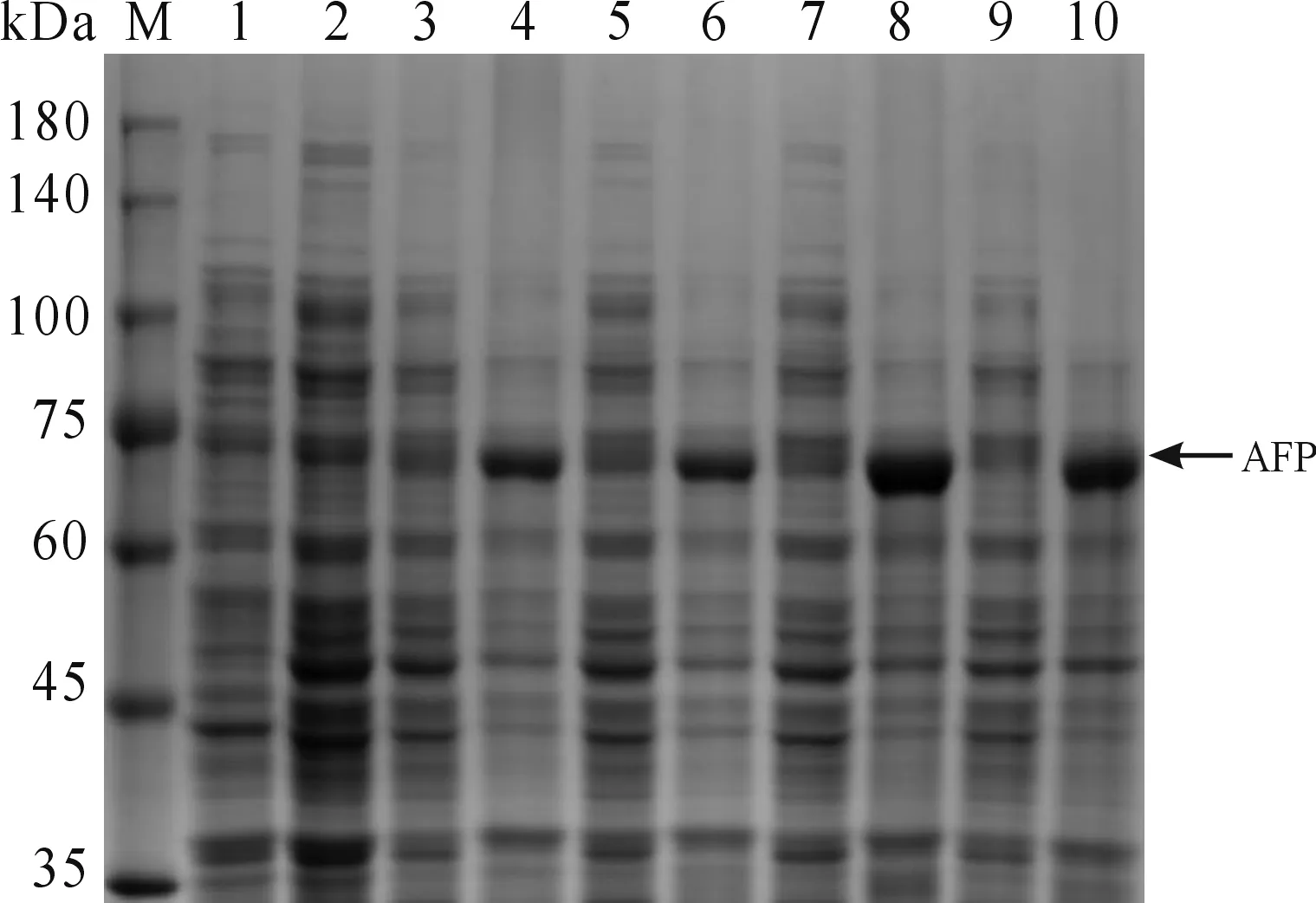
M: 蛋白质分子质量标准;1: pET-28a(+)/BL21(DE3)空白组;2: 未诱导对照;3:16 ℃诱导上清;4: 16 ℃诱导沉淀;5: 25 ℃诱导上清;6: 25 ℃诱导沉淀;7: 30 ℃诱导上清;8: 30 ℃诱导沉淀;9: 37 ℃诱导上清;10: 37 ℃诱导沉淀图3 重组蛋白AFP的最佳诱导温度筛选结果
2) 当诱导温度为30℃,设定5个IPTG浓度(0.1、0.3、0.5、0.75、1 mmol/L),150 r/min振荡诱导6 h。结果如图4所示,当IPTG浓度为0.1 mmol/L,AFP重组蛋白的表达量更高,故选择0.1 mmol/L的IPTG为最佳诱导剂浓度。
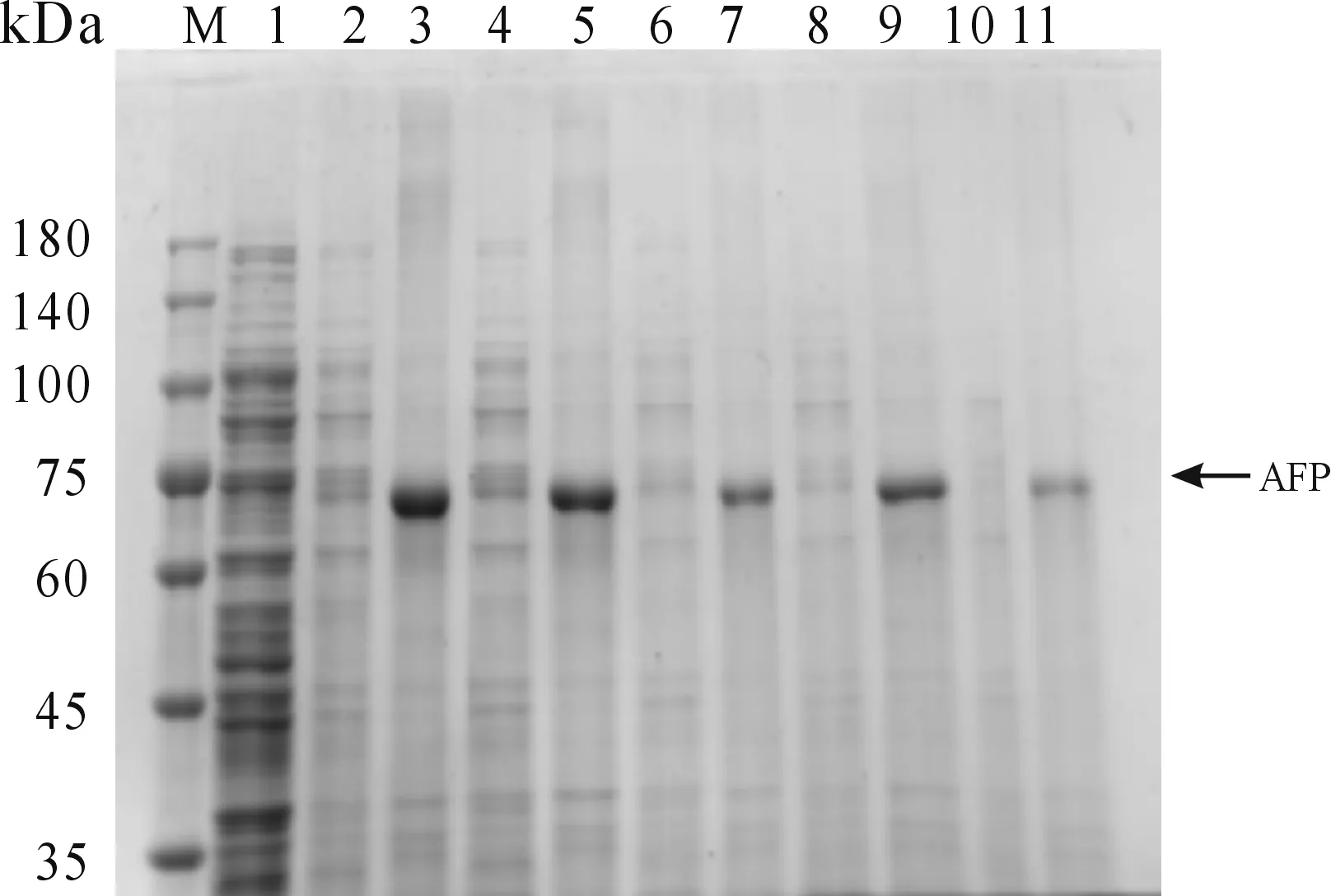
M:蛋白质分子质量标准;1:未诱导对照;2:0.1 mmoL/L诱导上清;3:0.1 mmoL/L诱导沉淀;4:0.3 mmoL/L诱导上清;5: 0.3 mmoL/L诱导沉淀;6:0.5 mmoL/L诱导上清;7:0.5 mmoL/L诱导沉淀;8:0.75 mmoL/L诱导沉淀.9:0.75 mmoL/L诱导沉淀;10:1 mmoL/L诱导上清;11:1 mmoL/L诱导沉淀图4 重组蛋白AFP最佳诱导剂浓度筛选结果
3) 当诱导温度为30 ℃,IPTG浓度为0.1 mmol/L时,150 r/min振荡诱导2、4、6、8、10、12 h。结果如图5所示,当诱导时间为8 h或10 h时,AFP重组蛋白的表达量较高,综合确定最佳诱导时间为8 h。
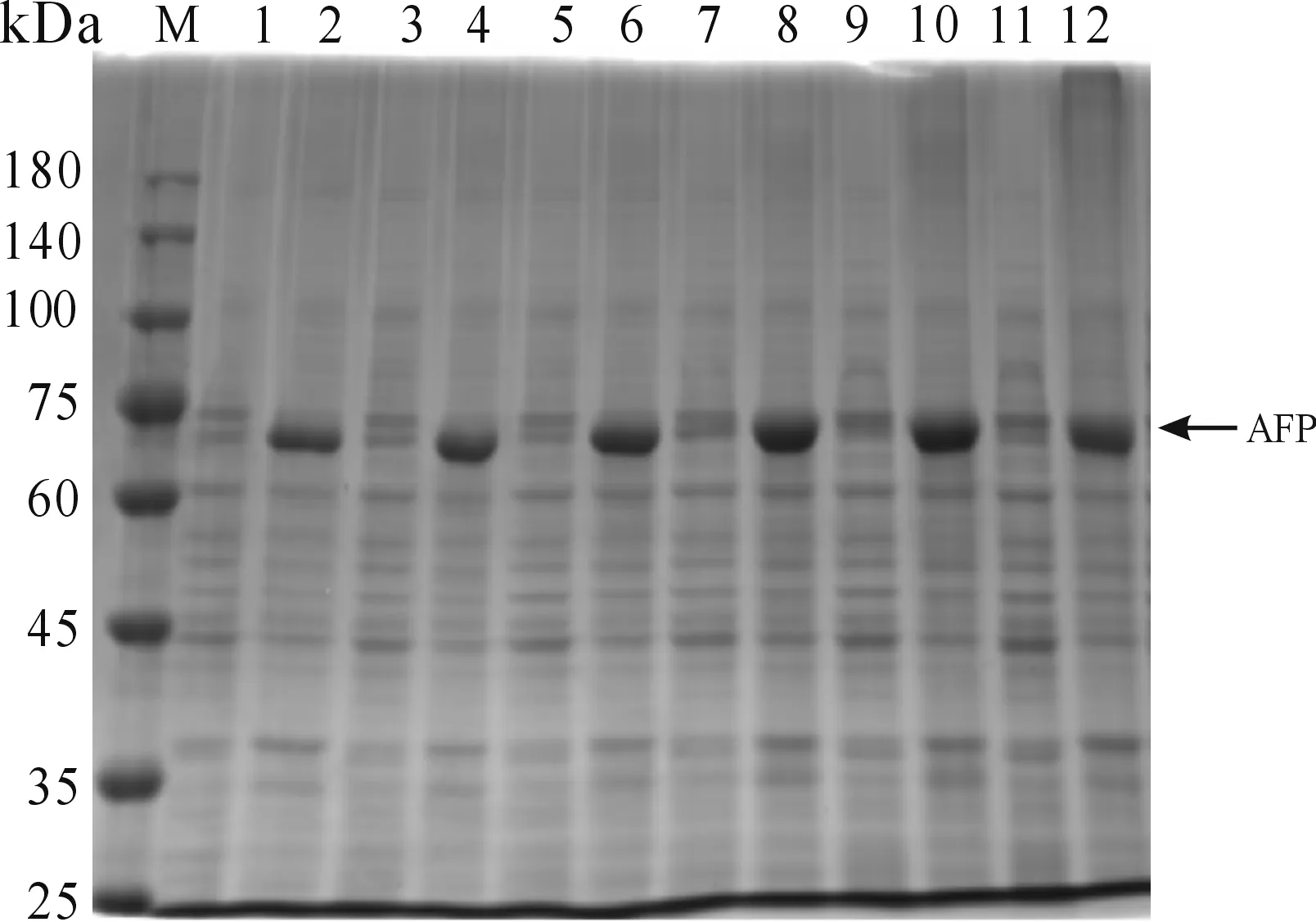
M:蛋白质分子质量标准;1:2h诱导上清;2:2 h诱导沉淀;3:4 h诱导上清;4:4h诱导沉淀;5:6 h诱导上清;6:6 h诱导沉淀;7:8 h诱导上清;8:8 h诱导沉淀9:10 h诱导上清;10:10 h诱导沉淀;11:12 h诱导上清12:12 h诱导沉淀图5 重组蛋白AFP最佳诱导时间筛选结果
2.4 AFP重组蛋白的纯化
按照最佳诱导条件获得大量表达的AFP重组蛋白后,通过洗涤包涵体、溶解变性、纯化及蛋白复性,获得AFP重组蛋白。如图6所示,300 mM的咪唑可将AFP目的蛋白完全洗脱。收集280 nm紫外吸收峰下的AFP重组蛋白样品并进行SDS-PAGE电泳纯度鉴定,结果如图7所示,纯化后的AFP重组蛋白分子量与预期相符且纯度较高。
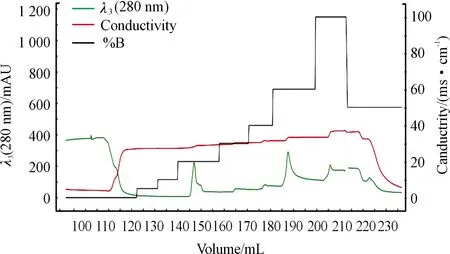
图6 NGCTM亲和层析系统纯化AFP重组蛋白图谱

M:蛋白质分子质量标准;1-12:纯化后的重组蛋白AFP;13:纯化前的样品图7 pET28a(+)-AFP重组蛋白纯化鉴定
2.5 重组蛋白pET28a(+)-AFP的Western blot鉴定
Western blot结果显示:实验组(1-2)在75KD处有明显的蛋白印迹出现(见图8),pET28a(+)/BL21(DE3)对照组(3-4)无条带,表明经Ni柱纯化后制得的AFP重组蛋白特异性良好。
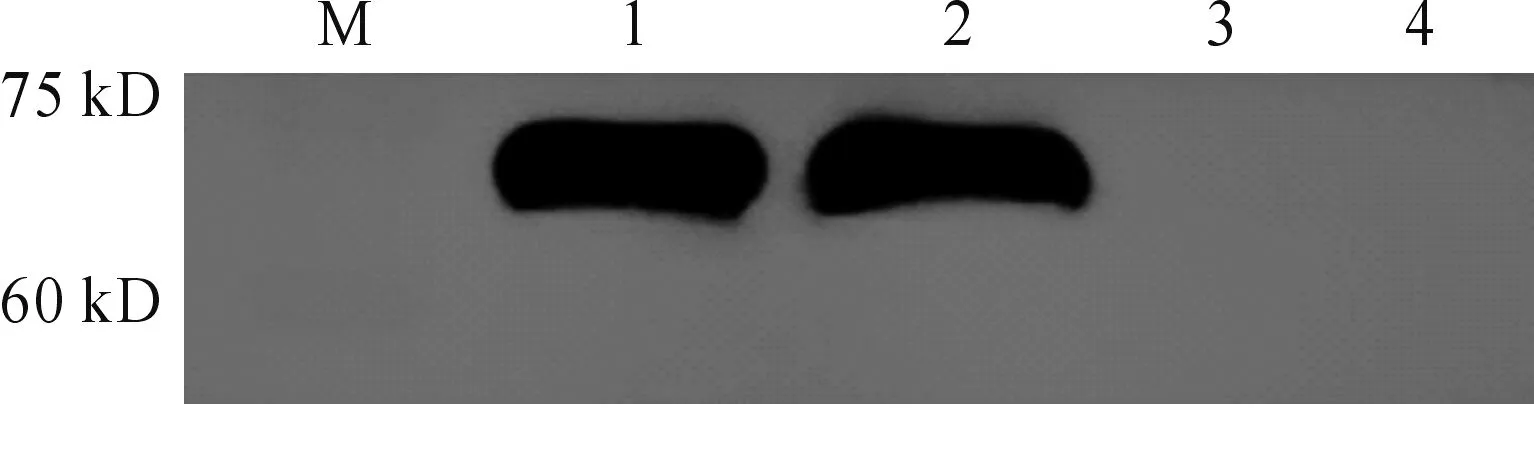
1-2:重组蛋白AFP;3-4:pET-28a(+)/BL21(DE3)空白组图8 重组蛋白AFP Western blot 鉴定
2.6 重组蛋白AFP的浓度测定
用BCA法测定AFP重组蛋白的浓度,结果如表2所示。标准曲线如图9所示,其中,回归方程式:y=1.852 6x-0.238 7,R2=0.999 1,线性关系良好。

表2 pET28a(+)-AFP浓度测定
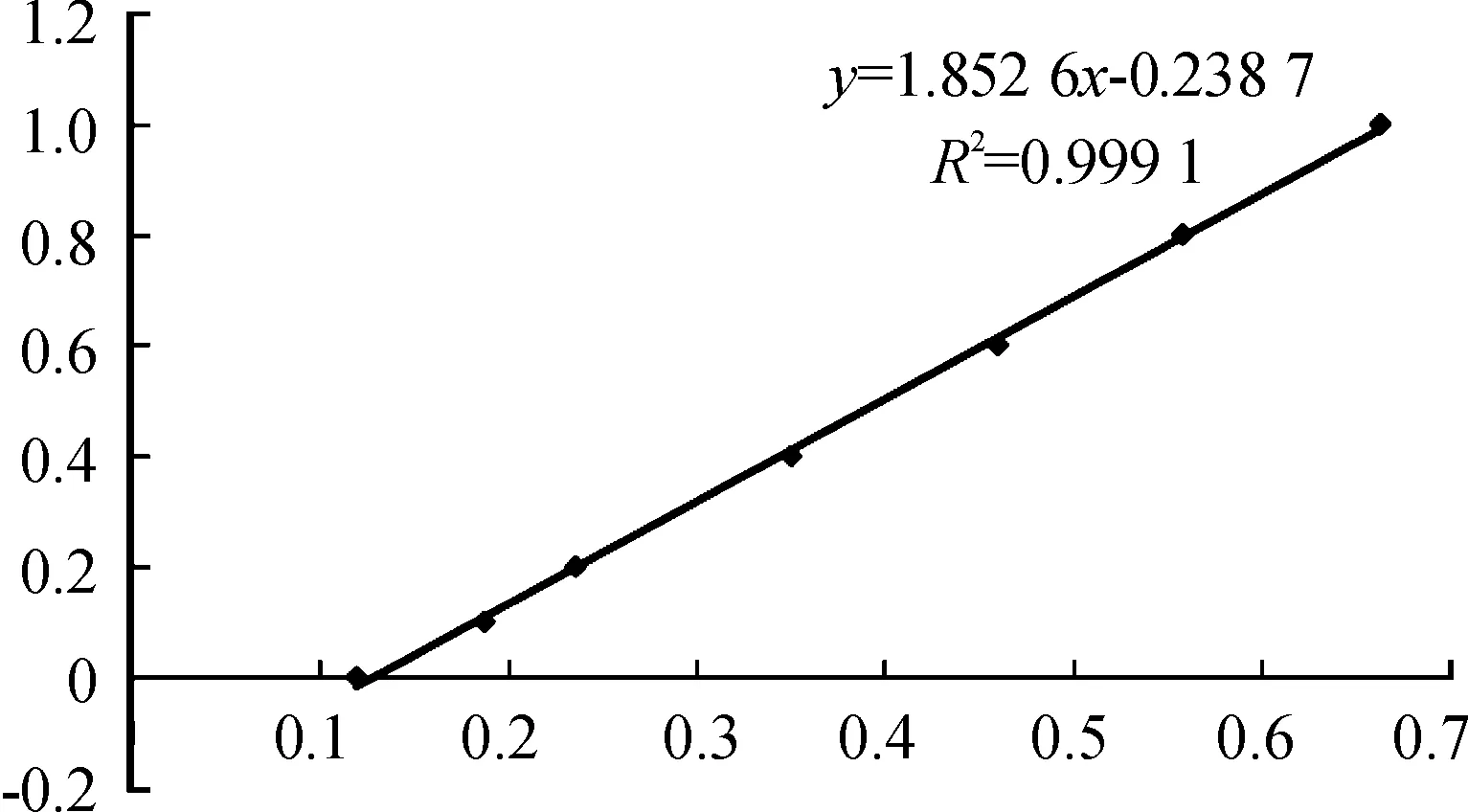
图9 重组蛋白AFP浓度测定标准曲线
3 结论
1) 大肠杆菌表达系统分子遗传结构清楚、操作简单,生长迅速、适于大规模发酵经济,利用该系统制备AFP重组蛋白具有操作简单、经济实用的优势。
2) 本研究选择pET28a(+)作为原核表达载体,可使AFP目的基因高效表达。AFP全长基因序列两端各加的一组6×His-Tag有助于AFP重组蛋白与Ni柱上的金属离子螯合,从而实现杂蛋白的有效分离。
3) 通过优化AFP重组蛋白的诱导温度、诱导时间以及诱导剂IPTG浓度,最终确定在30 ℃,0.1 mM的IPTG,诱导8 h的条件下,AFP重组蛋白可大量表达。
4) Ni柱纯化的实验结果证明:目的基因两端的2组6×His-Tag不仅提高了Ni柱纯化的效率,且不会影响AFP蛋白的免疫原性。
5) AFP重组蛋白的Western blot鉴定结果表明:原核表达的AFP重组蛋白与市售AFP单抗可发生强烈的特异性结合。
6) 本研究制得具有良好生物活性且纯度较高、特异性强的AFP重组蛋白,为后续制备AFP单克隆抗体以及AFP抗原检测方法的研究提供了有效试剂。
