新疆荒漠肉苁蓉粗多糖对口蹄疫疫苗抗体和T细胞亚群的影响
2021-11-06张爱莲巴雪丽王丹阳赵兵
张爱莲 巴雪丽 王丹阳 赵兵
(新疆大学生命科学与技术学院 新疆生物资源与基因工程重点实验室,乌鲁木齐 830046)
口蹄疫(foot and mouth disease,FMD)是由口蹄疫病毒(foot and mouth disease virus,FMDV)引起的一种在偶蹄类动物之间传播的疾病,严重危害家畜健康,造成巨大经济损失。疫苗接种作为预防口蹄疫的有效手段被广泛使用,并取得显著成效。由于口蹄疫病毒灭活抗原免疫原性较弱,往往需要添加佐剂才能发挥作用[1-2]。目前,商品化口蹄疫疫苗中常用佐剂是ISA-206油乳剂,它是Thl细胞的激活剂,也能增强体液免疫应答,但其副作用较大。尽管佐剂种类繁多,如常用佐剂(铝盐类佐剂,油水乳剂等)和新型佐剂(MF59,植物多糖等),但是用于口蹄疫疫苗的佐剂仍然有限,主要包括氢氧化铝、司班、轻型矿物油等,均存在不同的缺陷,如免疫效果不理想或毒副作用大等[3-4]。因此,急需研制高效、低毒的口蹄疫疫苗新型佐剂,用于提高疫苗的免疫保护效果,这对于口蹄疫的防治具有积极意义。
中草药在传染病防治中具有广泛的应用前景,中草药治疗人类和动物疾病有着悠久的历史。在疫苗佐剂研究领域,国内外研究者已经从多种中草药中提取多糖成分研究其佐剂效果,如人参多糖、黄芪多糖、茯苓多糖、淫羊藿多糖等,发现其对人类和动物免疫机能有很好的促进作用而成为新型的候选佐剂[5-7]。新疆荒漠肉苁蓉(Cistanche deserticola Y.C.Ma)为列当科植物,是常用的益补类中草药,一直用作滋补食品被人们长期食用。近些年,研究者们主要针对荒漠肉苁蓉多糖的化学结构和药理活性方面开展了大量的研究工作,发现其有效成分主要包括多糖、苯乙醇苷类化合物、生物碱等,其中多糖含量较高,可以调节免疫系统,具有抗氧化、抗衰老等作用[8-9]。前期研究发现荒漠肉苁蓉粗多糖联合OVA免疫小鼠后显著增强了OVA特异性抗体水平,与流感疫苗配伍可以提高流感疫苗的抗体水平[10-11]。鉴于此,本研究以荒漠肉苁蓉粗多糖作为口蹄疫灭活疫苗的候选佐剂,筛选具有显著免疫增强效果、副反应小的水溶佐剂,使荒漠肉苁蓉粗多糖可以有效的应用于口蹄疫疫苗新型佐剂的研制。
本研究以荒漠肉苁蓉粗多糖(Cistanche deserticola crude polysaccharide,CDCP)配伍FMDVAg制备疫苗,肌肉途径免疫ICR小鼠,通过检测免疫后对小鼠体液免疫和细胞免疫反应的影响,并观察其安全性,为高效、安全的口蹄疫疫苗新型佐剂的研制提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF雌性ICR小鼠(20-25 g)购买于新疆医科大学实验动物中心(合格证号SCXK(新)2016-0003),小鼠喂养5 d后进行动物免疫实验。动物实验在新疆生物资源基因工程重点实验室动物房内进行。实验获得新疆大学新疆生物资源基因工程重点实验室动物实验伦理委员会批准,动物伦理批件编号为: BRGE-AE001。
1.1.2 实验材料及试剂 CDCP为实验室制备(多糖含量为60%)[10],用0.9% NaCl溶解,配制粗多糖母液浓度为20 mg/mL的溶液,过滤除菌备用。FMDV-Ag,ISA-206油佐剂来自天康生物股份有限公司。RPMI-1640培养基和胎牛血清为Hyclone公司产品。山羊抗鼠的辣根过氧化物酶标记IgG-HRP购自Southbiotech公司;刀豆蛋白A(ConA)、脂多糖(LPS)和N-四甲基联苯胺(TMB)购自Sigma公司;噻唑蓝(MTT)购自Amresco公司。流式检测用抗体PECD3、APC-CD4、APC-CD8、FITC-CD8、PE-CD44购自BD公司。
1.2 方法
1.2.1 实验分组及免疫 将CDCP溶液、FMDV-Ag、ISA-206油佐剂按照一定的比例混匀,制备成疫苗。雌性ICR小鼠随机分为4组,每组6只,具体分组如下:0.9% NaCl对照组、FMDV-Ag组(146S,0.3 μg/每只小鼠,无佐剂)、FMDV-Ag/CDCP组(146S,0.3 μg/每只小鼠,CDCP 400 μg)、FMDV/ISA-206组(146S,0.3 μg/每只小鼠,ISA-206油佐剂)。肌肉免疫,100 μL/只,于0 d初次免疫和14 d加强免疫。采用同样的免疫策略免疫小鼠后进行淋巴细胞增殖实验,T细胞亚群检测实验。
1.2.2 IgG抗体水平检测 在初免后14 d、21 d、28 d小鼠眼眶采血制备血清,间接酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测抗体水平。方法参考文献[12],简述如下:包被合适浓度的FMDV-Ag到96孔板中,4℃放置12 h。加入5%脱脂奶粉封闭1 h。接着,加入稀释的小鼠免疫后血清,37℃ 孵育1 h。加入稀释的IgGHPR抗体,37℃孵育1 h。加入TMB 底物溶液,显色15-20 min,加入H2SO4溶液终止,酶标仪上检测OD450的值。
1.2.3 脾脏淋巴细胞增殖检测 加强免疫后7 d,制备脾脏单细胞悬液,裂解红细胞,洗涤并离心收集细胞。将细胞计数后,调整浓度为2×106/mL的单细胞悬液加入到细胞培养板中,设置3个复孔,再分别加入合适浓度的FMDV-Ag、ConA、LPS刺激细胞,37℃放置48 h,加入MTT继续培养3-4 h后,弃上清,加入DMSO溶解沉淀,在酶标仪检测OD490的值。计算每组刺激指数(SI):SI=(OD各刺激孔-OD培养基)/(OD未刺激孔- OD培养基)。
1.2.4 T细胞亚群检测 流式细胞术进行表面染色,检测免疫后小鼠脾脏T细胞亚群的表达水平。如上1.2.3所述制备脾单细胞悬液,调整细胞浓度为1×106/mL,用含0.5% 胎牛血清的磷酸缓冲液洗涤细胞,离心后弃上清。细胞分别用流式抗体PECD3、APC-CD4、APC-CD8、FITC-CD8、PE-CD44进行避光染色30 min,加入含0.5%胎牛血清的磷酸缓冲液终止染色,离心弃上清加入300 μL磷酸缓冲液混匀细胞,上机检测。
1.2.5 统计分析 实验数据以平均值±标准差表示,运用FlowJo 7.6处理流式细胞术检测结果,Graph Pad Prism 5.0进行数据统计学分析。不同实验组数据用one-way ANOVA分析后,运用Tukey’s Multiple-Comparison Test分析不同组数据之间的差异性,“*”表示两组数据之间差异显著(P<0.05),“**”表示两组数据之间差异极显著(P<0.01)。
2 结果
2.1 CDCP对血清中FMDV特异性抗体水平的影响
初疫后14 d、21 d、28 d血清IgG的水平呈现逐渐增强的趋势(图1)。初免后14 d和21 d,FMDVAg/CDCP组抗体水平显著高于FMDV-Ag无佐剂组(P<0.05),与FMDV组无显著差异(P>0.05)。初免后28 d,与FMDV-Ag无佐剂相比,FMDV-Ag/CDCP的IgG抗体水平显著提高(P<0.05),但是极显著低于FMDV/ISA-206组(P<0.01)。FMDV-Ag无佐剂组的抗体水平与0.9% NaCl对照组显著差异(P<0.05)。

图1 间接ELISA检测血清中FMDV特异性抗体水平Fig.1 Detection on FMDV-specific antibody by indirect ELISA
2.2 CDCP对脾脏淋巴细胞的增殖作用
初免后21 d,MTT法检测CDCP对脾淋巴细胞的增殖作用。如图2所示,FMDV-Ag体外刺激脾淋巴细胞后,FMDV-Ag/CDCP组的淋巴细胞刺激指数显著高于FMDV-Ag无佐剂组(P<0.05),且与FMDV/ISA-206组无显著差异(P>0.05)。ConA、LPS刺激后,可显著增强脾脏淋巴细胞增殖(P<0.05)。
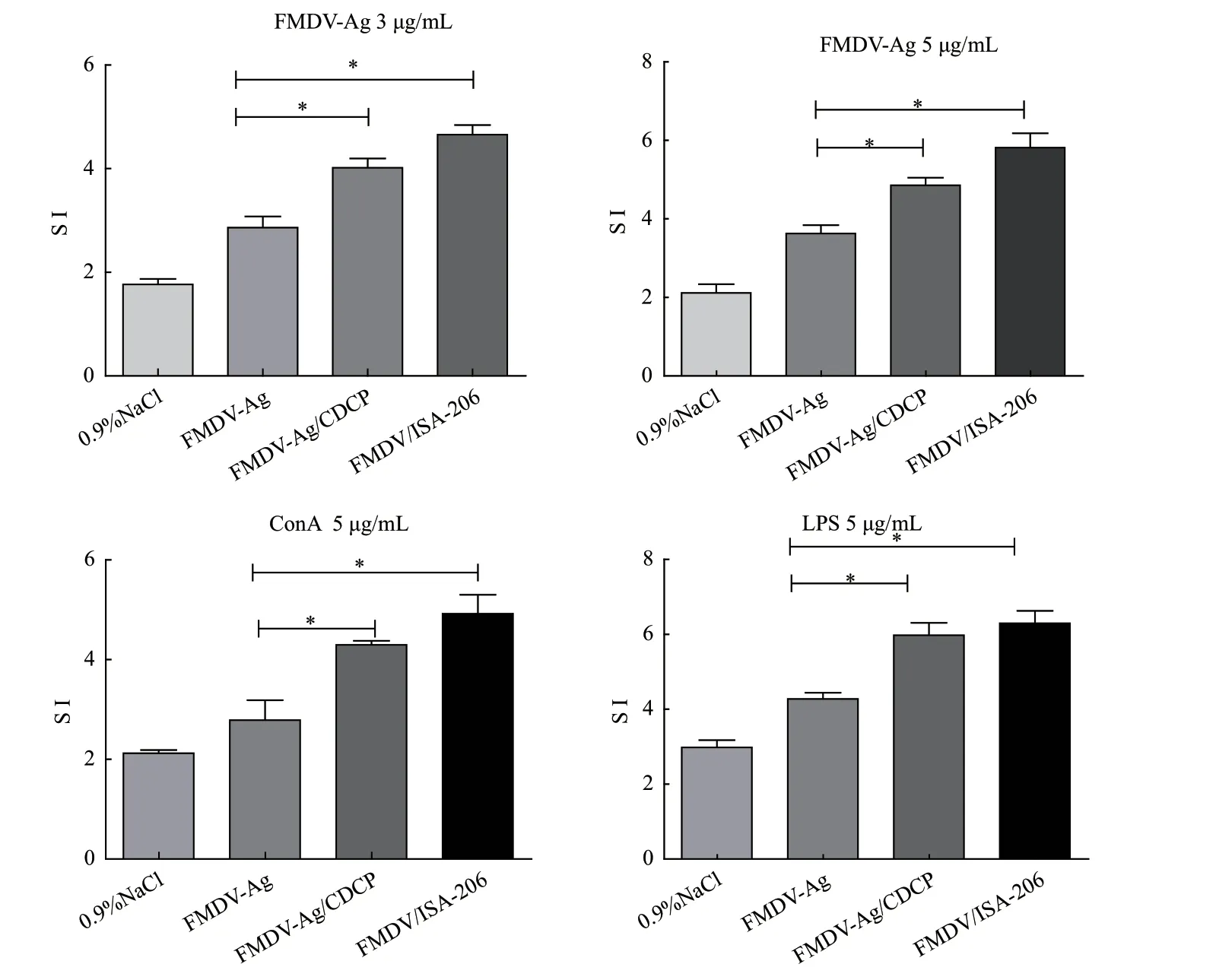
图2 CDCP对淋巴细胞增殖的影响Fig. 2 Effect of CDCP on splenocyte proliferation
2.3 CDCP对CD4+和CD8+ T细胞表达的影响
初免后21 d,检测CDCP配伍FMDV-Ag对小鼠脾脏中CD4+和CD8+T细胞的影响。结果如图3-AD,FMDV-Ag/CDCP组CD3+CD4+和CD3+CD8+T细胞亚群的比例显著高于FMDV-Ag无佐剂组(P<0.05),且与FMDV/ISA-206组之间差异不显著(P>0.05)。FMDV-Ag无佐剂组没有增强CD4+和CD8+T细胞表达。
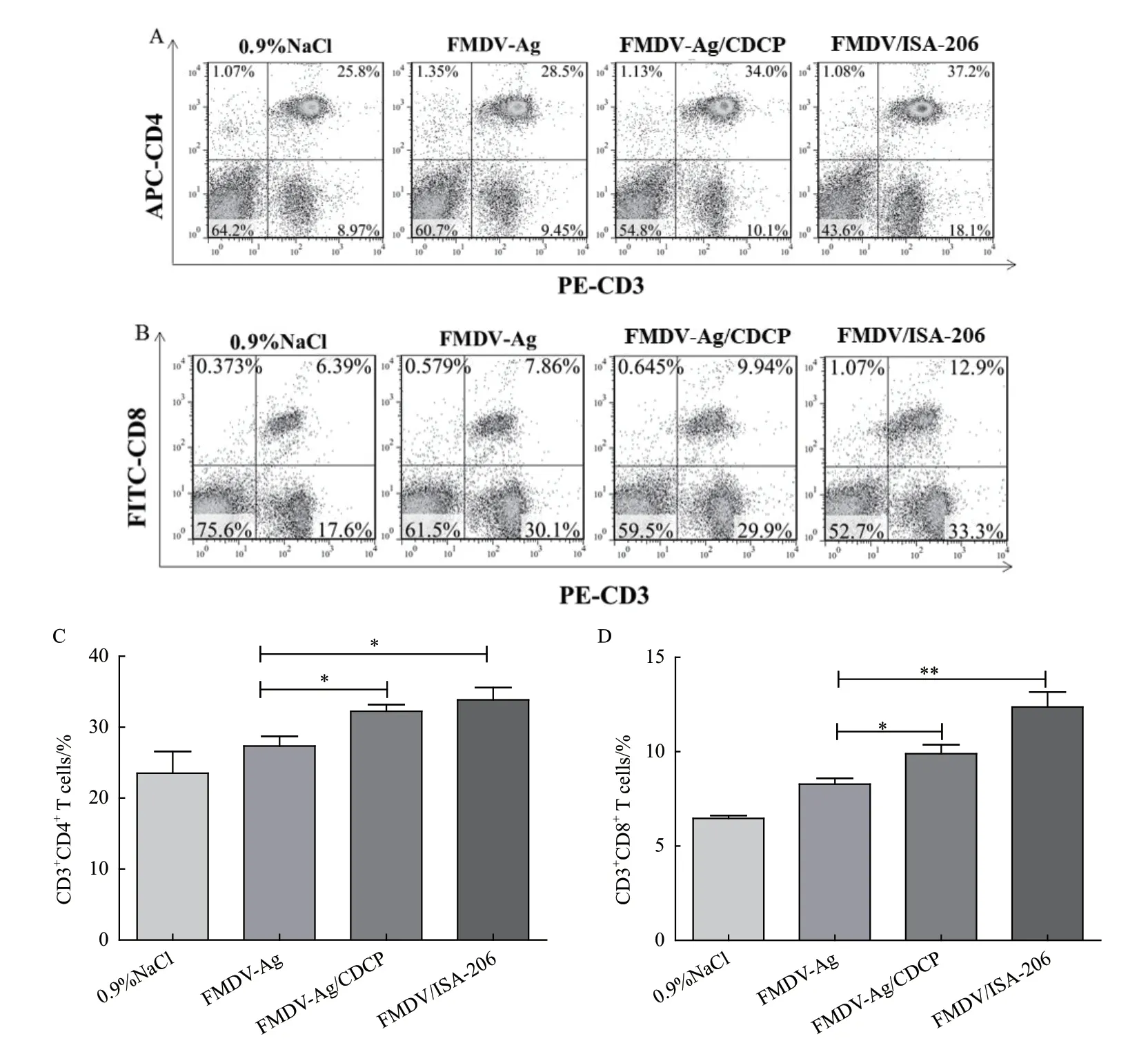
图3 CDCP对CD4+和CD8+ T细胞亚群的影响Fig.3 Effects of CDCP on CD4+ and CD8+ T cell subsets
2.4 CDCP对CD4+CD44+和CD8+CD44+效应T细胞亚群的影响
为观察CDCP对效应T细胞的影响,流式细胞术检测免疫后小鼠脾脏细胞中CD4+CD44+和CD8+CD44+的表达情况。结果如图4-A-D,FMDVAg/CDCP组CD4+CD44+和CD8+CD44+的 百 分 比 显著高于FMDV-Ag无佐剂组(P<0.05),且与FMDV/ISA-206组之间差异不显著(P>0.05)。
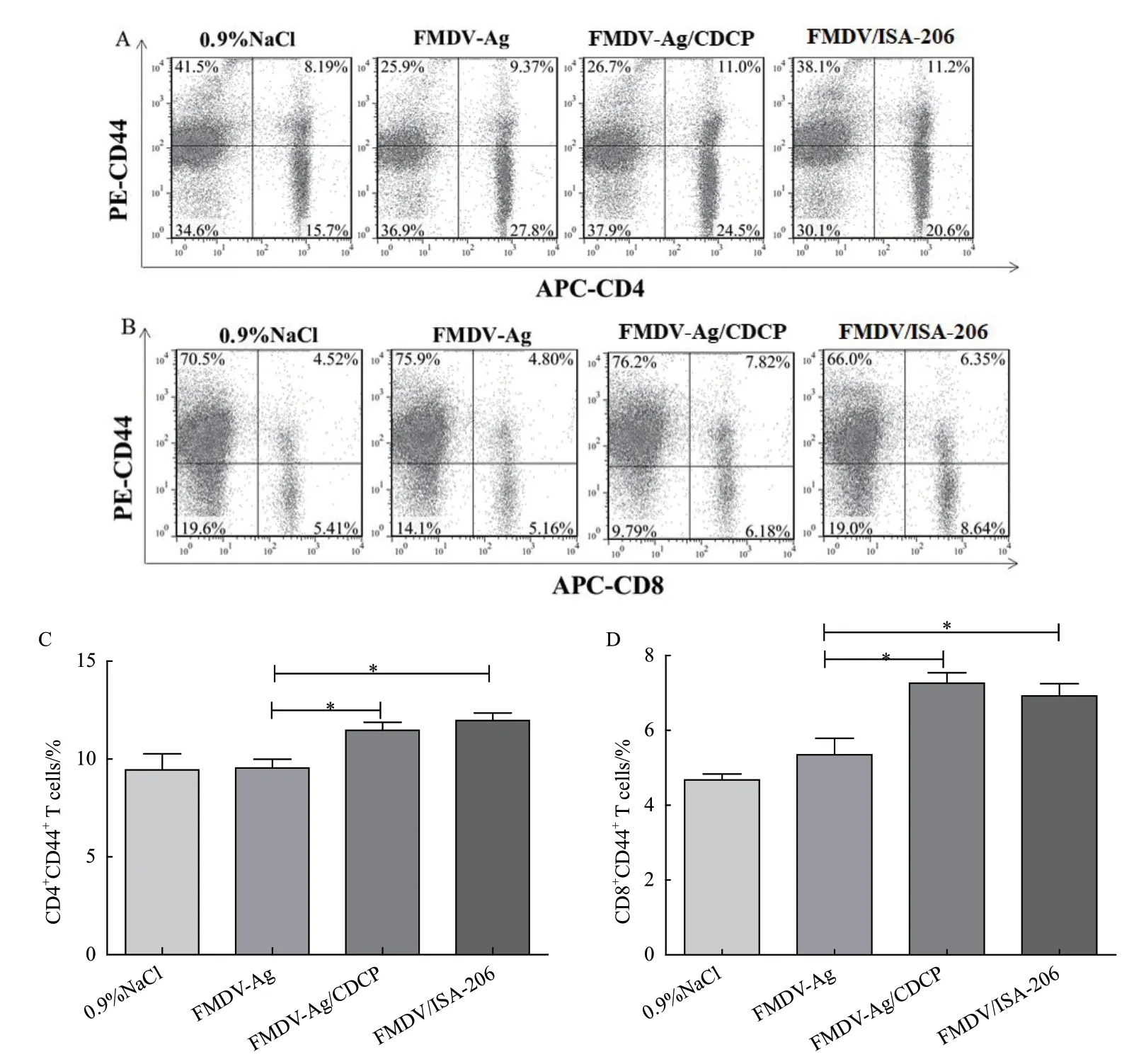
图4 CDCP对CD4+ CD44+、CD8+ CD44+效应T细胞的影响Fig.4 Effects of CDCP on CD4+ CD44+ and CD8+ CD44+ effector T cell
2.5 CDCP对小鼠生长的影响
CDCP通过肌肉途径免疫动物后,整个免疫期间观察小鼠生长情况并每周称量体重,观察注射部位肉芽肿情况(表1)。免疫后小鼠没有脱毛、拒食等现象,免疫后14 d、21 d、28 d每组小鼠体重正常增长,各组间体重没有显著变化(P>0.05)。FMDVAg/CDCP组小鼠注射部位未见肉芽肿,含有ISA 206油佐剂的FMDV疫苗组小鼠注射部位有肉芽肿。

表1 FMDV/CDCP免疫后小鼠体重变化Table 1 Changes in body weight of mice immunized with FMDV/CDCP
3 讨论
佐剂长期以来用于各类疫苗中,可以辅佐疫苗发挥免疫促进作用,降低疫苗用量,对于传染病的防治和流行起到了非常重要的作用[3]。随着新型疫苗的发展,不论是兽用疫苗研究领域还是人用疫苗研究领域,对疫苗佐剂数量上和质量上的要求越来越高了。理想的新型佐剂应该是对机体的细胞或体液免疫均有有效的激发作用、作用持久稳定、免疫次数减少、副作用小,同时便于生产和易于注射[13]。在FMDV灭活疫苗中,通常通过添加油佐剂发挥疫苗的免疫增强作用,但是存在免疫应激大等缺点。水佐剂与油佐剂相比使用简单,可以与疫苗抗原以任意比例互溶,无须乳化,容易注射,因此水佐剂在FMDV疫苗中具有良好的应用前景。
中草药多糖有良好免疫调节作用,加之其在安全性、多效性、无依赖性等方面的优势,成为新型疫苗佐剂研究的一个热点[14]。在FMDV疫苗佐剂研究领域,一些中草药多糖被用于新型佐剂的研究中,如黄芪多糖作为FMDV疫苗的佐剂,通过口服途径免疫能够增强体液和细胞免疫,低剂量抑制树突状细胞的成熟,高剂量可以促进其成熟。研究者们也用白术多糖、杜仲多糖作为FMDV疫苗的佐剂探讨了其免疫增强的作用[15-17]。由于不同中草药的活性成分含量有很大的差别,从具有免疫活性的中草药中进行广泛筛选,寻找合适的佐剂对于疾病防治和人类健康意义重大,也是疫苗学领域中的研究热点。
本实验选用CDCP作为FMDV疫苗的候选佐剂,进行了佐剂效应的实验研究。传染病的防治主要依赖B淋巴细胞介导的体液免疫反应和T淋巴细胞介导的细胞免疫反应[18-20]。由于FMDV疫苗在生产实际采用的是肌肉免疫方式,为此,在实验中选用肌肉途径免疫小鼠,通过评价CDCP对抗体产生和T细胞亚群的影响来评价其免疫增强作用,并进行安全性的初步观察。研究结果表明,免疫后14 d和21 d,肉苁蓉粗多糖可以增强FMDV特异性的抗体水平,且作用和ISA-206佐剂水平没有显著差异;在免疫后28 d的抗体水平低于ISA-206油佐剂,这说明CDCP在免疫后的一定时间内可以增强体液免疫水平。淋巴细胞增殖率与刺激指数的高低呈正相关,在MTT实验中,CDCP可促进FMDV抗原、ConA和LPS刺激的淋巴细胞增殖。在T细胞亚群实验中,CDCP不仅可以提高CD4+和CD8+T细胞的表达,也可以增强CD4+CD44+和CD8+CD44+效应T细胞的水平,且与ISA-206佐剂组没有显著差异;在安全性实验中,发现含有ISA-206的疫苗组注射小鼠后,在注射部位有肉芽肿,而含有CDCP水佐剂的疫苗组没有发现肉芽肿,初步表明了CDCP有良好的安全性,进一步的安全性需要开展相关实验证实。
4 结论
CPCD不仅增强了体液免疫反应,还可以提高淋巴细胞的增殖水平,促进CD4+和CD8+T细胞亚群的水平,活化效应T细胞,在注射后没有发现小鼠注射部位的肉芽肿,小鼠正常生长且没有异常行为。这些研究结果为进一步开展CDCP作为FMDV疫苗的新型佐剂研究提供了基础,也为多糖佐剂在其他疫苗中的应用提供了有益的参考。
