向日葵HaACO1基因的表达分析及功能验证
2021-11-06孙瑞芬张艳芳牛素清郭树春李素萍于海峰聂惠牟英男
孙瑞芬 张艳芳 牛素清 郭树春 李素萍 于海峰 聂惠 牟英男
(1. 内蒙古农牧业科学院,呼和浩特 010031;2. 内蒙古农业大学园艺与植物保护学院,呼和浩特 010011)
生物和非生物胁迫是影响植物生长发育和作物产量的重要因素,抗性相关基因的克隆和功能鉴定对采用基因工程手段改良作物抗性非常重要。乙烯(ethylene)是一种植物激素,在植物生长发育、成熟衰老整个生命活动及盐害、冷害、机械伤害、渍水等逆境胁迫和病原菌入侵中发挥着重要的作用[1]。ACC氧化酶(ACO)是乙烯合成途径中最后一个酶,直接催化ACC合成乙烯,其活性对乙烯生物合成具有重要的调控作用,因此ACO基因的表达是乙烯形成和应答的主要标志。ACO由多基因家族编码,目前,已在多种植物上克隆了ACC氧化酶基因,并对其在植物生长发育、成熟衰老等生育过程及激素、环境胁迫、提高作物抗逆性等方面进行了研究。拟南芥AtACO基因家族的6个成员(AtACO1-AtACO6)均可响应水分胁迫,其中AtACO1基因参与植物发育,特别是根系发育[2]。Yuan等[3]从梨的基因组中鉴定了11个ACO基因,其中8个ACO基因在梨的果实中表达,3个ACO基因可被乙烯诱导,表明乙烯是控制更年期果实成熟过程的主要因素。杨树ACC氧化酶基因Ptre-ACO3和Ptre-ACO6可通过调节乙烯合成而调控杨树秋叶的衰老[4]。Sornchai等[5]通过导入石斛兰CpACO基因反义载体延长了石斛兰花期寿命。孙申申等[6]从“云香”水仙中克隆的新型ACC氧化酶基因NtACOY2参与“云香”水仙花的发育,并且与其花衰老密切相关;在烟草中过表达NtACOY2,2株转基因烟草分别比野生型烟草提前8d和7d开花。吴建阳等[7]的研究表明荔枝Lc-ACO1基因参与调控荔枝幼果脱落。薛丽君从苎麻中获得的BnACO1基因参与ABA、干旱、NaCl 胁迫应答[8]。拟南芥中过量表达棉花GhACO2基因,增强了拟南芥耐盐、耐干旱能力[9]。有关向日葵ACC氧化酶基因相关方面的研究鲜有报道。本研究对前期从盐诱导向日葵中克隆的ACC氧化酶基因HaACO1(GenBank No. KP966508)[10-11]进行了表达分析及耐盐功能验证,为利用该基因进行作物抗逆性状改良奠定基础。
1 材料与方法
1.1 材料
试验在内蒙古农牧业科学院生物技术研究中心进行。将向日葵P50种子种植在实验室蛭石中,待发芽长成幼苗后,分别进行以下处理。(1)按照郭树春等[12]的方法接种黄萎病病菌(V21),取接种0 d(CK)、1 d、3 d、5 d和7 d植 株 的 叶 片。(2)按照孙瑞芬等[11]的方法,用120 mmol/L NaCl处理向日葵幼苗;用镊子夹伤叶片远端边缘并用大头针戳3-5下进行损伤处理;将向日葵幼苗置于4℃冰箱进行低温处理;用5 mmol/L水杨酸喷洒向日葵幼苗。分别取以上不同处理0 h(CK)、2 h、6 h、12 h和24 h植株的叶片。(3)取在1/2 MS营养液中培养4-5 d的向日葵P50幼苗的根、下胚轴和叶片。以上各处理材料于液氮中速冻后,-80℃保存备用。
将本课题组保存的野生型烟草SRI(Nicotiana tabacum)种子,用0.1% HgCl2消毒10 min,无菌水冲洗4-5次,接种到1/2MS固体培养基中,置于植物组织培养室中培养获得无菌苗,备用。新鲜洋葱购自市场。瞬时表达载体pCAM-35S-GFP、植物表达载体pPZP221、农杆菌菌株EHA101由本课题组保存。黄萎病病菌(大丽轮枝菌Verticillium dahlia)菌株V21由内蒙古农业大学赵君教授惠赠。利用Primer Premier 5/64软件设计引物(表1),由南京金斯瑞生物工程技术服务有限公司合成。
1.2 方法
1.2.1 HaACO1在向日葵中的表达分析 利用TaKaRa公司的RNA提取试剂盒(MiniBEST Plant RNA Exteaction Ki)提取各处理样品总RNA,通过微量紫外分光光度计(NanoDrop 2000)测其浓度并稀释到200 ng/μL,以其为模板,利用TaKaRa公司 的PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒合成cDNA。根据HaACO1的ORF序列设计引物F1和R1(表1),以向日葵18S rRNA(No.HM638219)为内参基因(引物为F2和R2),利用TaKaRa公 司 的SYBR®Premix EX TaqTMⅡ(Tli RNaseH plus)进行实施荧光定量PCR反应(qRTPCR),重复3次。通过2-ΔΔCT法计算HaACO1的相对表达量,分析其在向日葵根、下胚轴和叶中的表达量及其在生物和不同非生物胁迫条件下的表达模式。

表1 引物信息Table 1 Primer information
1.2.2 HaACO1亚细胞定位分析 使用ProtComp9.0软件对HaACO1进行亚细胞定位预测。以克隆载体pT-HaACO1[11]为模板,用引物F3和R3(表1)扩增不含终止密码子的HaACO1编码区片段,将其定向连接到瞬时表达载体中的绿色荧光蛋白(GFP)N端,构建融合基因表达载体pCAM-35S-HaACO1-GFP。切取2 cm2×2 cm2新鲜洋葱内表皮于含4%甘露醇的MS高渗培养基上,25℃预培养4 h。分别制备含有融合基因的表达载体pCAM-35S-HaACO1-GFP和空载体pCAM-35S-GFP(CK)的微金弹,通过基因枪(Bio-Rad)轰击洋葱表皮并暗培养24 h以后,利用激光共聚焦显微镜观察洋葱表皮细胞中HaACO1-GFP融合蛋白的瞬时表达情况。
1.2.3 HaACO1的过表达分析
1.2.3.1 HaACO1对烟草的遗传转化 用引物F4和R4(表1)扩增HaACO1基因编码区片段,并定向插入到植物表达载体pPZP221的35S启动子和NOS终止子之间,构建重组表达载体,通过冻融法将其导入农杆菌EHA101感受态细胞中获得转化菌株。采用农杆菌介导法转化烟草叶片并用庆大霉素(50 mg/L)筛选抗性植株。在35S启动子近3'端序列上设计正向引物p-F(表1)和HaACO1下游引物R4对抗性植株进行PCR和RT-PCR扩增,分别检测其在DNA水平和RNA水平上的整合和转录情况。将RNA检测阳性植株与野生型植株进一步扩繁株系。
1.2.3.2 转HaACO1烟草抗逆性鉴定 随机切取3个转基因阳性株系和1个野生型(WT)株系相同部位的叶盘,分别接种于含有0和150 mmol/L NaCl的分化培养基上培养10-15 d,观察叶片颜色变化和分化情况并拍照。
将1个转基因株系与野生型株系组培苗炼苗后转移到液体1/2 MS中培养5 d后,分别经4℃低温、20% PEG6000和150 mmol/L NaCl处理0 h(CK)和24 h取其相同部位叶片,液氮速度后-80℃保存。以烟草EF-1α基因(No. AF120093)为内参基因(引物为F5和R5),用引物F1和R1进行不同胁迫条件下HaACO1的qRT-PCR分析。重复3次。
利用南京建成生物工程研究所的生理生化测定试剂盒,对NaCl处理前、后的转基因株系和野生型株系叶片进行叶绿素、可溶性蛋白质和脯氨酸含量的测定及POD和SOD活性的测定(测定方法按照试剂盒说明书进行)。以烟草EF-1α为内参基因,利用TaKaRa公司的试剂盒进行抗逆相关基因P5CS、POD、MnSOD、GuZnSOD的qRT-PCR分 析。3次重复。
2 结果
2.1 向日葵不同器官中HaACO1的表达分析
qRT-PCR结果表明,HaACO1在向日葵根、下胚轴和叶中均有表达,其中在叶和下胚轴中的表达量均极显著高于根中的表达量(P<0.01),且在叶中的表达量最高(图1),说明HaACO1存在器官特异性表达差异。

图1 HaACO1在向日葵不同器官的表达分析Fig.1 Expression of HaACO1 in different organs of sunflower
2.2 HaACO1对生物胁迫的应答分析
由图2看出,向日葵幼苗接种黄萎病病菌(V21菌株)1、3、5、7 d后分析向日葵叶片HaACO1基因表达情况,发现接种1 d后HaACO1表达量几乎没有变化,但第3天和第7天HaACO1表达量迅速升高,极显著高于0 d(P<0.01),其中第5天较第3天有所降低,到第7天又升高。由于黄萎病病菌侵入而导致的HaACO1表达量变化,表明该基因在生物胁迫防御调控中发挥作用。
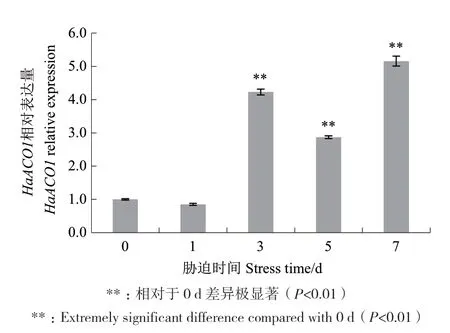
图2 HaACO1在黄萎病病原菌V21诱导下的表达分析Fig.2 HaACO1 expression under the induction of Verticillium wilt pathogen V21
2.3 HaACO1响应非生物胁迫的表达分析
qRT-PCR分析表明,NaCl、机械损伤、低温和水杨酸处理向日葵幼苗均可诱导向日葵叶片中HaACO1基因表达,但胁迫条件不同,其表达模式不同。总之损伤处理后HaACO1的相对表达量变化最显著,依次为水杨酸、低温和NaCl诱导(图3)。

图3 非生物胁迫的不同时间点HaACO1相对表达分析Fig.3 HaACO1 expression at different time under different abiotic stresses
120 mmol/L NaCl处理向日葵幼苗2、12和24 h时,与0 h(CK)相比,HaACO1的相对表达量变化不明显,但呈上调趋势,而胁迫6 h时呈现显著下调表达(P<0.01)。
向日葵受机械损伤处理后,叶片中HaACO1的表达量变化较为明显,总体趋势为先升高后降低。与0 h相比,受损2 h后升高(P<0.01),6 h达到高峰,之后降低,但均极显著高于0 h(P<0.01)。
4℃低温诱导向日葵幼苗后,叶片中HaACO1的表达量也有变化,总体趋势为先升高后降低再升高。与0 h相比,处理2 h后HaACO1的表达量升高且到6 h变化平缓,但均高于0 h(P<0.01),12 h时降低(P<0.05),24 h时又升高(P<0.01),且达到峰值。
5 mmol/L水杨酸处理向日葵幼苗后,叶片中HaACO1的表达量表现出明显的变化,总体趋势为升高-降低-升高-降低。与0 h相比,处理2、6、12和24 h后,HaACO1的相对表达量均较0 h有所增加(P<0.01),2 h时叶片中HaACO1相对表达量最高,24 h时最低。
由此表明,向日葵可通过调节HaACO1表达水平防御非生物胁迫造成的伤害。
2.4 亚细胞定位分析
HaACO1亚细胞定位预测结果表明,HaACO1蛋白主要位于细胞质。构建HaACO1基因融合表达载体pCAM-35S-HaACO1-GFP,通过基因枪轰击转化洋葱表皮细胞,借助激光共聚焦显微镜观察,发现空载体的GFP荧光信号分布于洋葱表皮细胞的细胞膜、细胞质和细胞核各个部位,而HaACO1-GFP融合蛋白的荧光信号主要集中于细胞质(图4),与ProtComp 9.0软件预测结果一致。
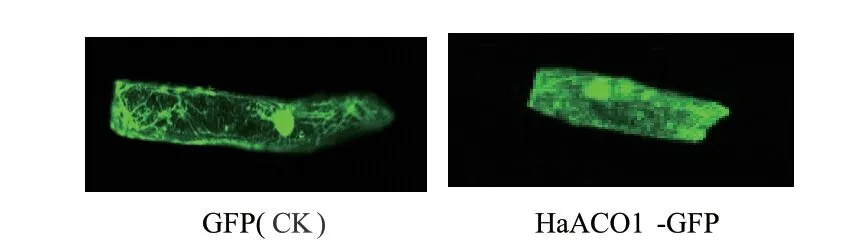
图4 融合蛋白HaACO1-GFP在洋葱表皮细胞中定位Fig. 4 Localization of HaACO1-GFP fusions in onion epidermal cell
2.5 过表达分析
2.5.1 转基因植株获得及分子检测 构建HaACO1基因植物表达载体,通过农杆菌介导法转化野生型烟草,获得了庆大霉素抗性烟草植株。随机选择11个独立的抗性植株(编号1-11)分别进行目的基因HaACO1的PCR和RT-PCR检测。扩增结果显示,11个植株中有10个植株(2-11)获得与阳性对照大小一致的条带(图5-A),表明HaACO1已整合到烟草基因组DNA中;RT-PCR检测结果显示,10个PCR阳性植株中,除5号外其余9个植株均获得与阳性对照一致的目的条带(图5-B),表明该基因在RNA水平上获得表达。扩繁RT-PCR检测阳性植株以备后续试验。
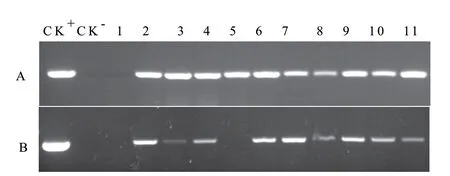
图5 抗性植株的分子检测Fig.5 Molecular test of resistant plants with PCR and RTPCR
2.5.2 转HaACO1烟草抗逆性鉴定 图6结果显示,在不含NaCl的分化培养基上,3个转基因株系(T-4、T-6、T-10)植株离体叶片颜色与野生型烟草均表现正常、分化能力基本一致,而在含有150 mmol/L NaCl培养基上的转基因植株和野生型植株叶片均表现为颜色变浅,分化能力受到抑制,但转基因植株叶片受到抑制的程度较野生型烟草的轻,表明转基因植株较野生型植株对盐胁迫表现出一定的耐受性。

图6 盐胁迫对烟草叶片离体培养的影响Fig.6 Effect of salt stress on in vitro culture of tobacco leaves
对转基因株系T-10进行qRT-PCR分析表明,正常条件下,T-10与WT烟草叶片中HaACO1的相对表达量基本一致,而受到胁迫后,二者叶片中HaACO1的相对表达量均较CK有不同程度的增加,而且无论是低温诱导还是PEG、NaCl诱导,转基因株系T-10中HaACO1的相对表达量均显著高于WT烟草(P <0.01)(图7),表明逆境胁迫诱导了转基因烟草中HaACO1的过量表达。
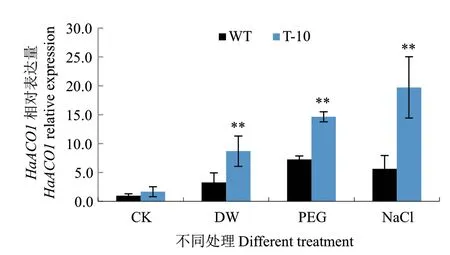
图7 非生物胁迫条件下转基因烟草中HaACO1的表达分析Fig. 7 HaACO1 expression analysis in transgenic plants under abiotic stresses
图8显示,处理前,转基因株系T-10与WT株系叶片的叶绿素、可溶性蛋白、脯氨酸含量和POD、SOD活性均基本一致,而用NaCl处理24 h后,各生理生化指标均有变化。其中T-10和WT叶片中的叶绿素含量均较处理前有所下降,但WT叶片中叶绿素含量下降幅度较T-10下降幅度大,且二者呈现极显著差异(P<0.01);T-10和WT叶片中可溶性蛋白含量、脯氨酸含量、POD活性和SOD活性均较处理前有所增加,且T-10较WT增加显著(P<0.01)。由此表明,HaACO1基因在烟草中过表达,可以增加植株可溶性蛋白和脯氨酸的合成以及提高POD和SOD的活性,从而提高烟草对NaCl胁迫的耐受能力。

图8 转基因烟草中抗逆相关生理生化指标分析Fig.8 Analyses of physiological parameters related to stress tolerance in transgenic tobacco
图9显示,处理前,转基因烟草株系T-10和WT烟 草 中P5CS、POD、MnSOD和GuZnSOD相对表达量基本一致无显著差异,而在NaCl处理24 h后,T-10和WT烟草中4个抗逆相关基因的相对表达量均较处理前有所增加,且T-10极显著高于WT(P<0.01)。可见,HaACO1过表达诱导了烟草中P5CS、POD、MnSOD、GuZnSOD基因的上调表达,提高了烟草体内的渗透调节和清除活性氧的能力,从而提高了烟草对NaCl的耐受性。

图9 转基因烟草中胁迫相关基因的表达分析Fig. 9 Expression analysis of stress-responsive genes in transgenic tobacco
3 讨论
植物在其生长、发育、成熟衰老的生命周期中,会受到各种生物和非生物胁迫的影响,乙烯作为气态植物激素不仅影响植物生长发育的许多方面,而且对多种胁迫都会做出响应[13]。研究表明,ACC氧化酶(ACO)由多基因家族编码,是催化ACC合成乙烯的最后一个关键酶。ACO基因的特异表达,不论是在植物生长发育,还是响应环境胁迫过程中,对乙烯的生物合成都具有重要的调节作用[13-14]。已有研究证实,同种植物的不同ACO成员在器官表达特异性、时空表达、转录水平和翻译水平等不同基因表达层次都存在明显差异[1]。Takahashi等[15]从莴苣中分离出3种ACO基因,即Ls-ACO1、Ls-ACO2和Ls-ACO3。研究表明,光照可诱导Ls-ACO1和Ls-ACO3积累,低pH(4.0)诱导Ls-ACO2表达,ACC或IAA只诱导Ls-ACO2积累。这些结果表明,生长素、乙烯和光可诱导ACO表达,Ls-ACO2在低pH诱导莴苣根毛形成过程中对乙烯生成起着关键作用。Liu等[16]从损伤诱导的向日葵品种Dahlgren 131中克隆了ACCO1及其同源基因ACCO2,并以Ouvrard等[17]分离的向日葵sdi-10为基础克隆了ACCO3,这3个基因属于向日葵ACO家族的3个成员。通过损伤和银离子处理向日葵幼苗,结果表明ACCO1和ACCO2和ACCO3存在器官差异表达,ACCO1主要在根中表达,ACCO2主要在下胚轴和叶中表达,ACCO3在根、下胚轴和叶中均有表达,但ACCO3在ACO总的转录产物中只占少量。植物ACO各个成员的表达差异可能是由于上游调控序列的差异所致[18]。百脉根LcACO1在其根、果荚、叶、花中均有表达,且具有一定的组织特异性,其中根中表达量最高,与在果荚、叶、花中的表达量相比有显著性差异[19]。潘刚[20]报道了分离得到的桑树MaACO1基因在桑树叶片形成、雌花发育中的作用以及参与机械损伤与低温、干旱胁迫的应答。李立芹等[21]研究表明,马铃薯StACO1在马铃薯根、茎、叶和花的各个组织中均有表达,并且其表达量在根中最高,在叶中的表达量最低,同时发现该基因在高盐、渗透、低钾和过氧化氢胁迫后表达量明显增加,表明StACO1参与马铃薯非生物逆境胁迫反应。此外,马铃薯StACO1还受到乙烯、生长素、茉莉酸、伤害和真菌诱导表达。Xiao等[22]从匍匐翦股颖中克隆的AsACO在茎中的表达量最高,对乙烯利、茉莉酸甲酯、水杨酸和低温的反应强烈上调,但对干旱和NaCl处理的反应下调。Shi等[23]分析表明梨的PpACO1和PpACO2基因在梨的果实中有差异表达,且在果实发育的不同时期,2个PpACO的表达量不同。此外,PpACO1在果实中被水杨酸诱导下调;而PpACO2在果实中被水杨酸诱导显著上调。这些结果表明,梨的PpACO可能参与调节果实成熟和响应水杨酸胁迫。朱家红等[24]研究表明,乙烯利、低温和赤霉素均能诱导菠萝AcACO1的表达。本研究进行了HaACO1在向日葵不同器官中的表达分析,结果表明HaACO1在向日葵根、下胚轴和叶中均有表达,其中在叶中表达量最高,依次为下胚轴、根,与向日葵ACCO2的表达模式相似[16]。进一步对向日葵幼苗进行生物胁迫和不同非生物胁迫前后HaACO1的相对表达分析,表明黄萎病病原菌及NaCl、损伤、水杨酸和低温处理均可诱导向日葵HaACO1表达,但胁迫条件不同,表达模式不同。ACO基因表达量增加,乙烯合成增多,启动乙烯信号传导途径参与激发植物防御应答[20]。
在ACO基因超表达研究中,张萍等[9]将棉花GhACO2基因导入拟南芥中发现,转基因拟南芥对盐胁迫和干旱胁迫的耐受性较野生型拟南芥显著性增强。孙明明等[25]通过花粉管注射法将花生AhACO1和AhACO2导入花生中,结果表明转基因植株目的基因的表达量和乙烯释放量明显高于非转基因植株,而且用盐处理后转基因植株叶片萎蔫程度相对较轻,推测AhACO基因的过量表达提高了转基因花生的耐盐性。李立芹等[21]将马铃薯StACO1基因转入烟草中,在低钾条件下进行种子萌发实验发现,转基因烟草的发芽率明显优于对照,且根毛数量和长度较对照增加和增长,表明过量表达的烟草通过增加根毛数量与主根长度来适应这种胁迫,促使植物吸收更多钾离子。在低钾水培条件下,H2O2含量与对照相比降低,表明过量表达StACO1基因的烟草表现出更强的耐低钾能力。Ramadoss等[26]将ACO基因转入拟南芥中,淹水条件下,野生型拟南芥存活时间不到20 d,而转基因株系存活时间可达35 d,表明过表达ACO基因可提高拟南芥抗淹水能力。
非生物胁迫引起的植物生理生化指标的改变是由植物体内的保护系统和相关基因表达共同调控的[27]。大量研究表明,可溶性蛋白和脯氨酸含量及POD和SOD活性是反应植物逆境胁迫生理生化参数改变的重要指标。植物中的蛋白质合成对非生物胁迫非常敏感。Ban等[28]研究表明,植物蛋白质合成与抗逆性呈正相关,可溶性蛋白水平的增加有助于提高转基因植物对环境因子(如铜)的耐受性。胁迫条件下,植物体内脯氨酸含量的改变显示了植物对胁迫的耐受能力,其含量越高,植物的抗胁迫能力越强。SOD、POD等抗氧化酶类作为活性氧的清除剂,可以防止环境胁迫下细胞受到伤害[29]。干旱、冷、热、盐胁迫下向日葵叶片和根中脯氨酸增加[30]。Shahbaz等[31]报道了盐胁迫显著提高了8个供试向日葵品种的游离脯氨酸含量。在低钾胁迫下,转马铃薯StACO1烟草的3个株系的脯氨酸、K+和ACC含量及POD酶活性都呈现增加的趋势,且显著高于对照,表明过表达StACO1,可增强烟草对钾胁迫的耐受性[21]。盐胁迫使光合作用受抑制,也影响光合成分和叶绿体超微结构[32],从而影响植物生长发育。已有报道显示,某些外源基因超表达可提高转基因植物在高盐胁迫下的叶绿素含量[33],可以激活一系列胁迫相关基因如P5CS、POD、Cu/ZnSOD、LEA、C2H2、脱水素及冷诱导等基因的表达来提高植株对盐、干旱、氧化等非生物胁迫的耐受性[28]。Cu/ZnSOD在叶绿体中表达可增强马铃薯植株对环境胁迫的耐受性[34]。本研究结果表明在低温、干旱和NaCl 胁迫下,转基因烟草的HaACO1表达量高于野生型烟草,说明过度表达向日葵HaACO1提高了烟草对逆境胁迫的抗性。进一步研究表明,NaCl 胁迫下,转HaACO1烟草中可溶性蛋白含量高于野生型烟草,认为HaACO1可能参与促进蛋白质合成或保护蛋白质合成途径;转基因烟草和野生型烟草叶绿素含量降低,但转基因烟草叶绿素含量高于野生型烟草叶绿素含量,表明NaCl胁迫影响了光合成分叶绿素的合成,导致光合作用受阻,但HaACO1过表达减弱了盐胁迫对转基因烟草中叶绿素合成的影响,与烟草离体叶片的耐盐性实验结果相符。同时,转HaACO1烟草中脯氨酸含量和POD、SOD活性及与之相关的P5CS、POD、MnSOD、CuZnSOD基因相对表达量均高于野生型烟草,表明NaCl胁迫下,HaACO1过表达诱导了胁迫相关基因P5CS、POD、MnSOD、CuZnSOD的上调表达,增加了细胞内脯氨酸积累,增强了POD和SOD活性,提高了转基因烟草的耐盐性。
4 结论
本研究表明HaACO1在向日葵根、下胚轴和叶不同器官中具有表达特异性;该基因参与生物和非生物胁迫应答,且具有独特的表达模式。瞬时表达证实其编码蛋白定位于细胞质,与其行使的功能相一致。烟草中过表达HaACO1基因,提高了转基因烟草对低温、干旱和盐的耐受性;NaCl胁迫后,经过一系列信号传递,诱导一些与抗逆相关基因的上调表达,引起与之相关的生理生化参数的相应变化,以增强烟草抵抗盐害的能力。
