陆地棉小GTP结合蛋白基因GhROP3的克隆、表达及VIGS载体的构建
2021-11-06胡子曜代培红刘超玛迪娜木拉提王倩吾尕力汗阿不都维力赵燚孙玲徐诗佳李月
胡子曜 代培红 刘超 玛迪娜·木拉提 王倩 吾尕力汗·阿不都维力赵燚 孙玲 徐诗佳 李月
(新疆农业大学 农业生物技术重点实验室,乌鲁木齐 830052)
棉花是我国重要的经济作物,种植广泛。然而棉花在生长过程中会受到一系列的生物胁迫和环境因素的影响。这些不利因素会影响棉花的生长、产量以及纤维品质,继而造成巨大的经济损失。因此,发掘棉花抗逆相关基因并研究其抗逆的分子机制,培育棉花抗逆新品种进而获得高产高品质的棉花,对于提高棉花产量和农民收入,促进经济发展具有重大意义。
小G蛋白(small GTPases)家族成员是一类分子量为20-30 kD的单体蛋白,广泛存在于真核生物中[1],通过其独特的调节方式,在植物细胞信号转导及生长发育等生理活动中起关键的作用[2]。根据其结构和功能的不同,将其分为Ras、Ran、Rab、Rho和Arf等5个家族[3],在真核生物中,Ran、Rab、Arf家族蛋白的功能主要参与囊泡和大分子运动的调节,而Ras和Rho家族蛋白则是信号转导开关。ROP蛋白是一类植物特有的Rho类小G蛋白[4-5],具有GTP酶活性,通过与GTP结合和水解过程中构象的变化促进了ROP蛋白与效应因子或调节蛋白的短暂相互作用,从而导致信号级联的周期性激活或失活,在植物信号传导途径中起分子开关的作用[6],ROP家族蛋白作为植物特有的上游信号传递的分子开关,参与了植物对病原菌的防卫调控及抗逆反应。
最早在豌豆中发现了第一个ROP基因,目前,已在沉香、番茄、辣椒、烟草、玉米、棉花、水稻、拟南芥、苜蓿、葡萄、大豆等多种作物中克隆了ROP基因,对ROP基因的功能研究也更加深入,研究发现该类基因除了参与细胞分裂、根毛极性生长、花粉管生长、激素反应等生理活动外[7],也响应了高温、盐、低温、干旱胁迫和抗病反应[8]。目前,对于棉花中ROP家族基因的研究报道主要集中在棉花纤维发育和陆地棉对黄萎病菌的抗病反应,对其在非生物胁迫下的功能研究也有初步报道。虽然已有研究表明ROP基因响应棉花抗逆反应,但其对逆境的调控方式及抗逆分子机制还不清楚,仍需要进一步探究。李先碧等[9]从陆地棉克隆了GhRacA和GhRacB,这两个基因在棉花纤维起始和伸长时期优势表达。因此,推测其可能调控棉花纤维的早期发育;Delmer等[10]克隆了2个在棉纤维发育过程中初生和次生壁合成过渡时期的优势表达的基因GhRac9和GhRac13,推测它们可能调控棉花次生壁的合成;王钰静[11]通过病毒诱导的基因沉默技术抑制棉花GhROP6的表达,沉默植株的抗病性显著低于对照组,推测GhROP6正调控棉花对黄萎病的抗性;李月等[12]从陆地棉克隆了GhROP4并利用qRT-PCR技术分析了不同胁迫下该基因的表达情况,表明GhROP4响应非生物胁迫应答;但目前对于GhROP3的生物学功能研究还未见相关报道。
病毒诱导基因沉默(virusinduced gene silencing,VIGS)是近年来发展起来的一种快速、高效、高通量的反向遗传学技术,其原理是利用重组病毒抑制植物内源基因的表达,通过表型或生理指标变化鉴定基因的功能,属于转录后基因沉默[13]。
本研究利用同源克隆的方法从棉花cDNA中克隆得到的GhROP3,通过荧光定量PCR的方法分析该基因的组织表达特异性和不同逆境诱导条件下的表达模式,同时构建了该基因的VIGS沉默载体并通过农杆菌介导侵染棉花获得沉默植株,旨为进一步验证棉花GhROP3的生物学功能奠定基础。
1 材料与方法
1.1 材料
供试材料为陆地棉新陆早22,由新疆农业大学农学院农业生物技术重点实验室提供。农杆菌菌株GV3101为新疆农业大学农学院农业生物技术重点实验室保存;大丽轮枝菌强致病力落叶型菌株V991(Verticillium dahlia Kleb)、TRV病 毒 载 体 及含阳性对照TRV:GhCLA1载体的农杆菌菌株由新疆农业科学院核技术生物技术研究所黄全生研究员惠赠。XbaⅠ和SmaⅠ等限制性内切酶购于赛默飞(Thermo)公司,Biospin多糖多酚植物总RNA提取试剂盒购于杭州博日科技公司,Taq DNA聚合酶、T4 DNA Ligase、RNase A、高保真聚合酶TransStar KD Plus、反转录试剂盒、荧光定量试剂盒、琼脂糖凝胶回收试剂盒和DNA分子量Marker均购自北京全式金生物技术有限公司。卡那霉素、庆大霉素、MES、乙酰丁香酮、MgCl2及培养基配制等化学试剂均为国产分析纯。PCR所用引物的合成及DNA的测序均由上海杰李生物技术有限公司完成。
1.2 方法
1.2.1 棉花种植及胁迫处理 选取经硫酸脱绒后颗粒饱满大小一致的种子,经30%的H2O2处理后,再用清水冲洗3-5遍,将种子浸泡于清水中直至露白,然后把种子平铺在发芽纸上装入自封袋中置于28℃恒温培养箱中暗培养12 h,待胚根长至2-3 cm时,种植于蛭石∶黑土=1∶2的营养土中,25℃培养室、光照周期为16 h光照/8 h黑暗条件下培养并适时浇水,待棉苗生长15 d后用于胁迫处理。
选取生长一致的棉花,置于吸水纸上吸干水分,分别进行4℃低温、干旱、高盐(200 mol/L NaCl)胁迫处理,具体处理方法参照王娜等[14]已报道的方法进行。分别于胁迫处理后的0、1、3、6和12 h采集叶片,盐胁迫处理的最适浓度及各取样时间段的选择参照李月等[12]的方法,同时对未处理材料的根、真叶、子叶、下胚轴和茎进行取样,用于组织特异性表达检测。不同的时间点及不同部位均取3个生物学重复。将所取材料液氮冷冻并-80℃保存,用于总RNA提取及目的基因表达分析。
待棉花第二片真叶完全展开时,参照王钰静[11]和李秀青等[15]的方法挑选生长状况一致的棉苗进行接菌处理,在接菌0、6、12、24和48 h后取棉花幼根,不同的时间点均取3个生物学重复。取样时用无菌水将根部清洗干净,迅速液氮冷冻并-80℃保存,用于总RNA提取及目的基因的表达分析。
1.2.2 棉花总RNA的提取与cDNA第一链的合成 将上述样品研磨成白色粉末,使用Biospin Plant Total RNA Extraction Kit试剂盒提取棉花不同处理、不同时间点和棉花不同组织的RNA,用Thermo Scientific(NanoDrop 1000)核酸分析仪和1.2%琼脂糖凝胶电泳检测所提RNA的质量和完整性,质量检测合格的RNA使用反转录试剂盒,进行cDNA第一链的合成。
1.2.3 棉花GhROP3的克隆及序列分析 从拟南芥TAIR网站(http:/www.arabidopsis.org/index.jsp)下载AtROP1(AT2G17800)基因的序列,在棉花EST数据库(http://www.leonxie.com)、棉花基因组数据库(http://www.phytozome.net)中进行比对,获得棉花ROP基因的cDNA序列,将其命名为GhROP3。然后根据此序列的ORF(open reading frame)序列设计扩增引物(表1),以陆地棉新陆早22的cDNA为模板,使用高保真聚合酶TransStar KD Plus进行PCR扩增。扩增产物经1%的琼脂糖凝胶电泳检测后,回收目的条带,并连接pEASY-Blunt-Zero克隆载体,转化大肠杆菌Trans-T1感受态细胞。挑取单克隆进行质粒酶切鉴定,正确的阳性克隆质粒送上海杰李生物技术有限公司进行测序。试验所用的PCR程序、扩增产物检测及目的片段的纯化回收均参照王娜等[14]方法进行。
用基因文库(GenBank)为GhROP3申请登录号,利用(http://web.expasy.org/protparam/)在线程序计算GhROP3编码蛋白质的理化参数。用SignalP(http://www.cbs.dtu.dk/services/SignalP)在 线 程 序对该蛋白质进行信号肽预测分析。利用在线软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域。
1.2.4 目的基因的表达特征分析 以反转录的cDNA为模板,以棉花管家基因UBQ7[16]为内参基因,进行荧光定量PCR反应,反应体系和反应条件参照王娜等[14]方法,每个样本进行3个技术重复。反应结束后根据目的基因和内参基因Ct值,使用2-ΔΔCt方法[17]计算目的基因的表达量。目的基因和内参基因荧光定量引物见表1。
1.2.5 陆地棉GhROP3的VIGS片段克隆与VIGS载体构建 根据GhROP3的CDS(591 bp)序列,利用SGN-VIGS在线软件设计抑制目的基因表达的靶序列(291 bp),设计合适引物,并在其上、下游5'端分别加入XbaⅠ和SmaⅠ的酶切位点(表1),以cDNA为模板,PCR扩增目标片段。回收、检验、测序方法同1.2.1。将测序完全正确的质粒和VIGS沉默载体TRV2用XbaⅠ和SmaⅠ进行双酶切并回收,将回收的目的条带与TRV2载体用T4连接酶连接,转化大肠杆菌Trans-T1感受态细胞,用XbaⅠ和SmaⅠ进行双酶切鉴定,酶切正确的质粒取15 μL使用冻融法转化农杆菌GV3101感受态细胞,28℃倒置培养2-3 d,用于后续试验。1.2.6 农杆菌介导的VIGS侵染棉花及沉默效率检测 参照李秀青等[15]的方法,挑取构建好的载体TRV:RNA1、TRV:RNA2、TRV:GhCLA1和TRV:GhROP3转化农杆菌后,进行转化棉花前的活化及重悬。待棉花幼苗生长至子叶完全展开且真叶还未露出时,参照王钰静[11]的方法选取生长较为一致的幼苗,利用注射法侵染棉花。将包含TRV:GhROP3和TRV:RNA1、TRV:GhCLA1和TRV:RNA1、TRV:RNA2和TRV:RNA1的重悬菌液侵染的棉花植株分别作为试验组及阳性、阴性对照。
侵染棉株幼苗大约15 d时,当阳性对照TRV:GhCLA1出现叶绿素缺失的白化表型时,拍照记录。对阴、阳对照和试验组植株第二片真叶及根部进行取样,每个样本取3个技术重复。将所取样本进行RNA提取并反转成cDNA,利用荧光定量PCR反应检测基因沉默效率。目的基因沉默检测和阳性对照GhCLA1沉默检测的荧光定量引物见表1。

表1 引物及用途Table 1 Primer and application
2 结果
2.1 GhROP3的克隆与序列分析
以陆地棉新陆早22的叶片cDNA为模板进行PCR扩增(图1),扩增片段大小符合预期,表明已克隆出GhROP3的CDS序列并在基因文库(GenBank)为其申请登录号:MK955930。利用在线软件对GhROP3进行生物学分析(表2),GhROP3的ORF为591 bp,编码196个氨基酸,相对分子质量为21.75 kD,理论等电点为9.45,平均疏水性为负值,表明该基因编码的蛋白为碱性、亲水性蛋白;蛋白质信号肽预测结果显示GhROP3蛋白无信号肽;亚细胞定位预测结果显示GhROP3蛋白定位于细胞膜;跨膜结构域预测结果显示GhROP3蛋白是非跨膜蛋白。

表2 棉花GhROP3的生物信息学分析Table 2 Bioinformatics analysis of GhROP3 in cotton

图1 GhROP3的克隆Fig. 1 Cloning of GhROP3 gene
2.2 GhROP3的表达特征分析
利用荧光定量PCR检测GhROP3在高盐(200 mol/L NaCl)、干旱、低温和黄萎病菌逆境胁迫处理下的表达模式,结果表明,GhROP3对以上处理均有应答反应,但在不同胁迫处理下基因表达模式不同。在高盐处理下,GhROP3在1 h的表达量最高,在0和3 h基因表达量一致,无明显差异,均显著与高于6和12 h(图2-A)。在干旱处理下,GhROP3在6 h的表达量均高于其他时间点,在0和12 h的表达量基本一致,均低于1和3 h(图2-B)。低温处理后,GhROP3在12 h的表达量高于其他时间点,但在其他时间点也有一定的表达量(图2-C)。黄萎病菌侵染棉花后,GhROP3的表达量呈现先升高后降低的趋势,在4 h的表达量最高,在24和48 h的表达量基本一致,在0 h的表达量最低(图2-D)。GhROP3在不同组织中的表达分析结果表明,GhROP3在茎中的表达量最高,在根、叶、子叶和下胚轴中的表达量均处于低表达量水平(图2-E),说明该基因的表达存在一定的组织特异性。

图2 GhROP3的表达谱分析Fig. 2 Expression pattern analysis of GhROP3
2.3 GhROP3的VIGS载体构建
利用PCR方法扩增GhROP3的VIGS靶序列,所得产物大小符合预期(图3-A)。将产物进行克隆并测序,所得结果与目标片段序列一致。经XbaⅠ和SmaⅠ酶切阳性质粒与VIGS沉默载体TRV2连接,并进行双酶切鉴定(图3-B),发现呈现2条条带,一条大于8 000 bp的载体条带和大小为250-500 bp的目标条带,表明GhROP3的VIGS沉默载体构建成功。
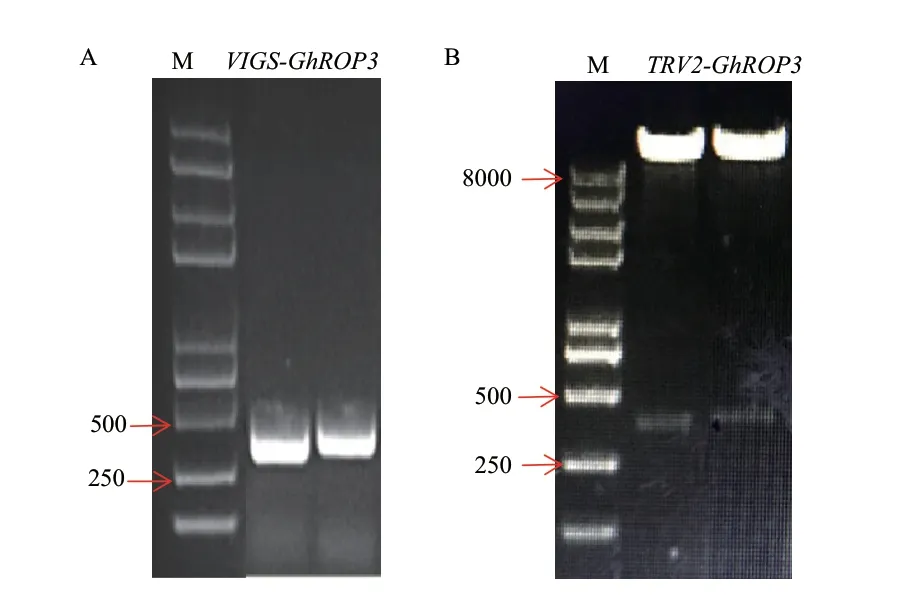
图3 GhROP3的VIGS载体的构建Fig. 3 Construction of VIGS vector of GhROP3
2.4 VIGS技术体系检验
将3个转化体TRV∶GhCLA1、TRV∶GhROP3和TRV∶RNA2分别与TRV∶RNA1混合,分别侵染棉花子叶。侵染15 d后,表型观察,阳性对照的叶片出现白化现象(图4-A);利用qRT-PCR技术检测阳性对照GhCLA1和GhROP3在根和真叶中的表达量,结果显示,目的基因的表达量均显著性低于对照组(图4-B-C),证明VIGS沉默载体在植株体内能够正常工作,成功获得GhROP3的沉默植株。

图4 VIGS技术体系验证Fig. 4 Verification of VIGS system
3 讨论
棉花是我国重要的农业经济作物,在国民经济中占有举足轻重的地位。而新疆由于其独特的光热资源,现已成为我国最大的棉花种植区[18]。但新疆棉花的大面积种植在推动地区经济发展的同时,也给棉花黄萎病的爆发和流行提供了便利条件,黄萎病现已成为棉花生产的主要障碍,同时也是制约棉花高产、稳产、优产的关键因素;此外棉花在生长过程中还会遭受到一系列的非生物逆境胁迫,由于地理位置及气候的影响,干旱胁迫同样严重影响着新疆棉花的扩大生产,使得新疆地区棉花的生产优势无法充分发挥出来。传统的杂交育种方法难度大、周期长,已不能满足现实生产发展的需求。因此,筛选、鉴定棉花抗逆相关基因,对保障棉花的有效供给具有重要的现实意义。
在黄萎病抗性基因筛选方面,Kawchuk等[19]在番茄中克隆出了Ve1、Ve2两个抗黄萎病相关连锁基因;陈捷胤[20]在海岛棉中克隆出GbaVd1和GbaVd2,通过过表达GbaVd1和GbaVd2增强了拟南芥对黄萎病的抗性;Zhang等[21]沉默了海岛棉中GbVe1后,沉默植株对黄萎病菌的抗性显著降低,证明该基因在抗黄萎病反应中起正调控作用;此外,一些抗性相关基因如GhDIR1、GhROP6[11]、GhWRKY40-like、GhWRKY70[22]等也被证实参与棉花对黄萎病菌的抗性。同时近年来也研究发现了许多有利用价值的抗旱基因,例如AREB、NAC、DREB、ABH1、SAD1、NF-Y和WRKY等转录调控基因;SnRK2、ERA1、MAPK、GGB[23]、DST[24]等蛋白翻译后修饰调控基因;CDPK、LOS、NCED和PLC等新陈代谢调控基因;LEA、P5CS、TPS、和betA等渗透保护调控基因[25]。
ROP蛋白作为传递细胞内和细胞外刺激信号的分子开关,调节细胞内的各种反应[7]。在拟南芥中,AtROP11的表达影响种子萌发、幼苗生长、气孔关闭、脱落酸介导的反应和干旱胁迫反应[26];AtROP1是ABA调控气孔开闭中的一个重要基因,该基因在气孔保卫细胞中优势表达,ABA通过灭活AtROP1蛋白,诱导气孔开闭[27];拟南芥ROP效应子RIC1的敲除通过改善解聚微管的重组提高了盐胁迫下植株的存活率[28]。本研究通过拟南芥基因序列与棉花基因组数据库比对,利用同源克隆的方法成功克隆出一个棉花ROP基因,命名为GhROP3,该基因的ORF长度为591 bp,编码196个氨基酸,相对分子质量为21.75 kD,编码的蛋白为碱性、亲水性蛋白,定位于细胞膜,是非跨膜蛋白。为探究该基因是否具有与拟南芥AtROP相似的功能,本研究分析了GhROP3在低温、干旱、高盐处理和黄萎病菌侵染后基因的表达情况,结果表明,GhROP3在低温胁迫下,基因表达量整体上呈现先升高再降低后升高的趋势;在干旱、高盐胁迫下和黄萎病菌处理后,该基因的表达量整体均呈现先上升后下降的趋势;在这4种逆境胁迫处理中GhROP3的表达受干旱和黄萎病调控的程度较强,推测GhROP3可能更多地参与了棉花对干旱的胁迫反应和抗黄萎病反应。上述结果显示在后续的研究中应该更多地关注GhROP3在棉花抗旱和抗黄萎病中的功能。组织特异性分析表明,GhROP3在棉花幼苗根、茎、叶、子叶和下胚轴中均有表达,但存在一定的组织特异性,GhROP3在茎中的表达量远高于其它组织,以上结果推测棉花GhROP3棉花茎组织中发挥着重要的调控功能。然而GhROP3在棉花抗逆中的功能尚不清楚,为进一步探究该基因在棉花抗逆中的调控方式及调控的分子机制,本研究还构建了GhROP3的VIGS沉默载体并转化棉花,获得了沉默植株,以期进一步研究棉花GhROP3的生物学功能,本研究为棉花抗逆的重要基因资源挖掘及创制新材料奠定了基础。
4 结论
克隆获得1个小GTP结合蛋白基因GhROP3,其开放阅读框为591 bp,编码196个氨基酸,相对分子质量为21.75 kD,编码蛋白为碱性、亲水性蛋白,定位于细胞膜,是非跨膜蛋白。GhROP3在棉花幼苗根、茎、叶、子叶和下胚轴中均有表达,且在茎中表达水平较高。同时该基因响应高盐、干旱、低温和黄萎病菌等逆境胁迫。本研究获得VIGS沉默植株。
