MTHFR基因多态性对大剂量甲氨蝶呤化疗后患儿血药浓度及药物不良反应的影响
2021-11-06裴保方陶兴茹郭鹏波马姝丽
裴保方,陶兴茹,刘 炜,郭鹏波,吕 萌,马姝丽
(郑州大学附属儿童医院 1 药学部,2 血液肿瘤科,3 河南省儿童遗传代谢性疾病重点实验室,郑州 450018)
急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)是常见的儿童白血病类型之一。大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)在ALL患儿维持治疗中发挥着重要的作用[1],但在临床治疗过程中,患儿对HD-MTX的敏感性和药物不良反应存在明显的个体差异。亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)是叶酸代谢途径中参与催化亚甲基四氢叶酸生成甲基四氢叶酸的关键酶之一[2],也是MTX发挥药理作用的关键酶之一,其基因多态性可能与MTX化疗后血药浓度及药物不良反应相关。本研究旨在探讨MTHFRA1298C和MTHFRC677T基因多态性与ALL患儿HD-MTX化疗后血药浓度及药物不良反应的关系,为MTX的合理应用及药物不良反应预测提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年10月~2019年9月在本院儿童血液肿瘤科确诊的ALL住院患儿77例作为研究对象。其中,男性患儿56例,女性患儿21例;最小年龄1岁4个月,最大年龄14岁,平均年龄(4.88±2.48)岁。患儿一般资料无统计学差异(P>0.05),具有可比性(见表1)。本研究经本院伦理委员会批准(伦理批件号:2020-K-022)。本研究为利用以往临床诊疗中获得的病例/生物标本的研究,经本院伦理委员会批准免除知情同意。
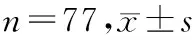
表1 患儿一般资料比较
纳入标准:每例患儿的诊断均参照《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[3],所有患儿均处于巩固治疗阶段。
排除标准:① 早期强化疗后未完全缓解者。② 使用过程中出现严重过敏反应者。③ 严重心、肺、肝肾功能不全者。
1.2 治疗方法
参照儿童ALL治疗建议,甲氨蝶呤注射液(Pfizer Australia Pty Ltd,注册证号H20140207,规格1000 mg/10 ml)给药剂量为低危组2.0 g/m2、中高危组5.0 g/m2,总剂量的1/10作为突击量于前0.5 h内快速静脉滴入,余量于后23.5 h内匀速滴入。突击量MTX滴入后2 h内,进行三联鞘内注射:甲氨蝶呤注射液+注射用阿糖胞苷(Pfizer Italia s.r.l.,国药准字HJ20160403,规格0.1 g)+地塞米松磷酸钠注射液(天津金耀药业有限公司,国药准字H12020516,规格1 ml∶2 mg),同时给予大剂量水化、碱化治疗;MTX滴注48 h后进行四氢叶酸钙(CF)解救治疗,之后根据MTX血药浓度监测结果调整CF解救方案,直至MTX血药浓度≤0.3 μmol/L(机器可检测最低范围)时停止解救。
1.3 基因分型
MTHFRA1298C和MTHFRC677T基因检测试剂盒购自上海吉凯基因科技有限公司;血药浓度监测采用西门子Viva-E2000全自动药物浓度分析系统(德国德灵诊断公司)。
目的片段的引物分别是5’-CAGTCCCTGTGGTCTCTTCAT-3’和5’-CTCACCTGGATGGGAAAGAT-3’与5’-CTTTGGGGAGCTGAAGGACTACTAC-3’和5’-CACTTTGTGACCATTCCGGTTTG-3’。PCR反应体系为25 μl,含有模板DNA 0.1 μg、各引物0.4 μmol/L、脱氧核糖核苷酸三磷酸(dNTP)0.2 mmol/L、MgCl 21.5 mmol/L、Taq DNA聚合酶及其1×缓冲液1.0 U。反应在ABI Verity热循环仪上进行,95 ℃预变性1 min,95 ℃ 15 s,62 ℃ 15 s和72 ℃ 20 s,共35个循环,最后72 ℃延伸7 ℃,后者的退火温度是58 ℃。
1.4 MTX血药浓度监测
HD-MTX开始后48和72 h采患儿静脉血2 ml,采用酶放大免疫法测定MTX血药浓度,若48 h时MTX血药浓度≤0.3 μmol/L,可不予测定72 h MTX血药浓度。
1.5 药物不良反应监测
HD-MTX化疗期间,观察记录患儿药物不良反应,根据美国国立癌症研究所常规毒性判定标准4.0版(NCI-CTC 4.03)及《抗癌药物急性及亚急性毒性反应分度标准(WHO)》[4],对药物不良反应进行分级,分级≥Ⅱ级被认为是临床相关的化疗不良反应。不良反应评价观察指标有:外周血中性粒细胞减少(N<1.5×109/L)、血红蛋白降低(Hb<95 g/L)和血小板减少(PLT<75×109/L)、胃肠道反应(暂时性呕吐、腹泻能耐受≥2天)、黏膜损害(口腔红斑、溃疡)、肝脏损害(谷丙转氨酶≥2.5倍正常值上限)、肾脏毒性(尿素氮≥2.5倍正常值上限)等。
1.6 统计学方法
采用SPSS 22.0统计软件进行统计分析,不同基因型间药物不良反应比较,计数资料以n(%)表示,采用χ2检验,用非线性logistic回归分析计算比值比(OR)及其95%可信区间(95%CI)表明不同基因型发生不良反应的可能性。P<0.05为具有统计学差异。
2 结果
2.1 MTHFR A1298C与ALL患儿HD-MTX化疗后药物不良反应的关系
MTHFRA1298CAA型患儿较AC+CC型发生血小板减少的风险增加了2.10倍(OR=2.10,95%CI:0.23~19.08,P<0.05),胃肠道不良反应的发生率增高,具有统计学差异(P<0.05),不同基因型患儿中性粒细胞减少、血红蛋白降低、黏膜损害、肝脏损害等药物不良反应的发生风险无统计学差异(P>0.05)。见表2。
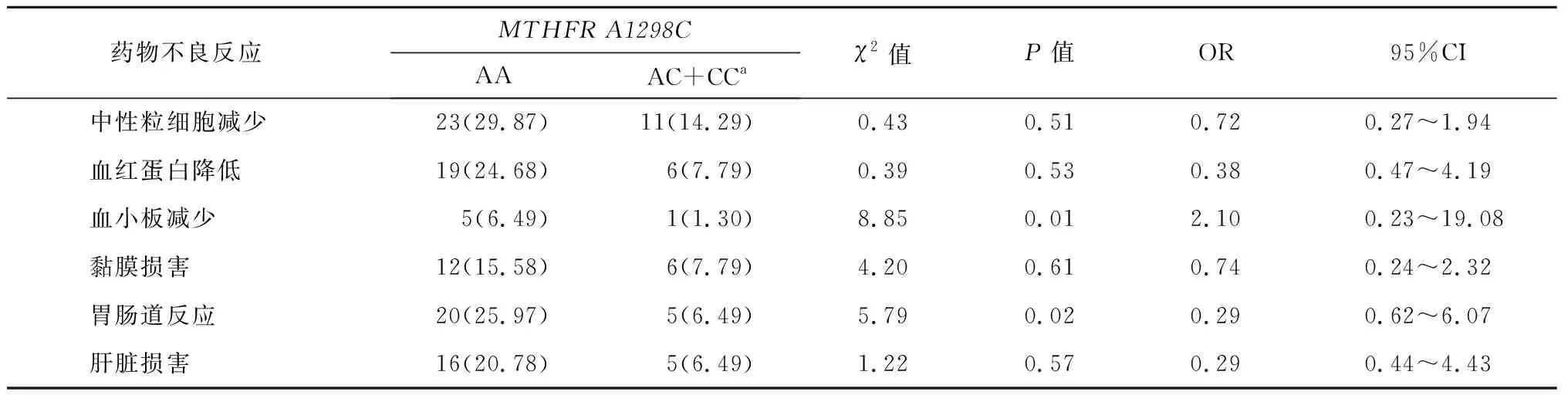
表2 MTHFR A1298C与HD-MTX化疗后药物不良反应的关系 n=77,n(%)
2.2 MTHFR C677T与ALL患儿HD-MTX化疗后药物不良反应的关系
与CT和TT型相比,MTHFRC677TCC型患儿血小板减少、血红蛋白降低和黏膜损害的发生率明显升高,具有统计学差异(P<0.05),不同基因型患儿中性粒细胞减少、胃肠道反应和肝脏损害等药物不良反应发生率比较无统计学差异(P>0.05)。见表3。
表3 MTHFR C677T与HD-MTX化疗后药物不良反应的关系 n=77,n(%)
2.3 MTHFR基因多态性与48 h MTX血药浓度的相关性
MTHFRA1298C和MTHFRC677T不同基因型与HD-MTX用药后48 h血药浓度无统计学相关性(P>0.05),提示MTHFR基因多态性不影响MTX的排泄。见表4。

表4 MTHFR基因多态性与48 h MTX血药浓度的关系 n=77,n(%)
3 讨论
MTHFR是参与叶酸代谢和DNA合成的重要辅酶[5],可催化5,10亚甲基四氢叶酸还原为具有生物学功能的5-甲基四氢叶酸,而后者主要使脱氧鸟嘧啶核苷酸(dUMP)甲基化为脱氧胸腺嘧啶核苷酸(dTMP),并参与DNA合成和修复[6]。MTHFRA1298C和MTHFRC677T是2个最常见的多态性位点,其多态性会导致酶活性的改变,可能会改变叶酸拮抗剂的化疗反应[7]。MTHFR基因多态性与MTX用药后血药浓度变化及化疗后药物不良反应的关系已成为目前研究的热点之一。
目前,关于MTHFRA1298C和C677T基因多态性与HD-MTX化疗相关不良反应的关系已有报道,但结果不一。本研究结果显示,MTHFR1298AA基因型与AC+CC基因型相比,其发生血小板减少的风险增加了2.1倍,胃肠道不良反应的发生率增高,具有统计学差异(P<0.05),在其他药物不良反应的发生率方面无统计学差异,这与Umerez等[8]的研究结果一致。此外,樊春艳等[9]的研究发现携带MTHFRA1298CAA基因型的ALL患儿发生MTX化疗后胃肠道反应的风险较AC+CC基因型高4.513倍,其他基因型与MTX化疗后药物不良反应则无关联。而Zhu等[10]荟萃分析了14项研究发现MTHFRA1298C基因多态性与儿童HD-MTX的化疗后不良反应发生无统计学相关性;Tantawy等[11]研究发现MTHFRA1298C多态性对ALL患者化疗毒性及生存无统计学影响。研究结果的差异可能受到联合用药、基因频率、当时叶酸水平以及样本数量的影响[12]。
本研究发现与CT和TT基因型相比,MTHFRC677TCC型患儿血小板减少、血红蛋白降低和黏膜损害的发生率升高(P<0.05),且未发现MTHFRC677T各基因型与中性粒细胞减少、胃肠道反应和肝脏损害等药物不良反应发生风险有统计学关联(P<0.05)。此研究结果与部分国内外学者的研究结果一致。Mahmoud等[13]研究发现,与MTHFRC677TCC野生型相比,MTHFRC677TTT基因型患者发生肝功能异常和黏膜损害的风险显著增加,而MTHFRC677TCT+TT型基因患儿发生血小板减少的风险同样增加。另外,高珊等[14]研究显示携带MTHFRC677TTT基因型的患儿发生MTX药物不良反应的风险比CC野生型携带者更高。然而,陈先睿等[15]的Meta分析结果显示,MTHFRC677T不同基因型患者MTX化疗后药物不良反应的发生率无统计学差异(P<0.05);不同地区、不同人群MTHFRC677T多态性与MTX化疗后药物不良反应相关性研究的结果并不完全一致,亚叶酸钙(CF)在一定程度上可能会降低血同型半胱氨酸水平[16]。同时,在本研究过程中,考虑到HD-MTX化疗后药物不良反应可能会受到给药剂量、CF的解救剂量、是否充分水化、碱化等因素的影响,ALL患儿的水化、碱化方案以及CF解救方案均严格参照中国儿童肿瘤临床多中心研究协作组ALL治疗研究方案(CCCG-ALL-2015),且研究入组患儿中高危患儿占96.10%,MTX给药剂量均按照5 g/L方案给药,进一步排除了给药剂量对研究结果的影响。
本研究结果提示,MTHFR基因多态性与MTX用药后48 h血药浓度变化无关,MTHFR基因多态性并不影响MTX的排泄。此研究结果与部分学者研究一致。王轶睿等[17]对大剂量甲氨蝶呤化疗后药物不良反应的影响因素进行了研究,结果显示不同MTHFR基因型、性别及年龄对MTX用药后48 h的血药浓度变化并无统计学影响。而李静等[18]研究了MTHFRC677T基因多态性与HD-MTX化疗后ALL患儿MTX血药浓度变化的相关性后发现,MTHFRC677T不同基因型患儿24 h血药浓度无统计学差异,而48 h血药浓度具有统计学差异(P<0.05)。
综上所述,MTHFRA1298C和MTHFRC677T基因多态性与ALL患儿HD-MTX化疗后药物不良反应的发生有一定的相关性,但并不影响MTX的排泄。由此,可以在ALL患儿接受HD-MTX化疗之前,通过检测MTHFR基因型来预测MTX毒性反应,从而实现患儿个体化用药。MTX的药物代谢、排泄及其所致的药物不良反应可能受到多种因素的影响,对于本研究的结果,在后续工作中还将通过扩大样本量来进行验证,以期为在ALL患儿HD-MTX化疗过程中实现个体化用药提供有效的依据。
