TLR4在间质性膀胱炎/膀胱疼痛综合征中表达增加
2021-11-06张银海关永晖
张银海,关永晖,罗 成
(新疆医科大学第一附属医院泌尿外科,新疆乌鲁木齐 835000)
间质性膀胱炎/膀胱疼痛综合征(interstitial cystitis/bladder painful syndrome,IC/BPS)是一种慢性炎症性疾病,会导致尿急、夜尿增多和骨盆区域疼痛[1],严重影响了患者的生存质量及生活质量。有研究表明IC/BPS的发病率为0.06%~30.00%[2],男女比例为1∶9[3],其发病因素与种族、地区、性别等多种因素相关[4]。目前,IC/BPS的发病机制、病理生理过程尚不明确。虽已提出几种理论,包括糖胺聚糖缺失、隐匿性感染、肥大细胞的活化和神经源性炎症理论[5],但是都缺乏明确的证据。有研究表明自身免疫是IC/BPS发病过程中一个有效的理论[6]。Toll样受体(Toll-like receptors,TLRs)是迄今为止研究最多、最集中的侵袭性病原体免疫传感器,主要分布于免疫细胞,如肥大细胞、巨噬细胞等[7]。TLR4作为TLRs家族里的明星分子,受到了广泛关注[8]。该研究首先通过膀胱内途径建立雌性SD大鼠IC/BPS模型[9],测定实验组大鼠和对照组大鼠尿液的组胺水平。然后采用苏木精-伊红染色法(hematoxylin-eosin staining,HE)、甲苯胺蓝(tol-uidine blue,TB)染色检测人和大鼠膀胱组织中炎症浸润及肥大细胞浸润程度,采用免疫组织化学染色、免疫印迹、实时荧光PCR等方法检测人和大鼠膀胱组织中TLR4蛋白及基因水平的变化,进一步明确TLR4在IC/BPS中的潜在作用,为IC/BPS的治疗提供新思路。
1 材料与方法
1.1 实验性IC/BPS大鼠模型的建立及组织准备自新疆医科大学实验动物中心购入24只、6~8周、体重200~220 g的雌性SD大鼠。将雌性SD大鼠随机分为实验组和对照组,各12只。采用腹腔注射100 g/L的水合氯醛(1 mg/kg)对大鼠进行全身麻醉,固定大鼠,用体积分数为70%的乙醇和碘酊对大鼠尿道开口消毒,随后使用无菌导管经尿道插入大鼠膀胱内。排空大鼠膀胱尿液,向实验组大鼠的膀胱先灌注1 mL硫酸鱼精蛋白(protamine sulfate,PS,10 mg/mL),保留45 min后使用磷酸盐缓冲液(phosphate buffered saline,PBS)溶液冲洗;随后立即向实验组大鼠膀胱内灌注1 mL脂多糖(lipopolysaccharide,LPS,750 μg/mL),保留30 min,拔出导管。对照组用同样的方法灌注2 mL生理盐水,两组大鼠每2 d进行1次灌注,为期4周。在最后1次灌注的24 h后,处死各实验组大鼠。摘除大鼠膀胱,沿着纵轴把膀胱平均分成三个部分。其中一部分固定于40 g/L多聚甲醛内,后续进行HE、TB染色及免疫组织化学染色;其他2个部分被及时储存在液氮中,后续进行逆转录聚合酶链反应(reverse trans-cription-polymerase chain reaction,RT-PCR)、免疫印迹试验。本研究经新疆医科大学动物伦理委员会批准,动物护理和实验均按照动物研究的生物伦理原理进行。
1.2 临床患者膀胱组织的活检研究对象为2018—2020年新疆医科大学第一附属医院收治的60例女性患者,平均年龄40~75岁,平均病史6~30个月。采用病例对照研究。选取30例患有间质性膀胱炎的女性患者作为病例组,临床表现为6个月以上的膀胱区疼痛、尿急、尿频≥8次/d、排尿后疼痛减轻及憋尿时加重,膀胱镜下具有典型的膀胱点状出血、膀胱壁Hunner溃疡及相关组织学特征,排除神经源性膀胱或膀胱逼尿肌无力、子宫内膜异位症、反复尿路感染、膀胱癌患者,且均未服影响膀胱功能的药物。匹配30例性别相同、体重相近(±5 kg)、膀胱镜下诊断为膀胱癌的患者作为对照组,排除膀胱镜下表现为典型间质性膀胱炎的患者。在膀胱镜下采集实验组患者的膀胱组织和对照组的癌旁健康膀胱组织后,固定于40 g/L多聚甲醛,后续行HE染色、TB染色及免疫组织化学染色。所有参与者均签署知情同意书,并经新疆医科大学第一附属医院委员会批准。
1.3 大鼠尿液中组胺的测定大鼠模型处死前,使用无菌塑料容器分别采集实验组和对照组大鼠尿液样本,随后将尿液于3 000 rpm离心10 min,收集上清并加入生物素抗体工作液50 μL,37 ℃孵育45 min。随后洗板3次,加入酶结合物工作液,37 ℃孵育30 min。最后加入显色剂(盐酸盐水合物),37 ℃避光孵育15 min。孵育结束后立即用酶标仪在450 nm波长测量各孔的光密度(optical density,OD)值。
1.4 HE及TB染色将收集的膀胱组织置于40 g/L多聚甲醛,固定、脱水、包埋制备蜡块,选择连续的切片进行染色。HE染色:切片用苏木精染色10 min,流水下冲洗后,盐酸分化,伊红染色2 min,乙醇梯度每组随机抽取5个切片,在200及400倍放大倍数下观察所有切片。TB染色:切片入预热60 ℃的TB染色液40 min,蒸馏水洗3次,体积分数为95%乙醇快速分化,脱色。利用Axioplan 2 imaging显微图像分析系统(放大倍数:大鼠模型×200,临床样本×400)选择5个视野的肥大细胞,并记录脱颗粒数。
1.5 采用RT-PCR检测TLR4 mRNA表达RT-PCR检测实验组及对照组大鼠膀胱组织内TLR4 mRNA的表达。取大鼠膀胱组织,采用Trizol试剂盒提取总RNA,测定RNA浓度,根据TaKaRa逆转录试剂盒反应条件生成对应cDNA模板。引物由上海生工生物公司设计并合成:大鼠TLR4上游引物序列:5’-TGG TGGCTGTGGAGACAAAAATGAC-3’,下游引物序列:5’-CTGAAA GGCTTGGGCTTGAATGGAG-3’;以GAPDH为内参,其上游引物序列: 5’-ACAGCAACAGGGTGGTGGAC-3’,下游引物序列:5’-TTTGAGGGTGCAGCGAACTT-3’。每组的引物各加入20 μL反应体系,混匀后放入PCR仪。采用2-△△Ct比较样本mRNA的相对变化。
1.6 免疫印迹试验(Western blot)从液氮中取出膀胱组织,在微量天平上称重,切成小块(1~2 mm3)。采用PIPA试剂盒(HAT,西安)操作说明书提取组织蛋白,BCA试剂盒(HAT,西安)测量蛋白质浓度,随后按25 μg/孔行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,随后250 mA恒流条件下转膜2 h,洗膜,封闭,进行一抗孵育:anti-TLR4抗体(1∶800,Bioss,中国)、anti-β-actin抗体(1∶3 000,Bioss,中国),4 ℃摇床过夜,洗膜后于1∶5 000二抗室温孵育1 h,充分洗膜后,ECL显色液发光。
1.7 免疫组织化学染色将石蜡切片在60 ℃温度下烤片2 h,二甲苯脱蜡、梯度乙醇入水,使用胃蛋白酶37 ℃孵育1 h,体积分数为0.3%的过氧化氢孵育30 min,使用血清封闭液封闭组织30 min,随后切片使用TLR4抗体(1∶200,Bioss,中国)4 ℃孵育过夜;次日,切片室温复温1 h,滴加酶抗山羊抗兔IgG聚合物孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精染核,盐酸分化后用中性树胶封片。阳性细胞镜下显示为黄褐色,用400倍放大倍数观察膀胱组织中TLR4阳性细胞数,每个组织随机选取5个非连续视野进行计数后取均值。
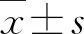
2 结 果
2.1 动物模型
2.1.1大鼠尿液中的组胺水平 Elisa法检测大鼠尿液中组胺表达水平,结果显示IC/BPS组大鼠尿液中组胺水平较对照组显著升高(图1)。
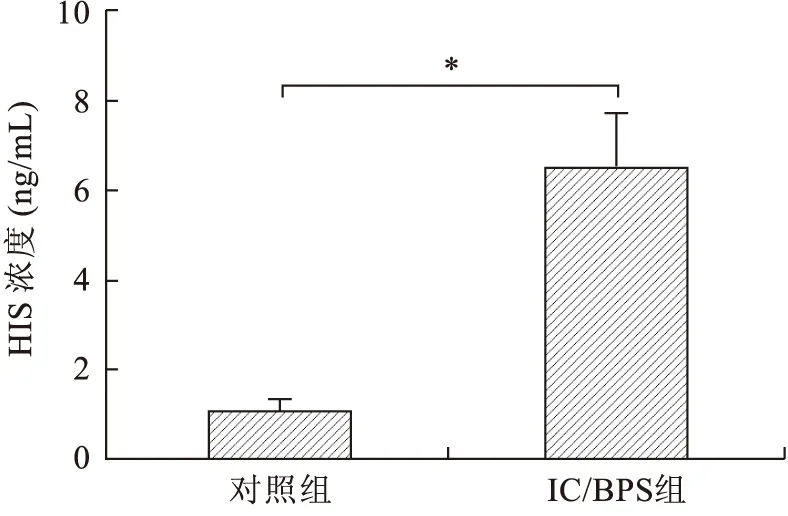
图1 实验组与对照组大鼠尿液中组胺含量(*P<0.05)
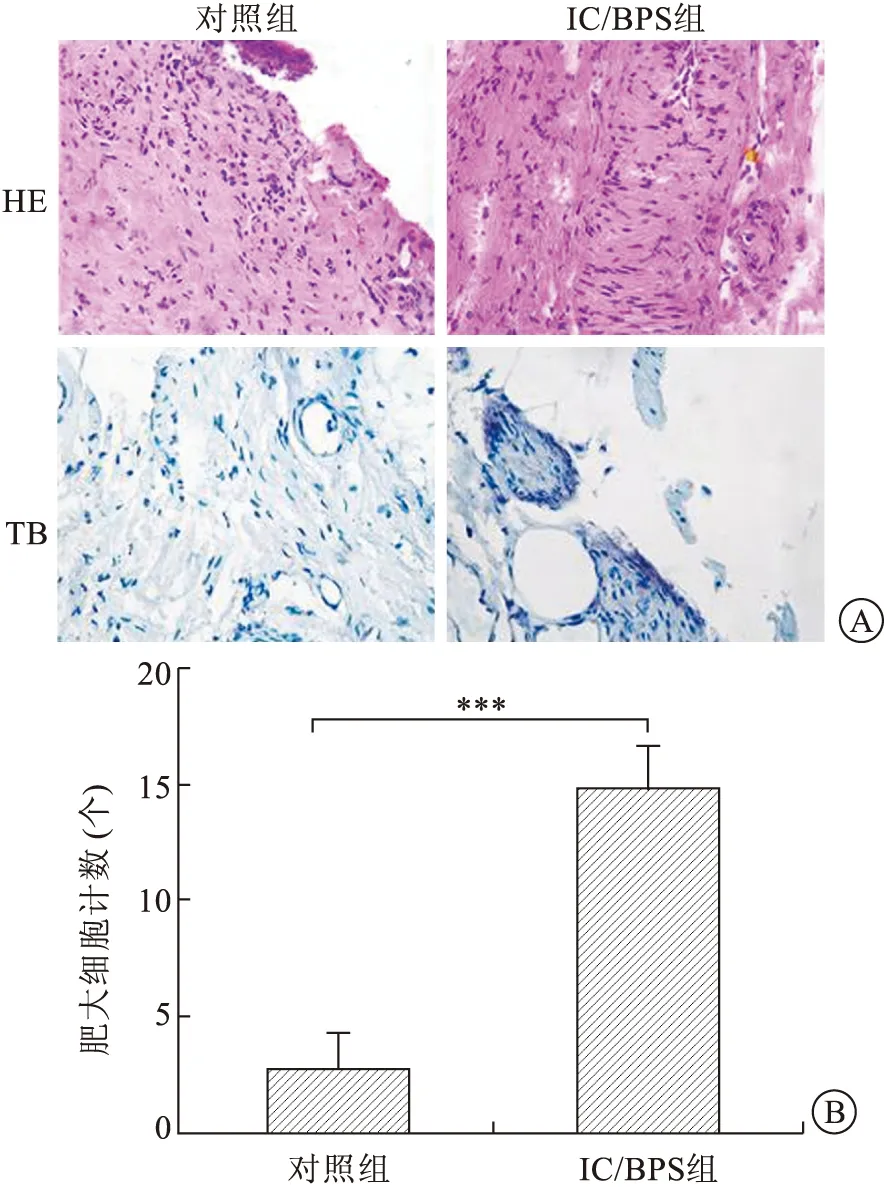
2.1.2各组大鼠膀胱组织炎性变化 HE染色显示,与对照组相比,IC/BPS雌性大鼠膀胱黏膜上皮变薄、充血水肿,固有层浸润,膀胱组织可见大量炎性细胞浸润;对照组膀胱上皮完整,未见炎性细胞浸润(图2A)。TB染色肥大细胞呈紫色显示IC/BPS雌性大鼠膀胱壁上皮严重损伤,肥大细胞数目急剧增多,且多分布于黏膜下层,主要呈脱颗粒状态肥大细胞存在(图2A)。对实验组与对照组大鼠膀胱组织内肥大细胞计数,发现IC/BPS组大鼠膀胱组织内肥大细胞数较对照组显著增多,差异具有统计学意义(P<0.05,图2B)。
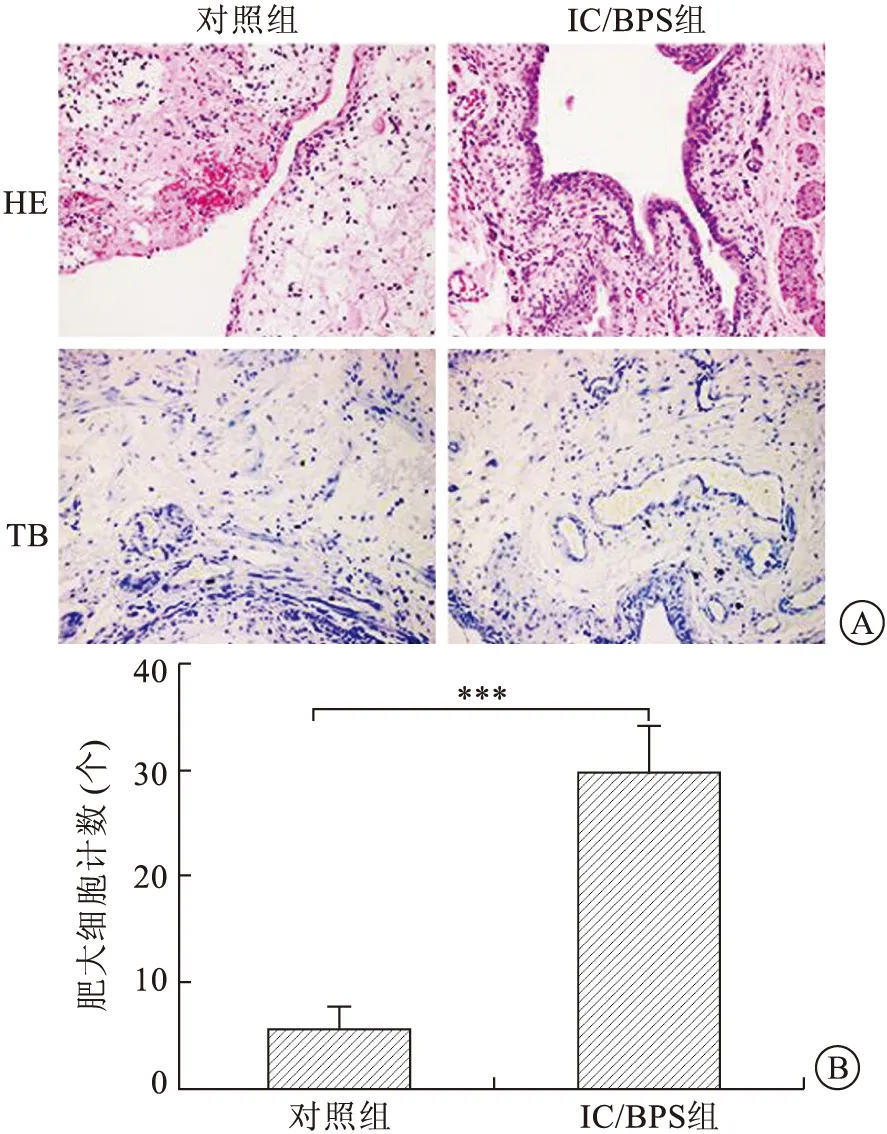
A:HE染色(×200),TB染色(×200);B:IC/BPS组及对照组膀胱组织内肥大细胞计数,***P<0.05。图2 两组大鼠膀胱HE染色及TB染色结果
2.1.3实验组与对照组大鼠膀胱组织TLR4的表达 本实验采用RT-PCR、Western blot和免疫组织化学染色检测TLR4在IC/BPS组大鼠及对照组大鼠膀胱组织内mRNA及蛋白表达水平。RT-PCR分析显示,IC/BPS大鼠膀胱中TLR4基因表达明显高于对照组,差异具有统计学意义(P<0.05,图3A)。Western blot检测结果显示,IC/BPS组TLR4蛋白表达量显著高于对照组(P<0.05,图3B)。针对大鼠膀胱组织标本免疫组织化学染色结果(图3C),TLR4阳性细胞被染为棕色,主要表达于膀胱黏膜层,IC/BPS组大鼠膀胱组织内TLR4阳性细胞数较对照组显著增高(P<0.05,图3D)。
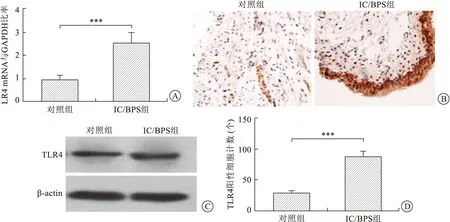
A:实验组和对照组大鼠膀胱组织的TLR4基因水平比较,***P<0.005;B:两组TLR4蛋白水平比较;C:大鼠膀胱组织标本免疫组织化学染色(×400);D:实验组和对照组膀胱组织的TLR4阳性细胞计数,***P<0.05。图3 实验组与对照组大鼠膀胱组织TLR4的表达
2.2 临床样本
2.2.1HE染色及TB染色 HE染色所见与大鼠IC/BPS模型相一致,IC/BPS患者膀胱组织可见大量炎性细胞浸润,膀胱黏膜上皮损伤,剥脱并可见组织充血水肿等;与IC/BPS组相比,正常组膀胱上皮完整,未见炎性细胞浸润(图4A)。TB染色发现,IC/BPS患者膀胱黏膜固有层和逼尿肌中可见肥大细胞浸润,肥大细胞脱颗粒现象严重(图4A);与对照组相比,IC/BPS患者膀胱组织中肥大细胞数目显著增多,具有统计学意义(P<0.05,图4B)。
A:HE及TB染色(×400);B:对照组及IC/BPS组患者膀胱组织内肥大细胞计数,***P<0.001。图4 临床样本膀胱组织HE染色及TB染色
2.2.2两组膀胱黏膜组织中TLR4的表达情况 为证实女性IC/BPS患者膀胱组织内TLR4的表达水平,对女性IC/BPS患者膀胱组织和对照组癌旁健康膀胱组织进行免疫组织化学染色。与大鼠模型一致,免疫组织化学染色显示,间质性膀胱炎组TLR4阳性细胞数较对照组显著增高,差异具有统计学意义,***P<0.05,图5。
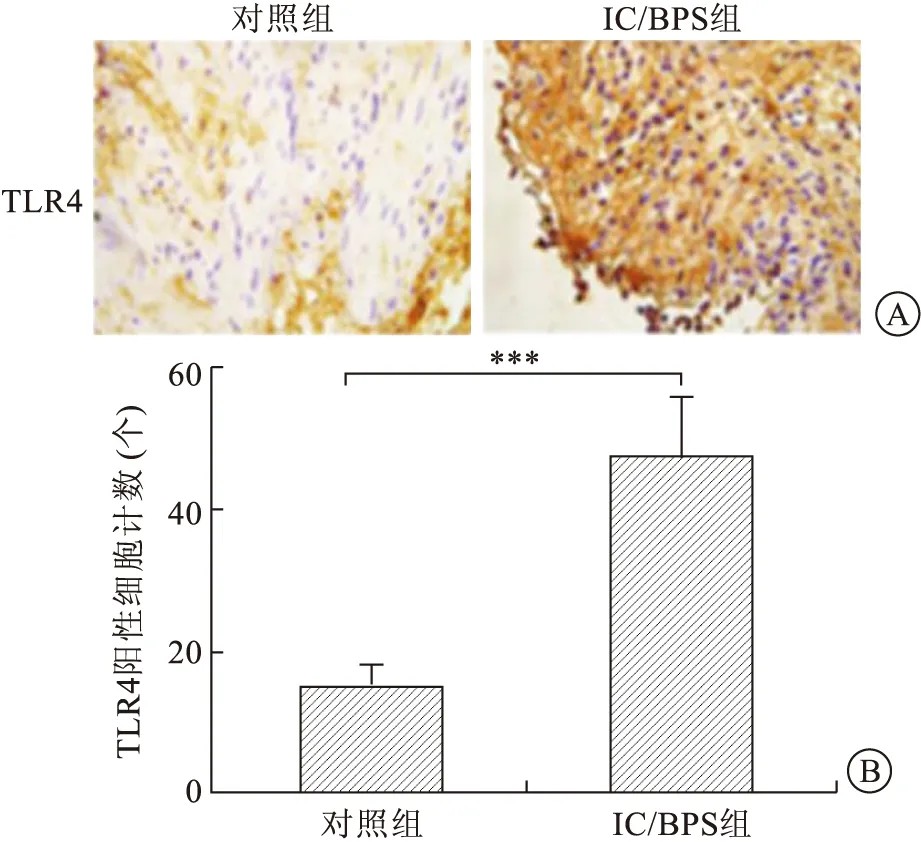
A:TLR4阳性染色细胞免疫组化染色呈现黄棕色(×400);B:IC/BPS组患者膀胱组织及对照组癌旁健康膀胱组织中TLR4阳性细胞计数,***P<0.001。图5 临床样本膀胱组织中TLR4的表达
3 讨 论
欧洲间质性膀胱炎研究学会(European Society for Study of interstitial cystitis,ESSIC)指出IC/BPS的临床诊断为6个月以上的与膀胱相关的骨盆疼痛或不适,并至少伴有一种尿道症状,如尿急或尿频[10]。值得注意的是,近年来,我国IC/BPS的确诊率不断上升,对患者的身心健康造成极为消极的影响。临床诊疗中,IC/BPS的治疗包括:神经调节、膀胱冲洗、手术及药物治疗等,但均未获得满意的临床疗效[11]。因此,研究IC/BPS的发病机制并寻找新的治疗方法具有重要的临床意义。TLR4已被证实表达于人和鼠的膀胱组织[12],并在膀胱肿瘤疾病的发生发展过程中起到了重要作用[13-14]。近年来,TLR4在心肌、肝脏及脑缺血等非生物性炎症损伤研究较多[15],而在IC/BPS发病机制中的作用尚未可知。
有研究表明间质性膀胱炎患者的膀胱活检标本中可见抗核抗体,这提示IC/BPS可能是一种自身免疫性疾病。IC/BPS与自身免疫性疾病还具有很多相似点,如好发于中年女性、部分患者有过敏史,患者中罹患类风湿关节炎、干燥综合征、系统性红斑狼疮等概率明显高于正常人,免疫抑制剂治疗有效[16]。TLR4受体是TLR家族的成员之一,属于Ⅰ类跨膜受体,参与机体免疫应答启动环节[17]。该受体以病原体相关分子模式(pathogen-associat-ed molecular patterns,PAMP)识别配体,如革兰阴性菌细胞壁成分的脂多糖、脂寡糖、细菌内毒素和病毒、真菌等,还以危险/损害相关分子模式(danger/damage-associated molecular patterns,DAMP)识别内源性配体,如对感染产生的各种内源性分子,启动信号转导途径,从而参与机体的固有免疫与获得性免疫造成组织损伤[18-19]。TLR4的激活是机体抵抗外界的第一道防线,但信号的过度活化也会导致高水平炎性细胞因子的分泌,从而加重细胞的损伤,打破机体对自身抗原的免疫耐受,促进自身免疫性疾病的发生发展[20]。在本研究中,通过建立IC/BPS大鼠模型和临床收集女性IC患者的膀胱组织,证实在IC/BPS发生发展过程中TLR4受体表达水平显著上调,因此推测TLR4在IC/BPS发病过程中具有一定作用。
迄今为止尚无诊断IC/BPS的金标准[21]。因为缺少特异性表现,IC/BPS的诊断更多倾向于临床症状。美国泌尿外科指南建议采取排除性诊断方法来诊断IC/BPS,必要时可行膀胱镜检查和病理活检。有研究显示IC/BPS的主要病理变化是肥大细胞在膀胱肌层和黏膜下层活化和聚集[22],肥大细胞的功能是释放炎性介质和细胞因子。它的胞质中含有大量的分泌颗粒,当受到刺激应答时,肥大细胞就会脱颗粒释放多种血管活性物质参与免疫应答,例如组胺、前列腺素、白三烯、血小板活化因子等。这些生物活性物质可导致神经元致敏和神经递质的释放,进一步刺激肥大细胞,这种恶性循环可能导致了IC/BPS慢性疼痛的症状[23]。本研究中IC/BPS建模时先向膀胱内灌注1 mL硫酸鱼精蛋白破坏大鼠的膀胱黏膜屏障,再灌注1 mL脂多糖,进一步通过损伤的膀胱黏膜渗透入膀胱基质,从而造成一系列的炎症反应。有研究表明肥大细胞分布有广泛的TLR4受体[19],当膀胱肌层肥大细胞计数超过20个/mm2,IC/BPS的诊断特异度和敏感度分别为88%和95%[24]。本实验通过RT-PCR、蛋白免疫印迹、免疫组织化学染色等证实IC/BPS大鼠膀胱组织中TLR4 mRNA及蛋白水平的变化,较对照组显著增高(P<0.05)。临床样本中,IC/BPS患者膀胱组织中TLR4蛋白水平急剧增高(P<0.05)。因此,我们推测靶向TLR4治疗可能会为IC/BPS的临床诊疗提供新的视角。
TLR4与配体结合后形成TLR4/MD-2复合物并二聚化,与MyD88的TIR结构域结合后激活MyD88,形成有活性的TLR4/MyD88复合物,激活IL-1R相关激酶4(IL-1R-associated kinase4,IRAK4),使IRAK1和IRAK2磷酸化后与TRAF6结合,活化IκB激酶(inhibitor of nuclear factor-κB kinase,IKK),促使NF-κB抑制因子(inhibitor of nuclearfactor-κB,IκB)磷酸化后从NF-κB上脱落,使NF-κB进入细胞核并激发后续反应[25],最终导致细胞因子和炎症介质的释放,引起免疫应答反应。下一步的研究将通过测定TLR4启动免疫反应后的下游分子NF-κB、P-NF-κB和MyD88的表达水平,进一步探讨TLR4/MyD88/NF-κB信号通路在间质性膀胱炎的潜在作用。
综上所述,对TLR4受体在间质性膀胱炎作用机制的进一步研究,将有助于阐明固有免疫的启动与机体应激反应性损伤之间的联系,并指出抑制TLR4的表达水平可能对患者IC/BPS的治疗有益。相信随着对TLR4研究的不断深入,会为临床疾病的治疗带来新思路。
本研究局限性在于:①本实验例数较少,需更大样本量进一步验证;②本研究提示TLR4在IC/BPS发病过程中具有一定作用。针对其具体的分子机制尚未说明,实验尚在进行中,后期将会整理并发表。