腹腔镜单侧肾上腺切除术治疗8例原发性双侧肾上腺大结节样增生患者的疗效随访
2021-11-06卢振权罗兵锋邢亚平朱逸飞罗光彦
卢振权,罗兵锋,袁 渊,梁 伟,张 咪,易 翔,邢亚平,朱逸飞,梁 拓,罗光彦
(1.香港大学深圳医院泌尿外科,广东深圳 518053;2.香港大学深圳医院内分泌科,广东深圳 518053)
原发性双侧肾上腺大结节样增生(primary bilateral macronodular adrenal hyperplasia,PBMAH) 是导致非依赖性库欣综合征(cushing’s syndrome,CS)的一种罕见的病因,可能和异位受体或遗传相关。尽管PBMAH发病率较低,仅占CS发病原因的不到2%[1-2],但是随着影像学技术的发展,PBMAH的检出率呈上升趋势。KIRSCHNER等[3]于1964年首次报道此病,通常表现为发生在肾上腺大小不等的结节状增生,其临床表现为CS的典型症状,如满月脸、水牛背、皮肤紫纹、痤疮等[4]。PBMAH在影像学[计算机断层扫描(computed tomography,CT)/核磁共振成像(magnetic resonance imaging,MRI)]上表现为双侧肾上腺弥漫性的增生大结节。在病理上,肾上腺皮质中异常膜受体的表达起重要作用[5]。镜下可见致密细胞和透明细胞,PBMAH多为良性疾病,目前尚未见文献报道有恶变。对于PBMAH的患者而言,控制皮质醇过多分泌的有效外科治疗方式有双侧肾上腺切除术、一侧肾上腺全切和对侧次全切除(先单侧肾上腺切除术,后期根据病情需求再决定对侧肾上腺的处理)。双侧肾上腺切除术不可避免地导致终生的激素替代治疗,可引起肾上腺危象[6-9]。而腹腔镜单侧肾上腺切除术对患者临床症状的改善和生活质量的提高具有优势,成为推荐的一线治疗方案[6-9]。本研究旨在探讨PBMAH患者腹腔镜单侧肾上腺切除术的治疗方式并评估其临床效果。
1 资料与方法
1.1 一般资料回顾性分析香港大学深圳医院2015年1月至2020年12月收治的8例PBMAH患者的临床资料,其中男性5例,女性3例。平均年龄50(34~61)岁。4例定性诊断为促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)非依赖性CS,4例定性诊断为ACTH非依赖性亚临床库欣综合征(subclinical cushing’s syndrome,SCS)。临床表现为高血压的有6例、典型CS临床表现者2例(满月脸及向心性肥胖)、糖尿病5例、低钾血症3例及脑血管意外后遗症1例。术前平均体重指数(body mass index,BMI)为28.3±2.81。1例患者6年前曾因PBMAH于外院行左侧肾上腺切除术,5个月前因血压升高伴头晕再次入院。
所有患者均完善内分泌检查和生化检查,内分泌检查包括血皮质醇(plasma cortisol levels,CRO),血ACTH、24 h尿皮质醇(urine free cortisol,UFC)水平,及大剂量、小剂量地塞米松抑制试验(high-dose dexamethasone suppression test,HDDST、low-dose dexamethasone suppression test,LDDST),详见表1。8例患者的血浆皮质醇浓度均失去昼夜节律变化,其中24 h UFC升高有4例[正常值58~403 μg·(dL·24 h)-1]。ACTH水平低下8例(正常值7.2~63.3 pg/mL),LDDST均不被抑制。24 h尿儿茶酚胺(catecholamine,CA)、24 h尿香草扁桃酸、卧位及立位高血压4项等检查均正常。8例患者均完成肾上腺CT平扫及增强检查,结合定位及定性诊断,8例均确诊为PBMAH。
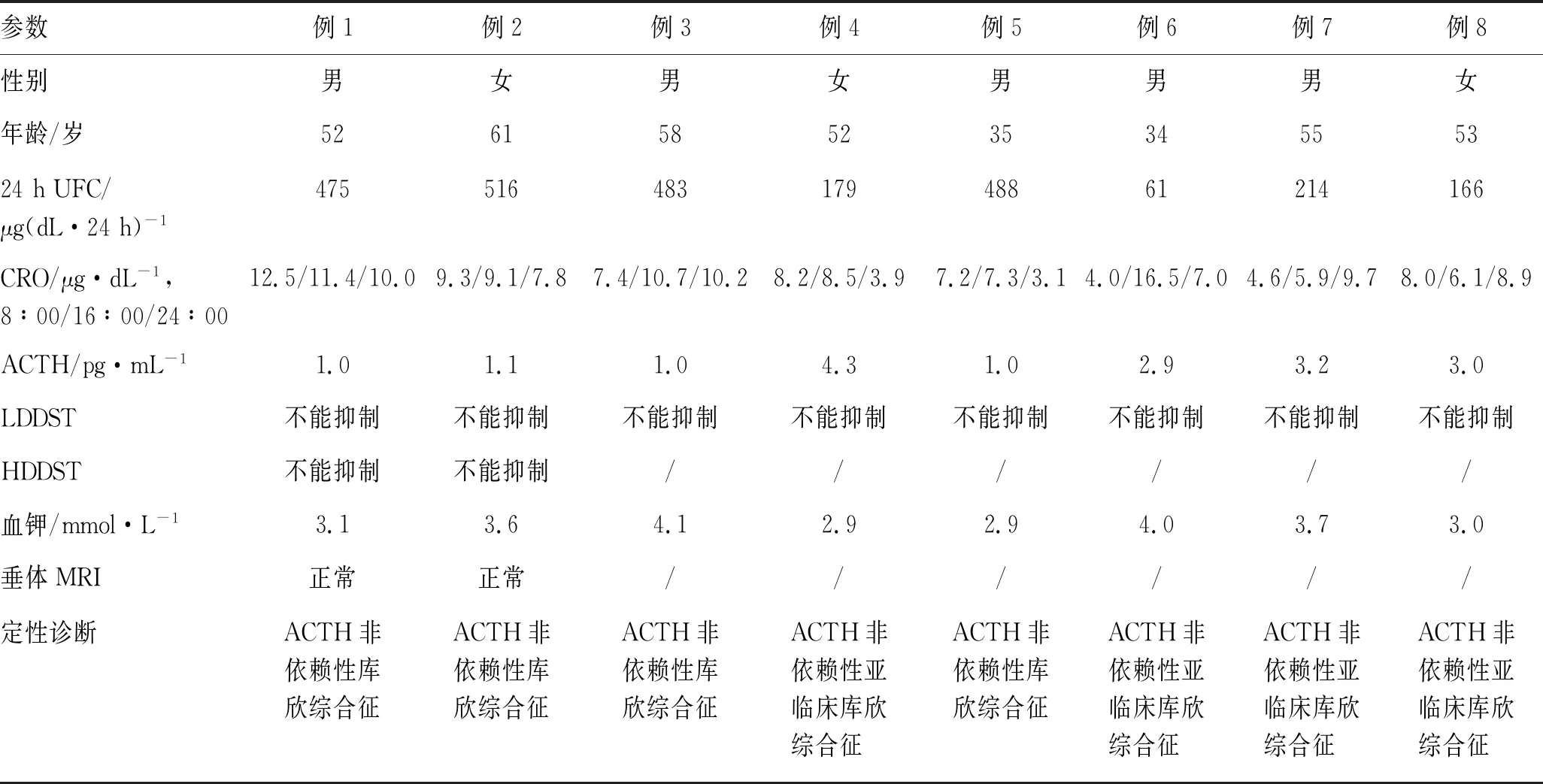
表1 8例PBMAH患者的临床资料
1.2 治疗方法所有患者术前均分别行多学科讨论,制定手术方案、围手术期及术后的激素补充及术后复诊方案。关于围手术期及术后的激素替代治疗,目前尚无统一方案,但是应该遵循下列基本原则:①手术中、手术当日静脉给予氢化可的松;②术后禁食期间可选择静脉给予氢化可的松,进食后给予口服泼尼松;③皮质激素剂量应当逐渐减量至停药。
经多学科讨论后制定的激素替代方案为:①手术当日给予氢化可的松50 mg,静脉滴注,6 h/次(术前2 h给予氢化可的松100~200 mg静脉滴注)。②术后第1天给予氢化可的松50 mg,静脉滴注,8 h/次,给药1~2 d。若病情平稳,给予氢化可的松50 mg,静脉滴注,12 h/次,给药1~2 d。术后第2天监测血清电解质水平、血浆ACTH及CRO水平。③后续改氢化可的松片40 mg上午口服,20 mg下午口服,每2 d减量1/2,逐渐减量至停药。
1.3 随访方法患者术后前2年内每3个月随访1次,以后每6个月随访1次。随访的内容包括临床表现、血常规、肝功能、肾功能、血钾、肾上腺相关激素水平与功能试验(ACTH、CRO、24 h UFC、LDDST、HDDST)、垂体及肾上腺MRI/CT等。注意是否有CS临床症状的复发。
2 结 果
2.1 患者临床及病理学表现8例患者接受了后腹腔镜途径的腹腔镜单侧肾上腺切除术,均获得成功,无手术并发症发生。7例为首次行单侧肾上腺切除术,另外1例6年前在外院诊断为PBMAH并行左侧肾上腺切除术,此次行右侧肾上腺切除术,术后需终身激素替代治疗。所有患者术后标本均可见肾上腺皮质多发结节状增生,增生的结节多为金黄色。镜下可见透明细胞和致密细胞等,未见核分裂象。病理结果提示5例为肾上腺皮质结节状增生,3例为肾上腺皮质腺瘤。
2.2 影像学结果肾上腺CT平扫显示增生结节为低密度,其CT增强扫描发现增生结节有不同程度的强化(图1)。在我们的研究中,CT结果显示7例为双侧肾上腺多发结节样增生,1例提示右侧肾上腺弥漫性增大伴多发结节(6年前已切除左侧肾上腺),肾上腺结节直径为2.2~9.5 cm,平均直径(5.02±2.58)cm,平扫CT值7~32 Hu,增强后CT值52~72 Hu。肾上腺MRI表现为肾上腺不规则肿块,其信号强度在T1加权上类似肝脏,在T2加权上略高于肝脏。增强T1加权并脂肪抑制像示肾上腺肿块呈中等程度强化。
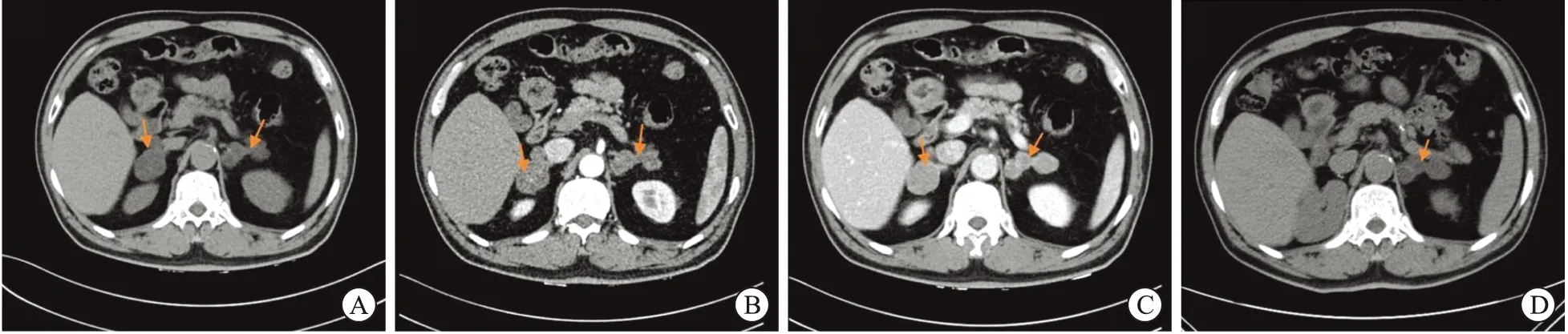
A:CT平扫显示双侧肾上腺结节状增生,增生结节呈低密度;B:CT增强扫描显示肾皮质期,双侧肾上腺增生结节边缘不均匀强化;C:CT增强扫描显示肾髓质期,双侧肾上腺增生结节呈中等程度均匀强化;D:患者术后2年复查,CT平扫示右侧肾上腺切除术后改变,左侧肾上腺增生结节未见明显增大。图1 原发性双侧肾上腺大结节增生患者的肾上腺CT扫描图(病例7)
2.3 患者预后所有患者平均随访30.5(19~48)个月,术前2例具有典型CS临床表现和体征的患者,皮质醇增多症症状缓解。8例患者术后的血压、BMI、24 h UFC水平等较术前有所下降,差异有统计学意义(P<0.01);患者术后ACTH水平较术前平均升高3.47 pg/mL(P=0.35);术后血钾均达到了正常范围,详见表2。5例糖尿病患者有3例血糖控制平稳,药量减轻。1例脑血管意外后遗症患者目前在康复科定期治疗,生活质量有明显改善。8例患者术后每3~6个月行CT复查,7例对侧肾上腺在随访期内无显著变化。上述患者随访中状态良好,暂未见病情复发者。
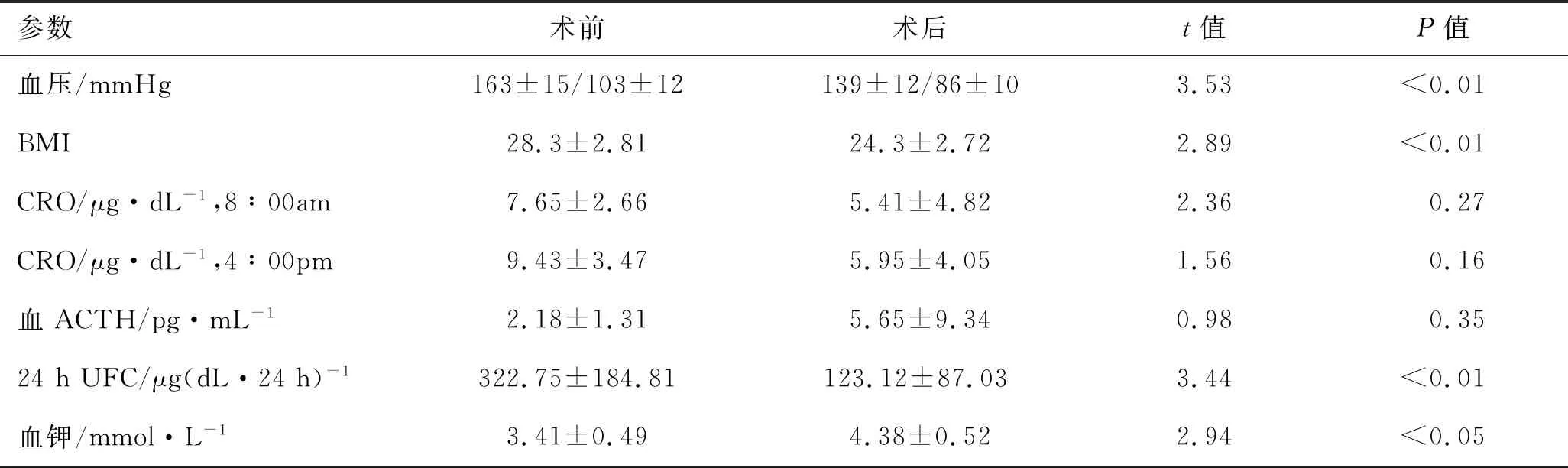
表2 8例PBMAH患者行单侧肾上腺切除术前及术后的临床随访数据比较
3 讨 论
PBMAH是CS的罕见类型,其病因不明[3],除和遗传相关外,精氨酸加压素受体的异位表达、抑胃肽、CA及抗利尿激素等受体在肾上腺异常表达或者过度表达,和PBMAH的发生、发展密切相关[10-12]。LOUISET等[13]研究表明30例PBMAH患者的肾上腺样本进行聚合酶链反应测定(polymerase chain reaction,PCR)和免疫组化分析,认为PBMAH的皮质醇异常分泌似乎受ACTH的调节,ACTH是由增生性肾上腺组织中类固醇生成细胞亚群产生的。因此,与PBMAH相关的皮质醇过多分泌似乎是ACTH依赖性的。PBMAH和基因突变也密切相关。ASSIÉ等[14]研究发现55%的PBMAH患者存在ARMC5基因突变。该基因的突变降低了ACTH受体表达,导致肾上腺细胞类固醇生成不足,致使肾上腺皮质弥漫结节状增生进而形成了CS。YOSHIDA等[15]研究发现PBMAH患者存在MEN1基因突变,并提示MEN1基因突变可能与PBMAH的发生有关。
PBMAH的确诊依赖于内分泌检查和CT或MRI扫描。内分泌检查需排除原发性醛固酮增多症及嗜铬细胞瘤等。肾上腺CT扫描属于PBMAH的定位诊断方式,成为影像学检查的首选。多层螺旋CT的空间分辨率高,能多平面重建,能够清晰地显示肾上腺增生结节和周围血管及脏器的解剖关系,为手术医生提供较高的参考价值[16]。典型的CT表现为双侧肾上腺多发结节样增生,结节互相融合。
大多数PBMAH患者的CS症状和体征并不典型,本组报道仅有2例具备典型CS的症状和体征,如满月脸、向心性肥胖、水牛背、皮肤紫纹、高血压等。PBMAH患者也可能因高血压、糖尿病等非特异性表现而就诊,该研究中因血压升高而就诊的有5例,占62.5%(5/8)。PBMAH需要和原发性色素结节性肾上腺皮质异常增生(primary pigmented nodular adrenocortical disease,PPNAD)鉴别[17-19],后者也是一种双侧肾上腺增生性疾病,为CS的一种罕见类型,此病发病年龄早,临床症状轻,同样为不依赖ACTH的双侧肾上腺增生性病变,但是PPNAD的双侧肾上腺多呈小结节样改变,结节直径通常<4 cm,脂褐色或者黑色素沉着结节为该病特征,与Carney综合征(一种常染色体显性遗传病)相关联。
PBMAH伴明显CS症状的患者,推荐双侧肾上腺切除术是标准的治疗方案[20-22],但术后需要终身激素替代治疗,术后患者易于发生肾上腺危象和Nelson综合征。故对于轻度或亚临床CS的患者则不建议上述方案。
近年来,越来越多的研究表明,单侧肾上腺切除术成为治疗PBMAH安全、有效的治疗方式,且推荐腹腔镜手术方案。当双侧肾上腺都有结节时,建议选择先切除结节较大侧的肾上腺,尽可能使得患者的高皮质醇状态得到最大程度缓解。若术后复查过程中,患者有复发,则考虑行对侧肾上腺全切除或者部分切除术。从国内研究来看,冒永鑫等[23]分析了46例PBMAH患者的临床资料,平均随访了26.93个月,29例未复发,其中13例复发的患者,行对侧肾上腺全切术或者次全切除术。张学斌等[1]报道了82例行单侧肾上腺全切术治疗PBMAH的患者,其中77例行腹膜后腹腔镜手术,5例行开放手术,随访时间3~156个月,63例(82.9%)患者术后1~60个月(平均14.6个月)症状复发伴24 h UFC升高,其中29例(46.0%)接受对侧肾上腺全切或次全切除术。2例因心血管意外和肺部感染死亡。从国外的研究报道来看,虽多为小型回顾性研究[24-27],但所报道患者的临床症状和生化指标都得到明显改善,同时单侧肾上腺切除术后对肥胖、高血压及糖尿病等皮质醇相关合并症的临床症状也有改善。SHEIKH-AHMAD等[28]报道了71例此病的临床数据(62例来自文献报道,7例来自于作者中心),均接受了单侧肾上腺切除术,经过(65.6±52.1)个月的随访,其中67例(94.4%)的CS症状得到明显缓解,4例CS症状持续存在。术后有13例(19.4%)复发,出现肾上腺功能减退21例(31.3%)。DEBILLON等[29]报道了15例患者接受较大侧肾上腺切除术,平均随访60个月,2例患者复发,其中1例接受了米托坦治疗,另外1例患者接受对侧肾上腺切除术。本研究回顾性分析了8例PBMAH患者,患者接受了后腹腔镜途径的单侧肾上腺切除术,平均随访30.5个月,患者复查的24 h UFC、CRO及血钾水平均在正常范围。术后的BMI及血压亦有明显改善,术后ACTH都较术前平均升高3.47 pg/mL。目前随访过程中,无1例复发。其中有1例患者为第二次手术行单侧肾上腺切除术(右侧),6年前因外院诊断PBMAH行左侧肾上腺切除术,但患者术后1年复发,伴高血压(很高危)、右侧脑梗塞等,高血压4种降压药物控制欠佳,常伴有头晕、头疼等不适,患者在脑梗塞半年稳定后再次来我院接受了腹腔镜对侧肾上腺切除术(后腹腔途径),术后予以长期的激素替代治疗。患者随访至今,目前服用1种降压药物,血压波动在120~130/75~90 mmHg,患者术后头晕、头疼等症状基本消失。当然,本研究不足之处在于样本量太少,随访时间不够长,手术治疗的远期效果需要更大样本的前瞻性研究和更长的随访时间来证实。
综上所述,PBMAH为CS的少见类型,临床表现多不典型,以CS常见。术前的内分泌检查和CT或者MRI扫描,对确诊PBMAH必不可少。双侧肾上腺切除术是PBMAH的标准治疗方案,其缺点是术后需要终身激素替代治疗,且易于发生肾上腺危象。相关的研究表明,腹腔镜单侧肾上腺切除术成为治疗PBMAH安全、有效的方式,多数患者的CS临床症状得到缓解,但是其缺点是一旦对侧复发,需要再次手术切除对侧。
