基于分布分数图对一元弱酸相关的滴定曲线的讨论
2021-11-05李娜
李娜
北京大学化学与分子工程学院,北京 100871
分布分数图是基于物料平衡原理与解离平衡表达式而绘制的,反映了体系中弱酸碱各相关物种的分布分数(浓度相对值)随pH的变化,在复杂体系的平衡处理中是一个基本且重要的关系式。分布分数在计算溶液pH、不同酸碱型体的浓度、缓冲容量,以及滴定误差等方面均有很好的应用[1–3]。本文基于分布分数对一元弱酸相关的滴定体系之滴定曲线进行讨论,包括一元弱酸的滴定,以及强酸与一元弱酸混合酸的滴定。为不影响讨论主线,本文略去一些基本pH计算以及误差计算过程。
1 一元弱酸的滴定曲线
酸碱滴定曲线是pH–T%函数,其中T%为滴定分数。滴定分数为100% (化学计量点,SP)、99.9%(计量点前0.1%,−0.1% SP)和100.1% (计量点后0.1%,+0.1% SP)是滴定曲线上最重要的三点。滴定分数在从99.9%至100.1%变化时,pH发生突然的改变,称为滴定突跃,pH变化范围称为滴定突跃范围。下面以0.1 mol·L−1NaOH滴定Ka在10−2–10−7之间的同浓度一元弱酸HA为例,对滴定曲线进行讨论。
强碱滴定一元弱酸的滴定分数:

式中:c(NaOH)为滴定剂NaOH的浓度,为0.1 mol·L−1,V(NaOH)为滴定过程中向弱酸溶液中加入0.1 mol·L−1NaOH的体积,ct(HA)为在任意V(NaOH)下,溶液中HA的总浓度,V(HA)为0.1 mol·L−1HA的起始体积。
计量点前,溶液组成为HA-A−,对于计量点前任意滴定分数T%,
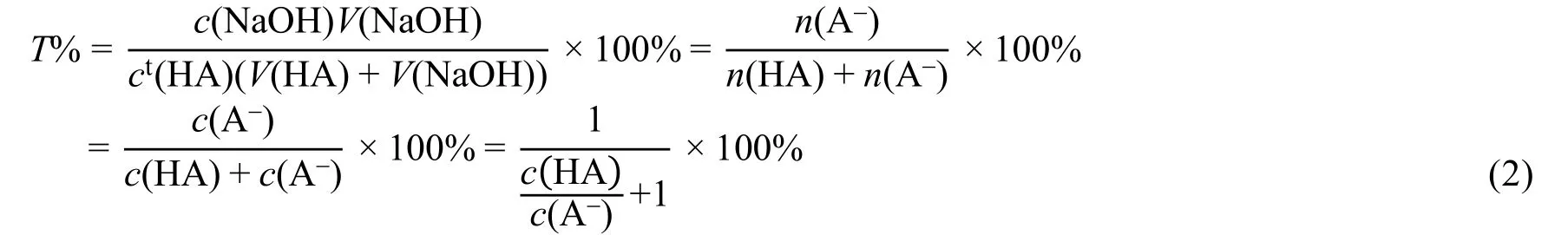
式中:n(HA)与n(A-)分别为HA与A-两种形态的量,c(HA)与c(A-)分别为HA与A-的分析浓度。
对于一元弱酸HA,A-的分布分数为:

由物料平衡式和电荷守恒式可以导出[1,2]:

计算溶液[H+]的公式为:

根据溶液的酸碱性可以选择使用:

或者,

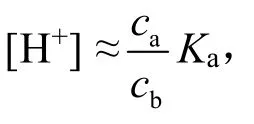

此时,x(A-) × 100%可以表示滴定分数。
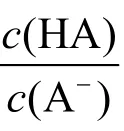
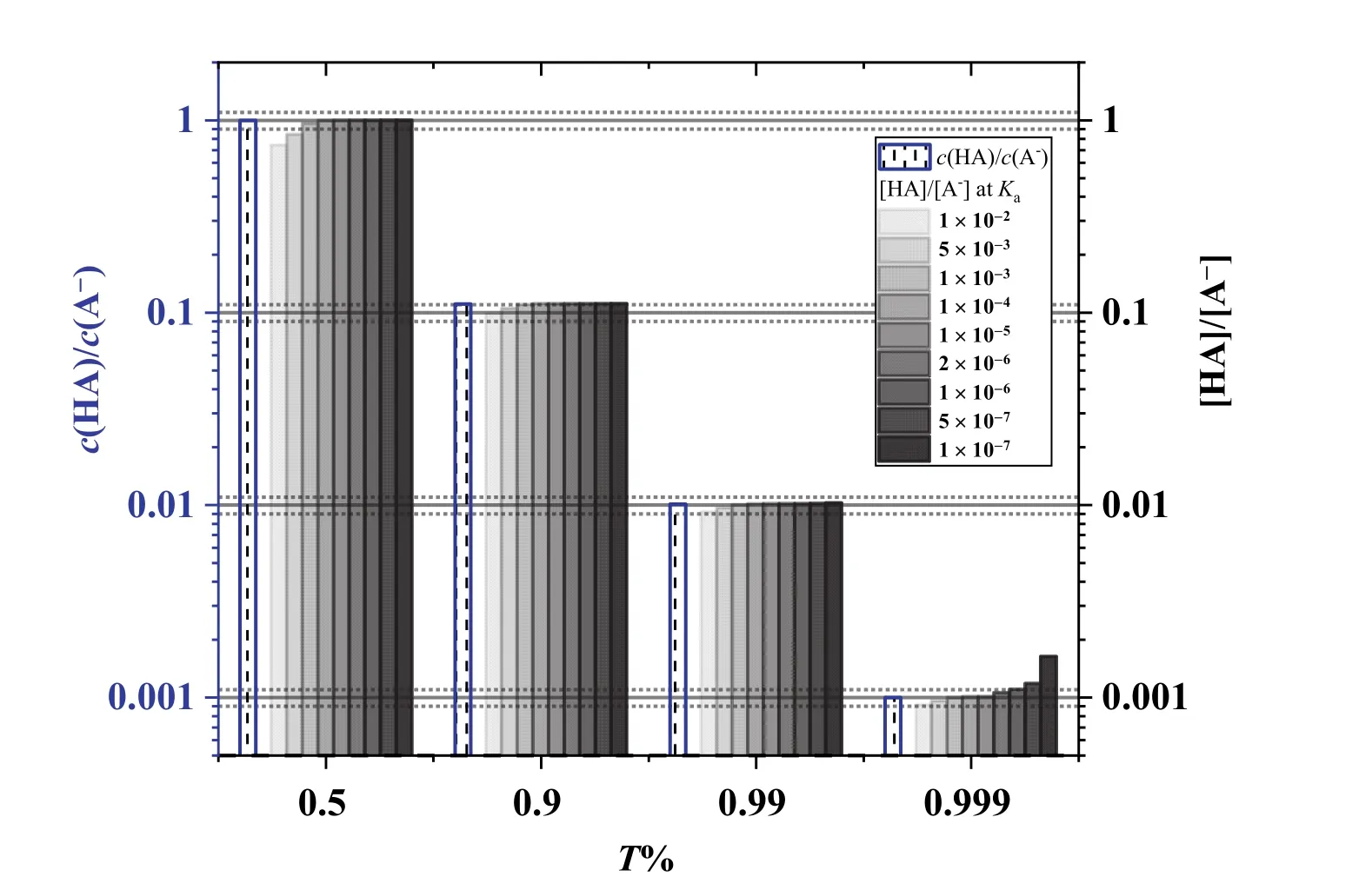
图1 滴定分数为50%,90%,99%,及99.9%时,不同Ka值的HA的以及由近似式求算的
当Ka>2 × 10−6,T% = 100.1%的pH由过量的NaOH计算,pH = 9.7。
因此,以0.1 mol·L−1NaOH滴定Ka≥ 2 × 10−6的同浓度一元弱酸HA,从分布分数图(图2)可以直观地看出来,滴定突跃范围为(pKa+ 3) − 9.7。对于常见的一元弱酸HAc,Ka= 10−4.76,滴定突跃范围为pH 4.76–9.7。滴定突跃范围随着Ka增大而增大,Ka增大10倍,pH (−0.1% SP)向酸性pH扩展1 pH。Ka=2 × 10−6时,滴定突跃范围为8.68–9.74,对应的[H+]浓度与最简式结果相比,误差为~5%,可以近似认为滴定突跃范围为(pKa+ 3) –9.7,即8.7–9.7。
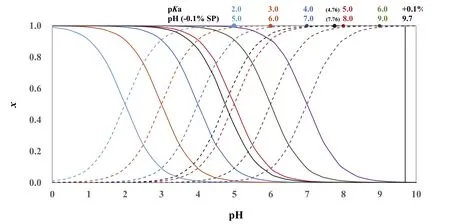
图2 10−2.0,10−3.0,10−4.0,10−4.76,10−5.0,10−6.0和10−7.0的一元弱酸的分布分数图
对于Ka为1 × 10−6的一元弱酸,计量点前0.1%的pH为8.96,对应的[H+]与最简式计算结果相比,误差~9%;计量点后0.1%时,质子条件式中[HA]与c(NaOH)相比不可忽略(c(NaOH) = 0.30[HA]),pH为9.77,与pH = 9.7相比,[H+]的误差约为−15%。对于Ka为1 × 10−7的一元弱酸,同样道理,无法使用最简式从分布分数图获得滴定突跃范围,由近似计算得滴定突跃范围为9.70–10.00;假设可以选到正好在化学计量点的pH变色的指示剂,由于人眼观测滴定终点有±0.3 pH单位的不确定性,终点范围将是9.85 ± 0.3,即9.55–10.15,对应于±0.2%滴定误差;此时若把浓度提高至10倍,即1 mol·L−1,虽然−0.1% SP的pH计算仍不能采用最简式,但是滴定突跃为9.93–10.70,如果选择恰好在化学计量点的pH变色的指示剂,终点范围(10.35 ± 0.3)包含在滴定突跃范围内,滴定误差在±0.1%范围。
下面讨论分布分数对滴定误差的影响。当弱酸的酸性不太强时,只能选择弱碱性范围变色的指示剂,如酚酞(PP),PP的变色点pH = 9.0。
0.1 mol·L−1NaOH滴定同浓度的HA,根据误差定义,并经合理近似,可得:

式中:下标ep表示滴定终点,sp表示计量点,csp(HA) = 0.05 mol·L−1。
在以PP指示的滴定终点,pHep= 9.0,[OH-]ep= 104× [H+]ep,[H+]ep与[OH-]ep相比,可被忽略,式(10)简化为:

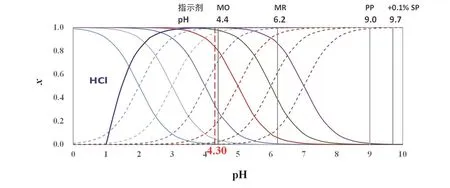
根据式(11),xep(HA)与E随Ka的变化如表1所示。当HA的酸性较强时,离解度大,xep(HA)较小。当Ka≥ 5 × 10−5时,xep(HA) ≤ 10% × 10-3.7,忽略xep(HA),误差主要受溶液中的[OH−]ep影响,E= 0.02%;若10% × 10−3.7 表1 0.1 mol·L−1 NaOH滴定同浓度HA的滴定误差(PP指示剂,pHep = 9.0) 对于强碱滴定强酸和弱酸的混合溶液,以0.1 mol·L-1NaOH滴定同浓度的HCl和HA混合酸溶液(HA的Ka不同)为例进行讨论。HCl滴定分数随pH的变化,以及HA (不同Ka)的分布分数随pH变化如图3所示。 图3 Ka为10−2.0,10−3.0,10−4.0,10−4.76,10−5.0,10−6.0和10−7.0的一元弱酸的分布分数图,及以0.1 mol·L−1 NaOH滴定同浓度的HCl时滴定分数(T% / 10−2)随pH变化 首先,我们来讨论选择性滴定HCl的可能性与条件。 以0.1 mol·L−1NaOH滴定同浓度HCl的突跃范围为pH 4.3–9.7,在−0.1% SP,溶液的pH = 4.30。欲选择滴定强酸和弱酸混合体系中的强酸,终点为弱酸HA体系,须需选择酸性pH范围变色的指示剂。 选择滴定HCl时,根据误差定义,经过合理近似,可得: 使用甲基橙作指示剂时,pHep= 4.4,则式(12)为: 如表2所示,当Ka在10−2.0–10−6.0范围,xepA-≥ 30 × 10-3.1,E主要由xepA-贡献,xepA-> 0.02,即有超过2%的HA参与反应,消耗NaOH,此时无法以不超过±0.1%的误差选择滴定其中的强酸HCl;当Ka= 10−7.0,xep(A-) = 3 × 10-3.1,xep(A−)与10−3.1的贡献不能忽略,此时误差由二者之差决定,误差达到最小值,有0.2%的弱酸被滴定,此时滴定HCl的误差为0.2%。当Ka为10−7.0时,滴定HCl完成后,如前节讨论,可以继续滴定Ka为10−7.0的弱酸。 若以甲基红(MR)为指示剂,滴定终点pH为6.2,即使对于Ka为10−7.0的一元弱酸,也有13.7%的酸参与反应,无法实现选择滴定HCl,也无法实现混合酸总量滴定。 对于Ka≥ 10−7.0的一元弱酸,无法选择滴定HCl,但是可以滴定混合酸总量。原理如前节所述,在此不作详细论述。滴定弱酸,需选择在碱性范围变色的指示剂,如酚酞,pHep= 9.0。 根据滴定总酸量的误差定义,并作合理近似,得: 使用酚酞为指示剂时,滴定终点pH为9.0,式(14)近似为: 根据式(15),xep(HA)与E随Ka的变化如表2所示。当HA的酸性较强时,离解度大,xep(HA)较小。合酸总量的误差是0.1 mol·L−1NaOH滴定同浓度相同弱酸的一半。根据误差定义,混合酸的总量是弱酸的2倍,这个结果也是合理的。 表2 0.1 mol·L-1 NaOH滴定同浓度的HCl与HA混合酸的滴定误差 综上,本文讨论了直接通过分布分数获得一元弱酸滴定突跃范围的可行性以及分布分数滴定误差的影响。由于分布分数受弱酸的Ka以及溶液的pH影响,因此必然影响滴定突跃范围和滴定误差,通过这些讨论有助于深入理解酸碱平衡与酸碱滴定。
2 强酸和一元弱酸混合溶液的滴定曲线






3 结语
