牛樟芝多糖对脂多糖应激黄羽肉鸡生长性能和空肠黏膜完整性的影响
2021-11-05叶金玲范秋丽林厦菁王一冰苟钟勇蒋守群
叶金玲 范秋丽 林厦菁 王一冰 张 盛 苟钟勇 蒋守群
(广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640)
在正常生理条件下,肉鸡机体氧化与抗氧化常处于动态平衡中,但许多外源或内源性刺激均可导致机体处于氧化应激状态,这对肉鸡的健康养殖造成了严重的影响[1-2]。肠道是动物体内最重要的消化器官,也是体内第一个遭受到氧化损伤的器官。致病性大肠杆菌可以损伤鸡肠道黏膜结构,导致氧化应激,进而影响肠道健康[3-4]。脂多糖(lipopolysaccharide,LPS),也称作细菌内毒素,是革兰氏阴性菌细胞壁脂质双分子层的外层结构,是构建肠道炎症较好的激活剂[5-6]。众多研究学者通过腹腔或静脉注射LPS引发肉鸡发生急性炎症反应,并发现LPS还促进了炎症细胞因子的产生和炎症关键基因的表达[7-9]。
多糖主要是从植物、菌类等中提取的一种多聚糖,能够提高机体免疫力和抗氧化水平,并具有抗肿瘤和抑菌等多种生物活性,同时具有安全低毒、无耐药性、无污染和无残留的特性[10-13]。研究表明,在饲粮中添加黄芪多糖(Astragaluspolysaccharide,APS)和人参多糖均可以通过减轻LPS引起的免疫应激,改善肠道屏障功能,进而显著提高断奶仔猪的平均日增重(ADG)和饲料转化率[12];在饲粮中添加2 g/kg的枸杞多糖可以增强肉鸡消化酶活性、抗氧化能力和免疫力,进而提高其生长性能[13];在饲粮中添加1 000~4 000 mg/kg海藻多糖可促进肉鸡生长性能的提高,增强其抗氧化性能,并从形态、抗氧化状态和肠道黏膜通透性等方面改善肠道屏障功能[11]。因此,天然活性多糖是目前一种很有前途的可替代抗生素的饲料添加剂。研究证实,食药用真菌子实体多糖、菌丝体多糖和胞外多糖具有较强的抗氧化活性,且主要通过清除氧自由基、激活细胞外信号等途径发挥抗氧化作用[14]。牛樟芝(Antrodiacinnamomea)为我国台湾地区特有的真菌品种,又有牛樟菇、樟芝、红牛樟芝和血灵芝等诸多别名。多糖是牛樟芝的主要活性成分,且主体结构是葡萄糖,但其活性多糖是D-葡聚糖大分子结构[15]。虽然多糖在肉鸡上的研究报道相对较多,但主要集中在APS、枸杞多糖和藻类多糖(algae-derived polysaccharide,ADP)等,牛樟芝多糖(Antrodiacinnamomeapolysaccharide,ACP)的研究报道较少。为此,本试验拟研究ACP、APS和ADP对快大型黄羽肉鸡生长性能和空肠黏膜完整性的影响,以期为ACP应用于肉鸡生产,改善其肠道健康、促进生长和提高养殖效益提供理论依据和参考。
1 材料与方法
1.1 试验材料
LPS(血清型为O55∶B5,货号L4005)购于Sigma公司;ACP(有效成分为D-葡聚糖,含量为76.3%)由台湾某股份有限公司提供;APS(富含APS和黄芪甲苷,多糖含量为45%)购自北京某科技股份有限公司;ADP(有效成分为β-1,3-葡聚糖,含量为45%)购自珠海某科技有限公司。
1.2 试验动物及设计
试验在广东省农业科学院动物科学研究所试验场进行。选用1 200只健康状况良好的9日龄快大型岭南黄羽肉鸡(母雏),逐只称重,根据体重一致原则分为8个组(每组6个重复,每个重复25只鸡),分别为:空白对照组(基础饲粮)、LPS应激组(基础饲粮+LPS应激)、抗生素组(基础饲粮+LPS应激+20 mg/kg维吉尼亚霉素)、100 mg/kg ACP组(基础饲粮+LPS应激+100 mg/kg ACP)、200 mg/kg ACP组(基础饲粮+LPS应激+200 mg/kg ACP)、400 mg/kg ACP组(基础饲粮+LPS应激+400 mg/kg ACP)、400 mg/kg APS组(基础饲粮+LPS应激+400 mg/kg APS)和200 mg/kg ADP组(基础饲粮+LPS应激+200 mg/kg ADP)。于18和20日龄,空白对照组每只鸡腹腔注射0.50 mL的生理盐水,其他组分别腹腔注射0.50 mL的LPS(500 μg/kg BW)。试验期21 d。
1.3 饲养管理
试鸡平养于封闭式鸡舍,地面铺放木屑,自由采食颗粒料和饮水,各组饲养管理和环境条件一致,按照常规操作程序和免疫流程进行饲养和免疫。试验期间人工控制舍内光照,每天保持23 h光照,并自然通风。每天08:00、14:00和20:00记录鸡舍温度和相对湿度。
1.4 基础饲粮
试验采用玉米-豆粕型基础饲粮,根据《中国饲料成分及营养价值表2004年第15版》配制,其组成及营养水平见表1。基础饲粮营养水平参考广东省农业科学院动物科学研究所新制定的农业行业标准NY/T 3645—2020《黄羽肉鸡营养需要量》科学配制。各组饲粮营养水平保持一致,抗生素和其他多糖添加剂按照不同添加水平等重量替代统糠。
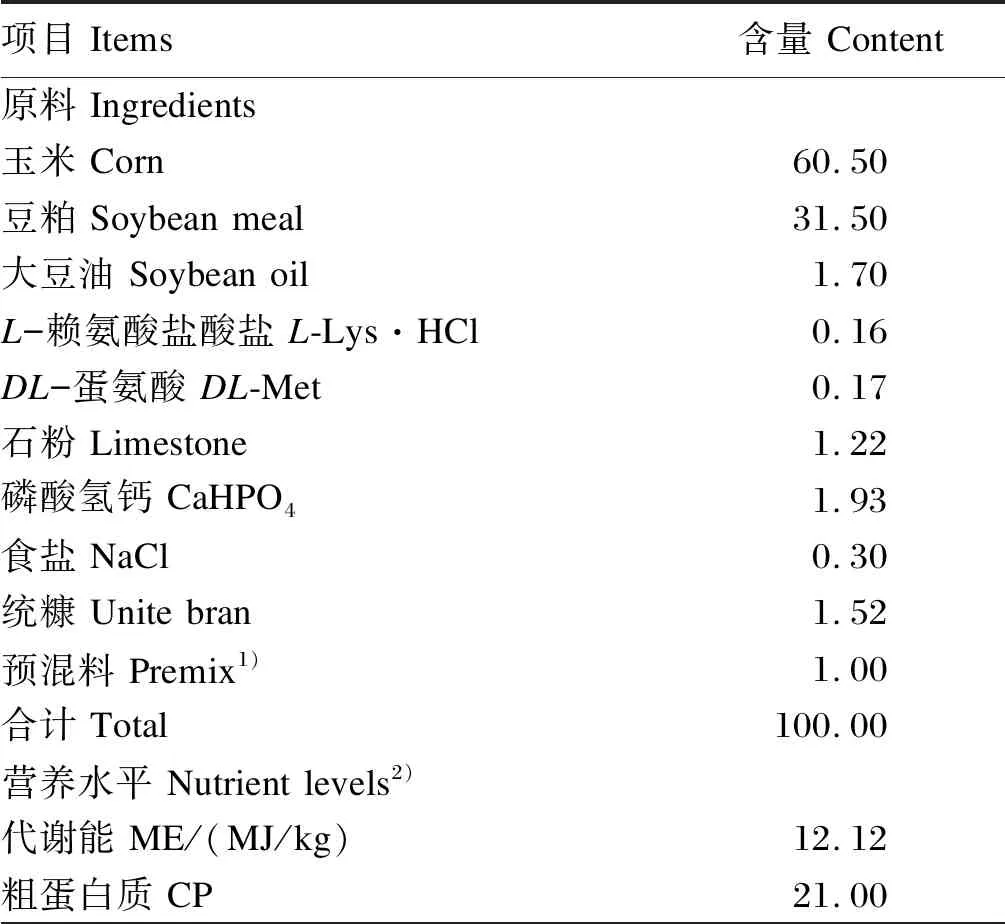
表1 基础饲粮组成及营养水平(饲喂基础)

续表1项目 Items含量 Content赖氨酸 Lys1.13蛋氨酸 Met0.45蛋氨酸+半胱氨酸 Met+Cys0.87苏氨酸 Thr0.83色氨酸 Trp0.25异亮氨酸 Ile0.86钙 Ca1.00非植酸磷 NPP0.45
1.5 指标测定与方法
1.5.1 生长性能
试验过程中,每天观察鸡只健康状况,一旦出现死鸡,立即称死鸡重和剩料量,以消除死鸡对试验结果的影响。记录死鸡数量,同时立即查明原因,采取适当措施。试验开始和结束前1天19:00对试验鸡断料、供水,次日07:00以重复为单位称重,统计耗料量,计算平均日采食量(ADFI)、ADG、料重比(F/G)和存活率。
1.5.2 样品的采集与指标检测
1.5.2.1 常规指标检测
于30日龄,每重复选取接近平均体重的2只鸡,翅静脉采血5 mL于加有肝素钠的抗凝管,1 200×g离心10 min取上清。屠宰后取出空肠,用预冷的生理盐水清洗内容物,纵向剖开,刮去内层黏膜装入1.50 mL离心管中,-80 ℃保存。常规制备空肠组织匀浆液,按照体积比加入9倍体积预冷的生理盐水,进行组织匀浆后低温离心(4 ℃、12 000×g,10 min),取上清。利用二喹啉甲酸(BCA)蛋白定量试剂盒(江苏凯基生物技术股份有限公司)测定上清中总蛋白含量。利用黄嘌呤氧化酶法测定血浆总超氧化物歧化酶(T-SOD)活性;二硫代二硝基苯甲酸(DT-NB)比色法测定血浆谷胱甘肽过氧化物酶(GSH-Px)活性;铁(Fe)氧化还原法测定血浆总抗氧化能力(T-AOC);硫代巴比妥酸(TBA)法测定血浆丙二醛(MDA)含量,以上试剂盒购自南京建成生物工程研究所。采用放射免疫法测定上清中肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和白细胞介素-10(IL-10)含量,所需试剂盒购自北京北方生物技术研究所。以上指标均在多功能酶标仪(Spectra max M-5,Molecular Devices,美国)上读数,各指标具体检测方法和结果计算均按照说明书进行。
1.5.2.2 空肠组织形态检测
每组肉鸡取出空肠后选取肠道中段1~2 cm用生理盐水进行冲洗,将冲洗干净的肠段放入提前准备好的4%多聚甲醛保存过夜,进行常规石蜡包埋后,采用苏木精-伊红(HE)进行染色处理,制成石蜡切片。采用Motic-BA210 Digital数码显微镜对每组切片进行40×视野拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件以40×标尺为标准,每张切片选取5根最完整的绒毛,分别测量绒毛高度、隐窝深度和肠壁厚度,并计算绒隐比(绒毛高度/隐窝深度)。
1.5.2.3 空肠结构完整性相关基因表达检测
空肠肠段清洗干净剪成2段放于1.50 mL离心管,-80 ℃保存。总RNA的提取按照Trizol试剂盒说明书进行操作,利用Nano-Drop 2000微量核酸测定仪检测RNA的总浓度和纯度。RNA反转录严格按照试剂盒说明书进行。实时荧光定量PCR(qRT-PCR)反应(Bio-Rad CFX System)为20.0 μL体系:iTaq Universal SYBR Green Supermix(Bio-Rad,美国)10.0 μL,上、下游引物(10 μmol/L)各1.0 μL,cDNA模板2.0 μL(10倍稀释),ddH2O 6.0 μL;每个样品3个重复孔。从GenBank中获得所测基因的序列取保守区域设计引物,并选用管家基因β-肌动蛋白(β-actin)基因作为内参基因。所需引物由上海生工生物有限公司合成,引物序列见表2,并用2-ΔΔCt法计算目的基因的mRNA相对表达量。

表2 实时荧光定量PCR引物序列
1.6 数据统计分析
试验数据采用SPSS 17.0软件中的one-way ANOVA进行单因素方差分析,在差异显著的基础上进行Duncan氏法多重比较,显著水平为P<0.05。试验结果均以“平均值±标准误”表示。
2 结 果
2.1 ACP对LPS应激黄羽肉鸡生长性能的影响
由表3可知,与空白对照组相比,LPS应激组肉鸡末重、ADFI和ADG显著降低(P<0.05),而饲粮添加不同多糖对肉鸡生长性能无显著影响(P>0.05)。与LPS应激组相比,其他组肉鸡ADFI均显著提高(P<0.05),且饲粮添加200 mg/kg ADP显著提高肉鸡ADG(P<0.05)。与抗生素组相比,饲粮添加不同多糖对肉鸡末重、ADFI和ADG均无显著影响(P>0.05)。此外,饲粮添加不同多糖组之间肉鸡生长性能均无显著差异(P>0.05)。
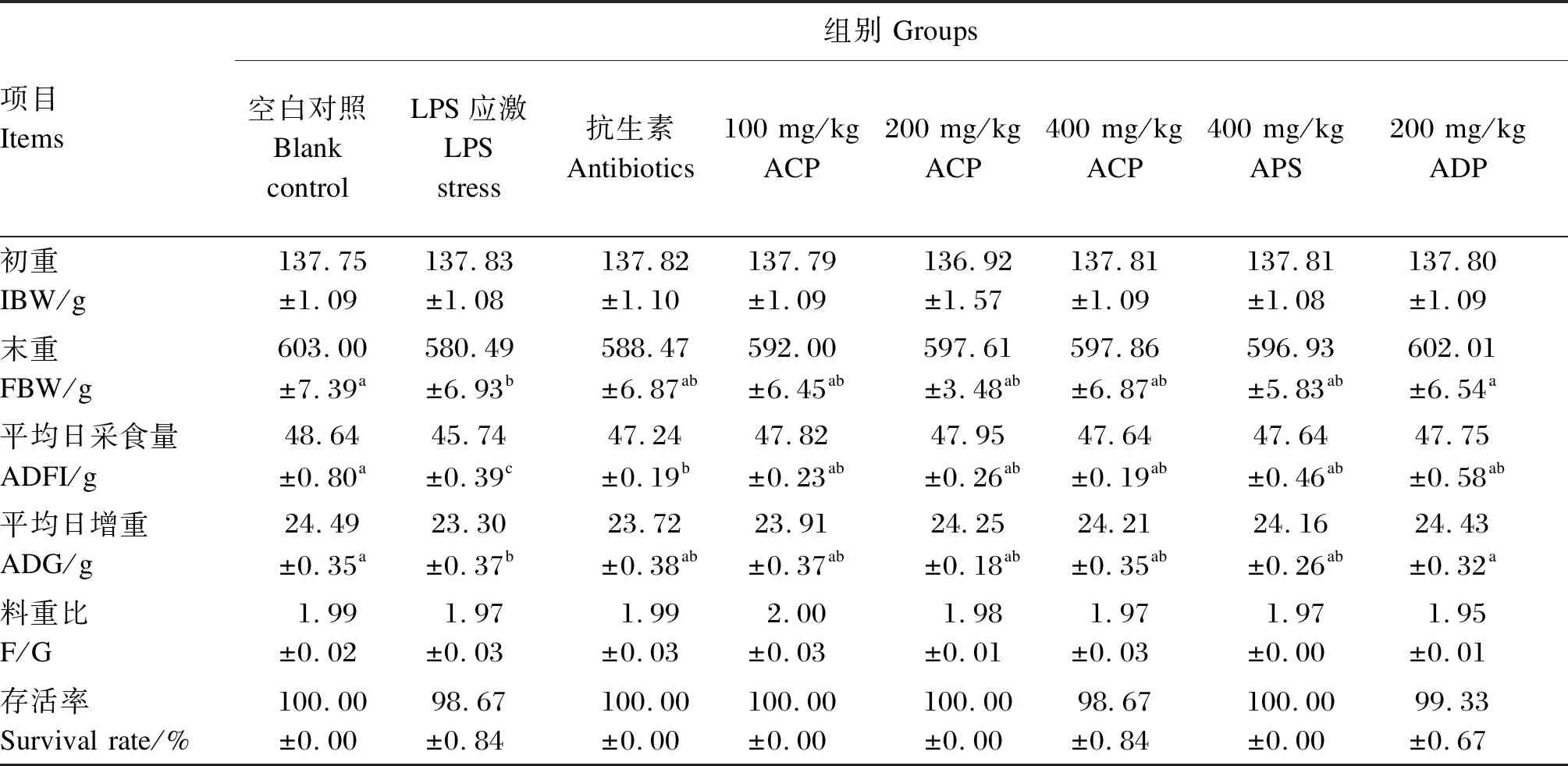
表3 ACP对LPS应激黄羽肉鸡生长性能的影响
2.2 ACP对LPS应激黄羽肉鸡血浆和空肠黏膜抗氧化能力的影响
由表4可知,与空白对照组相比,LPS应激组肉鸡血浆中T-AOC显著降低(P<0.05),血浆和空肠黏膜中MDA含量显著提高(P<0.05)。与LPS应激组相比,饲粮添加200和400 mg/kg ACP显著提高了肉鸡血浆和空肠黏膜中T-SOD、GSH-Px活性和T-AOC(P<0.05),饲粮添加ACP显著降低了血浆和空肠黏膜中MDA含量(P<0.05)。与空白对照组或抗生素组相比,饲粮添加200和400 mg/kg ACP和400 mg/kg APS显著提高了肉鸡血浆和空肠黏膜中GSH-Px活性(P<0.05),但对二者中T-SOD活性、T-AOC和MDA含量没有显著影响(P>0.05)。饲粮添加不同多糖各组肉鸡血浆和空肠黏膜中T-SOD活性、T-AOC和MDA含量均无显著差异(P>0.05)。
2.3 ACP对LPS应激黄羽肉鸡血浆和空肠黏膜炎症因子的影响
由表5可知,与空白对照组相比,LPS应激组肉鸡血浆中TNF-α和IFN-γ含量显著提高(P<0.05),空肠黏膜中TNF-α、IL-1β和IL-6含量显著提高(P<0.05),空肠黏膜中抗炎因子IL-10含量显著降低(P<0.05)。与LPS应激组相比,饲粮添加抗生素、ACP和APS显著降低了血浆中TNF-α和IFN-γ含量(P<0.05),饲粮添加ACP和APS显著降低了空肠黏膜中TNF-α、IL-1β和IL-6含量(P<0.05),但只有饲粮添加100 mg/kg ACP显著提高了空肠黏膜中IL-10含量(P<0.05)。与抗生素组相比,只有饲粮添加400 mg/kg ACP显著降低了空肠黏膜中TNF-α含量(P<0.05)。除空肠黏膜中TNF-α含量外,不同ACP组间血浆和黏膜中炎症因子含量均无显著差异(P>0.05),400mg/kg ACP组、400mg/kg APS组和200 mg/kg ADP组3个组之间血浆和黏膜中炎症因子含量也没有显著差异(P>0.05)。

表4 ACP对LPS应激黄羽肉鸡血浆和空肠黏膜抗氧化能力的影响

表5 ACP对LPS应激黄羽肉鸡血浆和空肠黏膜炎症因子的影响

续表5项目 Items组别 Groups空白对照Blank controlLPS应激LPS stress抗生素Antibiotics100 mg/kg ACP200 mg/kg ACP400 mg/kg ACP400 mg/kg APS200 mg/kg ADP干扰素-γ IFN-γ8.51±0.659.40±0.558.88±1.018.41±1.138.39±0.607.95±1.028.64±0.788.69±0.73白细胞介素-1β IL-1β2.47±0.21b3.33±0.14a2.28±0.25bc1.83±0.23c2.11±0.13bc1.99±0.11bc2.35±0.12b2.29±0.19bc白细胞介素-6 IL-62.90±0.18b4.03±0.18a3.43±0.36ab3.00±0.30b3.16±0.26b3.01±0.26b3.26±0.13b3.53±0.28ab白细胞介素-10 IL-109.48±0.74a7.35±0.35b8.66±0.86ab9.60±1.22a9.18±0.72ab8.92±0.57ab8.98±0.57ab8.45±0.50ab
2.4 ACP对LPS应激黄羽肉鸡空肠组织形态的影响
如图1所示,30日龄时,空白对照组肉鸡空肠黏膜结构完整,层次清晰,肠绒毛排列整齐,绒毛间及隐窝之间界限分明。相较于空白对照组,30日龄时,LPS应激组肉鸡肠壁厚度增加,空肠黏膜结构紊乱、疏松,肠绒毛变短、破损,肠绒毛上皮细胞坏死、脱落,隐窝深度增加,且出现肥大,提示LPS可能影响位于隐窝部位的肠道干细胞进而影响隐窝部位细胞增殖分化,最终导致绒毛结构受损。相较于LPS应激组和抗生素组,不同ACP组肉鸡表现为空肠绒毛高度增加、隐窝深度降低以及使肠壁变薄,并且其肠绒毛更加完整。相较于各ACP组和400 mg/kg APS组,200 mg/kg ADP组肉鸡空肠黏膜结构完整性较差。
由表6可知,与空白对照组相比,LPS应激组肉鸡空肠绒毛高度显著降低(P<0.05),隐窝深度显著增加(P<0.05),绒隐比显著降低(P<0.05),肠壁厚度显著增加(P<0.05);各ACP组和400 mg/kg APS组空肠绒毛高度、隐窝深度和绒隐比均没有显著差异(P>0.05)。与LPS应激组相比,各ACP组和400 mg/kg APS组空肠绒毛高度显著增加(P<0.05),隐窝深度显著降低(P<0.05),绒隐比显著提高(P<0.05),肠壁厚度也显著降低(P<0.05);200 mg/kg ADP组空肠绒毛高度没有显著变化(P>0.05),隐窝深度显著降低(P<0.05),绒隐比显著增加(P<0.05),肠壁厚度也显著降低(P<0.05)。与抗生素组相比,各ACP组和APS组的空肠绒毛高度没有显著变化(P>0.05),隐窝深度显著降低(P<0.05),绒隐比显著提高(P<0.05),肠壁厚度也显著降低(P<0.05)。与200 mg/kg ADP组相比,100 mg/kg ACP组空肠绒毛高度没有显著变化(P>0.05),隐窝深度显著降低(P<0.05),绒隐比显著提高(P<0.05),肠壁厚度也显著增加(P<0.05)。各ACP组和400 mg/kg APS组间空肠绒毛高度、隐窝深度和绒隐比均无显著差异(P>0.05)。
2.5 ACP对LPS应激黄羽肉鸡空肠炎症反应和屏障功能相关基因mRNA相对表达量的影响
如图2所示,与空白对照组相比,LPS应激组肉鸡空肠Toll样受体4(TLR4)、核转录因子-κB(NF-κB)、TNF-α和IL-1β的mRNA相对表达量显著提高(P<0.05)。与LPS应激组和抗生素组相比,各ACP组和400 mg/kg APS组空肠TLR4、NF-κB和IL-1β的mRNA相对表达量显著降低(P<0.05),但空肠TNF-α的mRNA相对表达量无显著差异(P>0.05)。与抗生素组相比,200 mg/kg ADP组空肠TLR4、TNF-α和IL-1β的mRNA相对表达量无显著差异(P>0.05),但空肠NF-κB的mRNA相对表达量显著降低(P<0.05)。与空白对照组相比,各ACP组和400 mg/kg APS组空肠TLR4、NF-κB、TNF-α和IL-1β的mRNA相对表达量均无显著差异(P>0.05);各ACP组和400 mg/kg APS组间空肠TLR4、NF-κB、TNF-α和IL-1β的mRNA相对表达量无显著差异(P>0.05)。
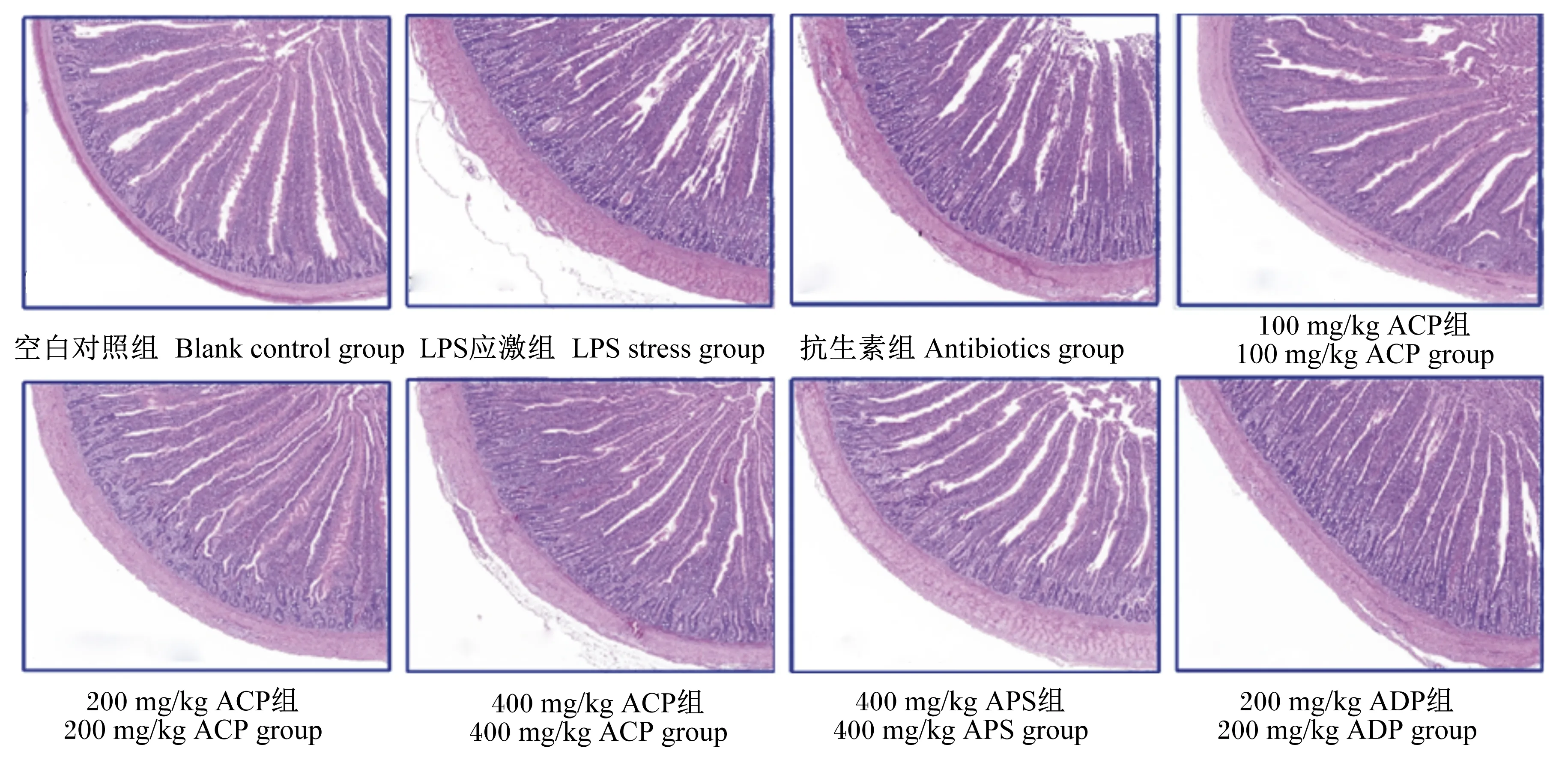
图1 ACP对LPS应激黄羽肉鸡空肠组织形态的影响

表6 ACP对LPS应激黄羽肉鸡空肠组织形态的影响
如图3所示,与空白对照组相比,LPS应激组肉鸡空肠黏蛋白2(MUC2)、封闭蛋白-1(claudin-1)、闭锁小带蛋白-1(ZO-1)和闭锁蛋白(occludin)mRNA相对表达量显著降低(P<0.05)。与LPS应激组相比,各ACP组空肠MUC2、claudin-1、ZO-1和occludin mRNA相对表达量显著提高(P<0.05),400 mg/kg APS组空肠MUC2、claudin-1和occludin mRNA相对表达量显著提高(P<0.05),200 mg/kg ADP组空肠claudin-1 mRNA相对表达量显著提高(P<0.05)。与抗生素组相比,饲粮添加200和400 mg/kg ACP显著提高空肠MUC2、claudin-1和occludin mRNA相对表达量(P<0.05)。与空白对照组相比,ACP组和400 mg/kg APS组空肠MUC2、ZO-1和occludin mRNA相对表达量无显著差异(P>0.05),200 mg/kg ADP组空肠claudin-1、ZO-1和occludin mRNA相对表达量无显著差异(P>0.05)。各ACP组和400 mg/kg APS组间空肠以上基因的mRNA相对表达量均无显著差异(P>0.05)。
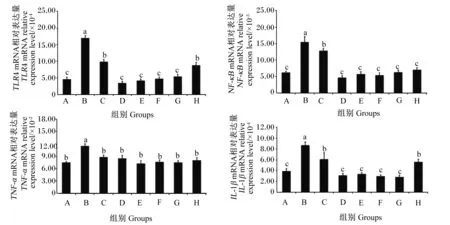
A:空白对照;B:LPS应激;C:抗生素;D:100 mg/kg ACP;E:200 mg/kg ACP;F:400 mg/kg ACP;G:400 mg/kg APS;H:200 mg/kg ADP。数据柱标注不同字母表示差异显著(P<0.05)。图3同。

图3 ACP对LPS应激黄羽肉鸡空肠屏障功能相关基因mRNA相对表达量的影响
3 讨 论
3.1 ACP对LPS应激黄羽肉鸡生长性能的影响
研究认为,多糖如枸杞多糖[13]、APS[16]和牛膝多糖[17]能改善肉鸡生长性能;也有研究发现,蘑菇多糖和螺旋藻多糖的应用效果不明显[9,18]。此外,研究表明,金针菇菇脚多糖(1 000 mg/kg)能显著提高爱拔益加(AA)肉鸡28~42日龄的ADG,显著降低F/G,且在试验末期(43~49日龄)不添加的情况下仍发挥降低F/G的作用[19]。Shang等[20]研究发现,在AA肉鸡饲粮中添加小刺猴头菌多糖后,ADG和ADFI随着添加水平的提高均呈线性和二次曲线提高,但各组间(0、1、3和5 g/kg)F/G无显著差异。在科宝(Cobb)肉鸡饲粮中添加螺旋藻可以增强热应激肉鸡的体液免疫反应,提高其抗氧化能力,但对其生长性能无显著影响[21]。但是,在罗斯(Ross)308肉鸡饲粮中添加螺旋藻后,8~21日龄、22~35日龄和1~35日龄的总增重、F/G和欧洲生产效率指数也都随其添加水平的提高呈线性提高[22]。以上结果表明,多糖对肉鸡生长性能的影响可能受动物品种、生长阶段和环境的影响。本试验结果表明,肉鸡注射LPS对F/G没有显著影响,这与马邯生等[23]和吴亚男等[24]的研究结果一致。其原因可能是LPS通过应激抑制了动物采食中枢的局部兴奋性,导致了采食量的降低,但采食量降低的同时也加快了机体分解代谢,导致ADG降低,致使F/G没有发生显著性变化。本研究中,与空白对照组相比,饲粮添加不同水平ACP对肉鸡ADG、ADFI和F/G均无显著影响,但却一定程度上缓解了LPS对肉鸡生长的抑制作用。这表明,ACP可以有效改善LPS应激状态下肉鸡的生长性能,但却没有剂量依赖性,且从添加水平上对比其作用效果优于APS和ADP;而与抗生素相比差异不显著,说明ACP与抗生素对肉鸡生长性能的作用效果基本一致。
3.2 ACP对LPS应激黄羽肉鸡血浆和空肠黏膜抗氧化能力的影响
T-SOD、GSH-Px、T-AOC和MDA是评价机体抗氧化能力的重要指标[11-13]。研究发现,在岭南黄羽肉鸡53、56和59日龄时腹腔注射LPS(500 μg/kg BW)后,显著降低了血清中超氧化物歧化酶(SOD)和GSH-Px活性,并且具有提高血清中MDA含量的趋势[25]。本试验研究也发现,LPS应激显著降低了30日龄肉鸡血浆中T-AOC,显著提高了血浆中MDA含量,这与前人研究结果基本一致。其结果差异性可能与肉鸡注射LPS的次数和日龄有关,本试验中在肉仔鸡在18和20日龄时分别注射LPS,机体发育没有53、56和59日龄时完善,所以试验期间肉鸡经受了明显的氧化应激,导致血浆中脂质过氧化的终产物MDA含量发生了显著变化,具体机制有待进一步研究。
研究发现,饲粮添加海藻多糖可显著提高肉鸡血清中T-AOC以及SOD和GSH-Px活性,降低血清中MDA含量,从而提高肉鸡的抗氧化能力,且效果优于抗生素[26]。万顺康等[18]研究发现,饲粮添加螺旋藻多糖能显著提高AA肉鸡血清中T-SOD和GSH-Px活性,通过抑制其体内羟自由基、超氧阴离子自由基的产生,从而显著降低血清中MDA含量。此外,螺旋藻还可以通过提高Cobb肉鸡血清SOD和GSH-Px活性,降低血清MDA含量,进而增强热应激刺激下机体的抗氧化能力[21]。研究发现,APS对氢化可的松诱导产生的氧化应激具有一定的干预作用,能够提高AA肉鸡血清中T-SOD和GSH-Px活性,降低血清中MDA含量[27]。本试验结果与上述报道基本一致,与LPS相比,多糖显著提高了肉鸡血浆中T-SOD、GSH-Px活性以及T-AOC,并显著降低了血浆中MDA含量,其中100 mg/kg ACP与400 mg/kg APS之间相比无显著差异,并且ACP、APS和ADP的作用效果要优于抗生素。
研究发现,多糖还可以提高肉鸡[11]和鼠[28]的肠道抗氧化能力。本试验结果也表明,与LPS相比,ACP显著提高了空肠黏膜中T-SOD、GSH-Px活性以及T-AOC,并显著降低了空肠黏膜中MDA含量。值得注意的是,ACP和APS各组间相比对肉鸡空肠黏膜抗氧化能力无显著差异。这提示ACP缓解了LPS对肠道的氧化损伤但没有剂量依赖性,且其效果优于抗生素和ADP。
总而言之,ACP可能是通过增强机体抗氧化酶的活性,减少LPS对肠道的氧化损伤,进而改善LPS氧化应激状态下肉鸡的生长性能且效果优于抗生素、APS和ADP。
3.3 ACP对LPS应激黄羽肉鸡空肠组织形态的影响
肠道结构的完整性是保证其正常生理功能的前提条件,如果破坏不但会影响肠道功能的发挥,还会影响肉鸡的健康和生长性能,甚至影响食品安全和人类健康[4,11,29]。研究发现,应激反应(饮用氢化可的松水或肌肉注射环磷酰胺)可造成肉鸡小肠黏膜氧化损伤,降低肠绒毛高度、绒隐比和绒毛表面积[30-31]。与应激组(饮用氢化可的松水)相比,饲粮添加APS显著提高肉鸡小肠绒毛高度和宽度、黏膜厚度、绒隐比和绒毛表面积,且以0.40%的低剂量添加组效果突出,表明其对氧化应激有一定的抑制作用[30];饲粮添加APS也可显著提高环磷酰胺应激肉鸡空肠绒毛高度、绒隐比以及肠道上皮内淋巴细胞和杯状细胞数量[31]。此外,肉鸡饲喂APS和黄芪总皂苷后,还可减少大肠杆菌引起的肠组织损伤和炎症反应,改善肠道免疫力,增强抗感染能力[3]。本试验结果显示,30日龄时,LPS应激组肉鸡肠黏膜结构损伤严重,与上述报道基本一致。同时,也提示LPS可能影响位于隐窝部位的肠道干细胞进而影响隐窝部位细胞增殖分化,最终导致绒毛结构受损。此外,本试验中,ACP和APS表现为提高空肠绒毛高度、降低隐窝深度以及使肠壁厚度变薄,而ADP组和抗生素组空肠黏膜结构完整性相对较差。由此可见,不同活性多糖对LPS诱导的肉鸡空肠损伤均具有保护作用,且初步推断ACP和APS能够增强肠道功能,其中,100 mg/kg ACP对肠黏膜修复作用最佳。
3.4 ACP对LPS应激黄羽肉鸡炎症反应和肠道屏障功能的影响
研究发现,LPS可以结合细胞表面的TLR4,进而活化NF-κB信号通路,介导促炎因子如IL-1β、IL-6和TNF-α等参与炎症反应进程[32-33]。大肠杆菌感染肉鸡后,空肠中促炎性细胞因子IL-1β、IL-6、TNF-α和NF-κBmRNA的表达量显著上调[34]。在炎症反应导致细胞因子增加后,APS可以减少炎症反应因子,保护细胞或身体[35-36]。研究发现,APS还能提高环磷酰胺应激肉鸡空肠中抗炎因子白细胞介素-2(IL-2)和IL-10的表达[31]。体外研究发现(Caco2细胞模型),添加APS可以有效缓解LPS感染的Caco2细胞的炎症反应,显著下调TNF-α、IL-1β和白细胞介素-8(IL-8)的表达[37]。进一步研究发现,APS通过抑制LPS诱导的NF-κB的激活,抑制TNF-α和IL-1β的表达[38]。另有研究也表明,APS对大肠杆菌的毒力减弱,其修复机制可能是通过TLR4/NF-κB信号通路介导的[39]。本试验结果与以上研究结果基本一致,LPS显著提高了血浆和空肠黏膜中炎症因子的表达,引发了肉鸡的炎症反应,成功建立了应激模型;ACP、APS和ADP显著降低了LPS诱导的血浆和空肠黏膜中炎症因子的表达;只有100 mg/kg ACP显著降低了血浆中炎症因子TNF-α的含量,并显著提高了空肠黏膜中抗炎因子IL-10的含量。由此可见,不同多糖有效缓解了LPS诱导的肉鸡血浆和空肠黏膜损伤,但只有100 mg/kg ACP同时发挥了抑制炎症因子和促进抗炎因子的双重作用,有效修复了LPS诱导的炎症损伤。其作用机制可能与APS类似,即通过抑制LPS诱导的TLR4/NF-κB表达,进而抑制炎症因子的表达,最终发挥修复炎症损伤的功能。
此外,LPS不但会提高炎症因子的表达,而且还会影响肠道屏障功能[40]。由于肠道健康很大程度上也取决于肠道黏膜屏障是否完整,TLR4表达增加通常也与肠道屏障的衰竭有关[41-42]。紧密连接蛋白是肠黏膜屏障的重要部分,它们主要由MUC2、ZO-1、occludin和claudin-1[33,43]。MUC2是肠黏膜表面黏液的主要成分,可修复有害因素引起的肠黏膜膜损伤[44]。MUC2、ZO-1、occludin和claudin-1的mRNA相对表达量的下调会对肠道结构和屏障功能造成损害。因此,本试验进一步研究了肠道屏障功能关键基因MUC2、ZO-1、occludin和claudin-1的表达,结果显示ACP和APS显著提高了LPS应激状态的空肠屏障功能关键基因mRNA相对表达量,其作用效果优于抗生素和ADP。
4 结 论
综上所述,在快大型岭南黄羽肉鸡基础饲粮中添加ACP,可有效缓解LPS诱导的生长抑制、氧化损伤和肠道结构损伤,且效果优于抗生素;其作用机制可能与APS类似,即通过抑制LPS诱导的TLR4/NF-κB表达,进而抑制炎症反应的发生,提高机体抗氧化能力并增强肠道黏膜屏障功能,充分发挥修复炎症损伤的功能;由于ACP不存在添加剂量依赖性,建议添加100 mg/kg。
