基于药效学和网络药理学探讨乌梅丸治疗溃疡性结肠炎方剂精简的可行性❋
2021-11-05王欢欢张立石
郭 琴, 王 颖, 王欢欢, 张立石, 柏 冬△
(1.中国中医科学院中医基础理论研究所, 北京 100700; 2.陕西中医药大学,陕西 咸阳 712046)
溃疡性结肠炎(ulcerative colitis, UC)是指影响因素众多且病因未明的慢性非特异性肠道炎症,与克罗恩病(Crohn’s disease, CD)统称为炎症性肠病(Inflammatory bowel disease, IBD),临床上常表现为腹痛、腹泻、里急后重、便血等症状。文献研究发现[1-3],中药复方乌梅丸对寒热错杂的UC疗效显著,该方由乌梅、细辛、干姜、黄连、当归、附子、花椒、桂枝、人参和黄柏10味药材配伍而成[4],原方为丸剂,服用量较大,临床中常用该汤剂进行加减治疗UC[5,6]。然而汤剂使用不便,不利于推广,若依据该方直接开发新药用于UC,方中药味较多,含有附子、细辛等有毒中药,药效、安全性、质量研究、审批风险较大,因此在不影响对于UC疗效的前提下,对该方的精简具有实际意义。
乌梅丸根据药味可分为酸、苦、甘、辛4种,其组方原则主要针对UC寒热错杂证病机,酸味药涩肠止泻、平肝柔木;苦味药清热燥湿止痢;辛味药温中散寒,一辛一苦、一散一降、一热一寒,辛开苦降,为开通之要药,寒热之邪均可开泻;甘味药益气补脾,与酸味药同用则酸甘化阴。方中药物寒热并用,补泻兼施,可实现原方健脾、理气、祛湿、涩肠止泻的目的,适宜治疗寒热错杂、正气虚弱所引起的腹痛、腹泻、里急后重之症。课题组在前期对乌梅丸治疗UC的相关文章进行了整理,通过数据库总结所有口服(汤剂)类文献(包含口服汤剂、联合用药),发现方中乌梅、黄连、人参、干姜使用频率较高(>90%),且这4味分别是酸、苦、甘、辛药味的代表药物,初步将乌梅丸精简为乌梅、人参、黄连和干姜,且由于乌梅丸原方中酸、苦、甘、辛4个药味的用量依次是30 g、12 g、12 g、29 g,因此将精简方中4个药物的用量拟定为原方中4个药味的用量。
本研究以2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid, TNBS)致UC大鼠为UC模型,通过结肠损伤程度、白细胞介素(interleukin, IL)-1β和环氧化酶(cyclooxygenase, COX)-2水平评价乌梅丸全方和精简方的药效,从药效学实验探讨乌梅丸精简方是否具有替代全方的可能性。而网络药理学基于药物和疾病间相互作用的整体性和系统性,能够在体外虚拟筛选潜在的药效物质、作用靶点和通路,并构建“疾病-基因-靶点-药物”多层次网络,初步预测出疾病与药物的作用机制[7]。因此本研究在药效学验证的基础上,进一步结合网络药理学和分子对接的方法,探讨乌梅丸全方和精简方作用于UC的机制,以期望说明乌梅丸精简方的可行性和合理性。本研究已通过中国中医科学院中医基础理论研究所实验动物伦理委员会审查,批号JCS2018012。
1 材料
1.1 动物
健康雄性SD大鼠,鼠龄2个月(体质量220~240 g),北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2018-0001。动物饲养环境温度和湿度分别为24 ℃和28%,每笼大鼠5 只,用混合配方饲料,由北京科澳协力饲料有限公司喂养,自由进食饮水,每日更换饮水,保持大鼠生活环境通风及清洁卫生。
1.2 药品
乌梅(Prunusmume,171215)、细辛(AsarumsieboldiiMiq.,180506)、干姜(Zingiberoj-jicinaleRosc.,180119)、黄连(CoptischinensisFranch.,171123)、当归(Angelicasinensis,180603)、附子(AconitumcarmichaeliDebx.,180512)、花椒(ZanthoxylumbungeanumMaxim.,180117)、桂枝(CinnamomumcassiaPresl,171229)、人参(PanaxginsengC.A.Mey.,180228)和黄柏(PhellodendronchinenseSchneid.,180507)均购自北京同仁堂药店,由北京中医药大学中药学院刘春生教授鉴定为正品。
1.3 试剂及仪器
柳氮磺吡啶肠溶片(Sulfasalazine,上海信谊嘉华药业有限公司,国药准字H31020557);TNBS(美国Sigma公司,P2297);戊巴比妥钠(美国Merck公司,P11011);COX-2 Elisa试剂盒(美国USCN life science公司,SEA699Ra);IL-1β Elisa试剂盒(美国R&D systems公司,RTA00)。分析天平(AR2130,美国OHAUS公司);高速低温离心机(3K15,美国Sigma公司);电动匀浆器(Pro200,美国PRO Scientific Inc公司);酶标仪(Elx800,美国BioTek公司);洗板机(Elx50/8,美国BioTek公司)。
2 方法
2.1 药效学实验
2.1.1 药物的制备 全方:乌梅30 g,细辛3 g,干姜9 g,黄连6 g,当归6 g,附子6 g,花椒5 g,桂枝6 g,人参6 g,黄柏6 g。精简方:乌梅30 g,人参12 g,黄连12 g,干姜29 g。分别按上述处方剂量称取药材,加8 倍水煎煮1 h,第2次6 倍量水煎煮1 h合并滤液,水浴浓缩至稠膏,70 ℃减压真空干燥6 h得干浸膏粉,称重并粉碎过筛,共煎煮30倍剂量,共获得干膏624 g,合20.8 g浸膏/剂。
2.1.2 大鼠UC模型的制备[8]大鼠(实验前禁食不禁水24 h)用戊巴比妥钠(40 mg/kg)麻醉,按5 % TNBS 0.6 mL加0.25 mL的无水乙醇比例配制TNBS乙醇灌肠液,取仰卧位,将1根聚乙烯管(直径约2 mm)经肛门插入肠道,深度8 cm, 将0.3 mL的TNBS乙醇灌肠液注入肠道,保持肛门高30 s,30 min后有大量粪便排出,再按上述方法经肛门注入TNBS乙醇灌肠液0.85 mL,保持肛门高位5 min,防止液体流出,另正常对照组大鼠以等量生理盐水取代TNBS灌肠液灌肠, 其余过程相同。
2.1.3 分组、给药和取材 将腹泻程度类似的大鼠随机分为正常对照组、模型组、全方组、精简方组、阳性药柳氮磺嘧啶组(SASP组)。造模后第2天进行灌胃治疗,正常对照组和模型组灌服纯净水,全方组、精简方组分别灌服乌梅丸全方浸膏和精简方浸膏3.6 g/kg(2 倍临床剂量),给药量计算公式:0.018×20.8 g浸膏/剂÷0.2 kg×2=3.6 g/kg,SASP组灌服柳氮磺嘧啶0. 4 g/kg[8]。
治疗2 周后,各组麻醉后剖开腹腔,截取结肠约2 cm测定长度、称重,拍照评价结肠损伤程度。铝箔纸包裹后液氮速冻,-70 ℃冰箱保存。
2.1.4 结肠黏膜损伤评分 表1示,取材后根据所拍摄纵向剖开肠组织溃疡形成及炎症的情况进行评分,病变范围每增加1 cm计分加1。评分由2 人同时评判取平均值。

表1 结肠组织损伤情况评分表[9,10]
2.1.5 细胞因子IL-1β和COX-2的测定 使用液氮研钵将冻存的肠组织研碎成粉末,转移至1.5 mL离心管中,称重并加入10 倍体积的PBS溶液进行匀浆,然后取上清液根据Elisa试剂盒说明书测定肠组织中IL-1β和COX-2水平。
2.2 统计学方法
2.3 网络药理学研究
2.3.1 有效成分的筛选 于中药系统药理学数据库和分析平台(TCMSP,https://tcmspw.com/tcmsp.php)检索乌梅丸全方和精简方中各个药味的化学成分,以生物利用度(OB)≥30 %和类药性(DL)≥0.18为条件筛选有效成分,并将《中华人民共和国药典》(2015版)[11]中各药的指标性成分作为有效成分。
2.3.2 疾病靶点的收集 借助TTD(Therapeutic Target Database, http://bidd.nus.edu.sg/group/cjttd/)、CTD(Comparative Toxicogenomics Database, http://ctdbase.org/)和Geen Card数据库(https://www.genecards.org/)检索疾病“Ulcerative colitis”(溃疡性结肠炎)的靶点,与2.2.1项下的药物靶点作交集。
2.3.3 药物-成分-靶点-疾病网络的构建 通过Cytoscape3.8.0软件对2.2.1和2.2.2项下的药物、有效成分、靶点和疾病进行关联,构建乌梅丸全方和精简方治疗溃疡性结肠炎的网络机制。
2.3.4 蛋白-蛋白互作网络(protein-protein interaction, PPI)的构建 将乌梅丸全方和精简方与疾病的交集靶点分别输入STRING数据库(http://string-db.org/),构建乌梅丸全方和精简方作用于UC的PPI网络,并将其导入Cytoscape3.8.0软件进行拓扑分析。
2.3.5 基因本体论 (gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析 基于DAVID数据库(https://david.ncifcrf.gov/)对乌梅丸全方和精简方与UC相关的靶点分别进行GO和KEGG分析,并对富集交结果进行可视化处理。
2.3.6 分子对接验证 根据拓扑分析结果,以核心成分为配体、核心靶点为受体进行分子对接。在RCSB PDB数据库(http://www.rcsb.org/)检索核心靶点的3D结构,去除水分子和其原配体并加极性氢。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载配体的3D文件,优化构象。使用Auto Dock Vina软件(美国Scripps研究所Olson实验室)对受体和配体进行分子对接,设置能量范围(energy range)为10、精度(exhaustiveness )为20,迭代次数(num modes)为100,通过比较结合自由能的高低评价受体和配体的结合情况,使用Pymol软件对结果进行可视化。
3 结果
3.1 药效学结果
3.1.1 结肠组织损伤情况 表2示,模型组大鼠的结肠组织明显变粗,结肠质量长度比显著升高(P<0.01),各组动物经药物治疗后肠管增厚程度均有所减轻,结肠损伤指数、质量长度比均有所下降(P<0.05),且各治疗组之间无显著性差异。

表2 各组大鼠结肠损伤情况比较
3.1.2 细胞因子IL-1β和COX-2水平 表3示,模型大鼠结肠组织中IL-1β、COX-2均显著增高(P<0.01),各组动物经药物治疗后IL-1β、COX-2水平均有所下降(P<0.05),但三者之间无显著性差异。
表3 各组大鼠结肠中IL-1β和COX-2水平比较
3.2 网络药理学分析
3.2.1 乌梅丸精简方和全方有效成分及其靶点、疾病靶点的收集结果 图1示,通过TCMSP数据库得到乌梅丸全方和精简方的有效成分为73和41个,有效成分的靶点有120和113 个。基于TTD数据库、CTD数据库和Geen Card数据库共检索到17 018 个疾病靶点。将疾病靶点与乌梅丸全方和精简方有效成分的靶点取交集得到的韦恩图,全方、精简方与UC共同调控的靶点分别有117和105 个,与精简方比较全方多调控了12 个靶点。
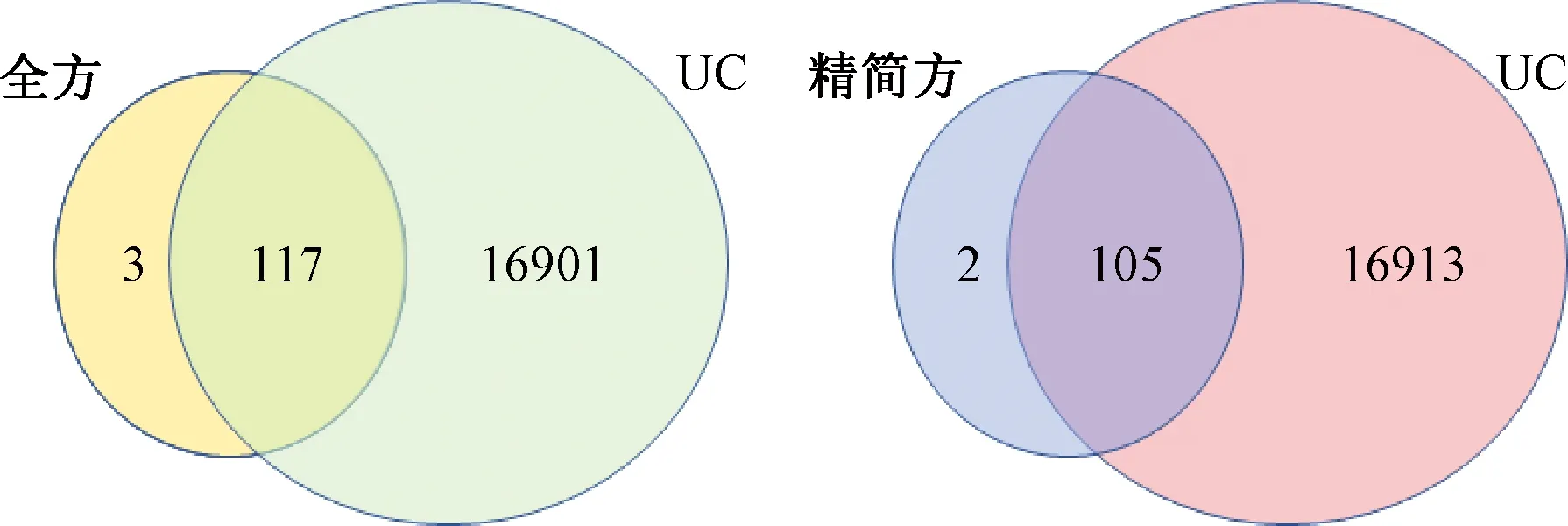
图1 UC与乌梅丸全方、精简方韦恩图
3.2.2 药物-成分-靶点-疾病网络的构建结果 图2示,将乌梅丸全方、精简方的有效成分及其靶点与疾病靶点导入Cytoscape 3.8.0软件后,构建药物-成分-靶点-疾病网络,其中绿色部分代表有效成分,绿色三角形代表重复性成分,紫色箭形代表全方、精简方与UC共同调控的靶点,浅粉色箭形代表全方与UC共同调控的靶点,浅黄色箭形为非交集靶点。从图中可以看出,乌梅丸全方、精简方有效成分和UC共同调控的靶点共有105 个,对于UC靶点的调控,乌梅丸全方比精简方仅多了12 个靶点,说明从网络药理学的分子角度来看,乌梅丸全方和精简方对于UC疾病具有较强的调控作用,且全方和精简方对于UC调控的靶点重复性很高。

图2 药物-成分-靶点-疾病网络图
3.2.3 PPI网络的构建和拓扑分析结果 图3示,利用STRING数据库构建了蛋白-蛋白互作网络图,全方的PPI网络由115 个节点和1056 条边构成,精简方的PPI网络由103 个节点和888 条边构成,将其导入Cytoscape 3.8.0软件。基于CytoHubba插件以度(Degree)值为条件进行拓扑分析,筛选出全方和精简方排名前10的核心靶点,与有效成分进行关联,得到的核心靶点-核心成分网络图,全方和精简方有9 个相同的核心靶点。
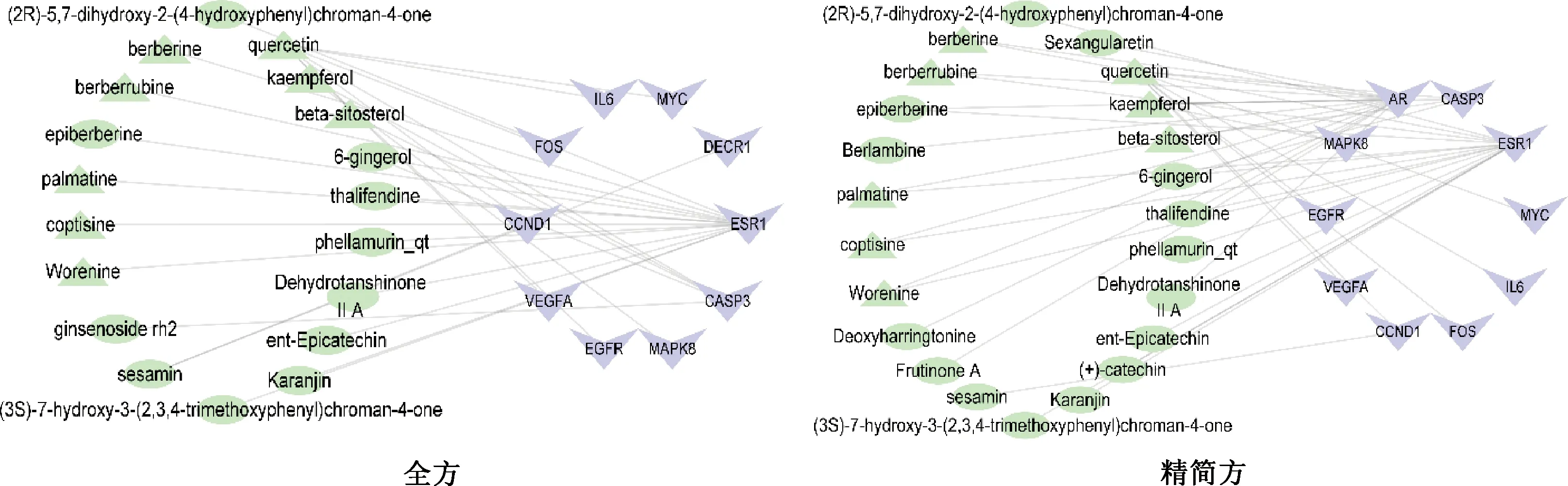
图3 核心靶点-核心成分网络图
3.2.4 GO和KEGG富集结果 GO分析:图4示,其中橙色柱代表分子功能(molecular function),绿色柱代表生物过程(biological process),蓝色柱代表细胞组成(cellular component)。在分子功能方面,全方和精简方主要对酶结合、转录因子活性和序列特异性DNA结合、类固醇激素受体等分子功能进行调节,且全方还对药物结合结合和RNA聚合酶II转录因子活性、配体激活的序列特异性DNA结合等分子功能显著调节;在生物过程方面,全方和精简方主要调节RNA聚合酶II启动子转录的正调控、转录的正调控和等生物过程,且精简方还对信号传导和凋亡过程负调控的生物过程具有重要调节作用;在细胞组成方面,全方和精简方都对胞质溶胶和核质具有调节作用,从以上可以看出,乌梅丸全方和精简方主要通过调控酶结合、信号传导、细胞凋亡、转录等生物功能来治疗UC。
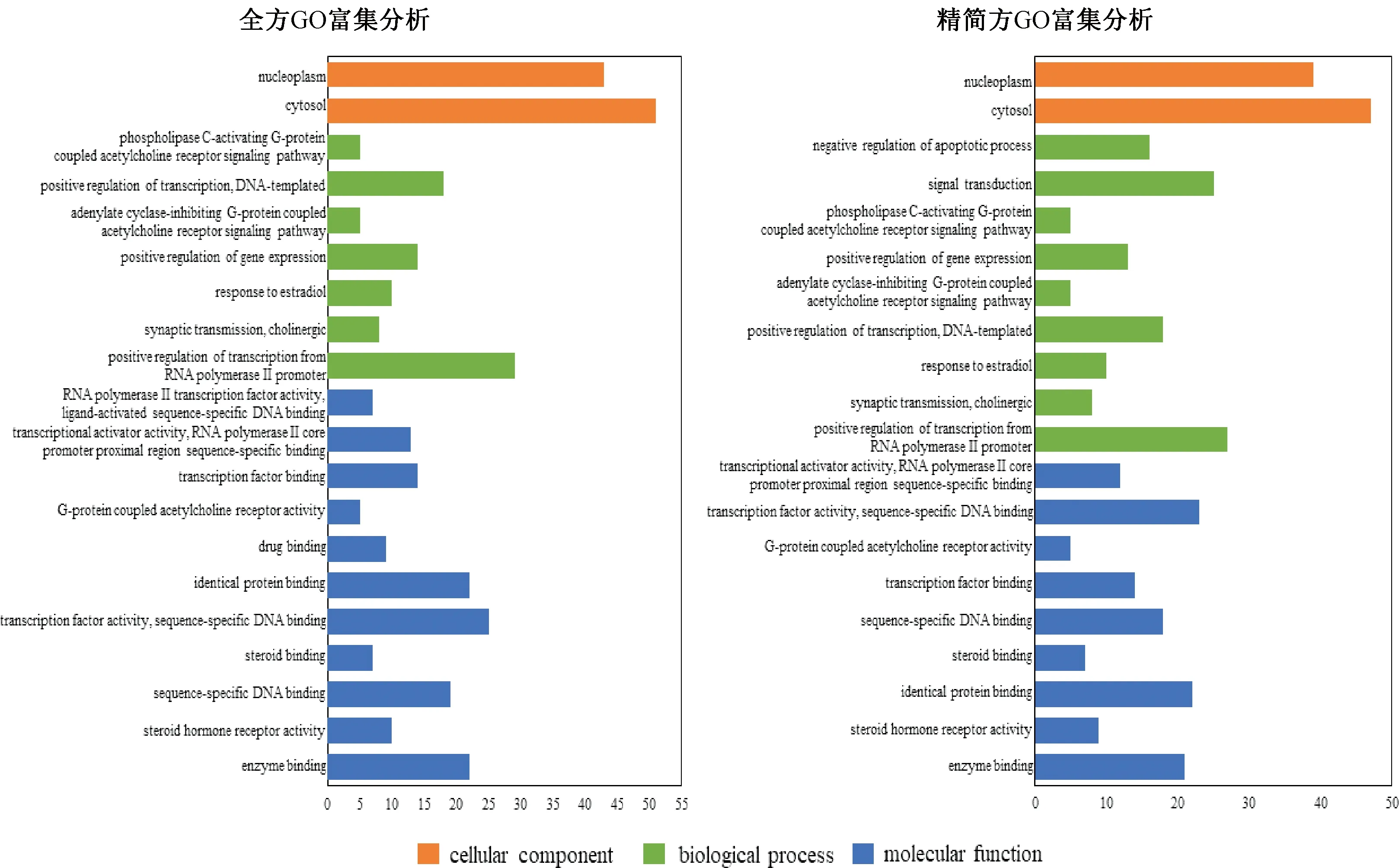
图4 GO富集分析图
KEGG分析:图5示,该气泡图中靶点富集到通路中的数目越多则气泡越大,从绿色至黄色,再至红色的颜色过渡中,表示P值越来越大。全方和精简方显著调节的前20 条通路相同,其中与UC有关的通路主要有肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、缺氧诱导因子(hypoxia inducible factor,HIF)-1信号通路和肿瘤抑制基因(tumor suppressor gene,p53)信号通路等,图6示,对富集得到的一些主要通路进行整合,其中胱天蛋白酶(caspase,CASP)3、原癌基因(proto-oncogene c-fos,FOS)、IL-6和表皮生长因子受体(epidermal growth factor receptor,EGFR)4个核心靶点出现在这几条主要通路中,说明乌梅丸主要通过CASP3、FOS、IL6和EGFR等核心靶点作用于TNF信号通路、结直肠癌信号通路和p53信号通路等通路来治疗UC。

图5 KEGG富集分析图
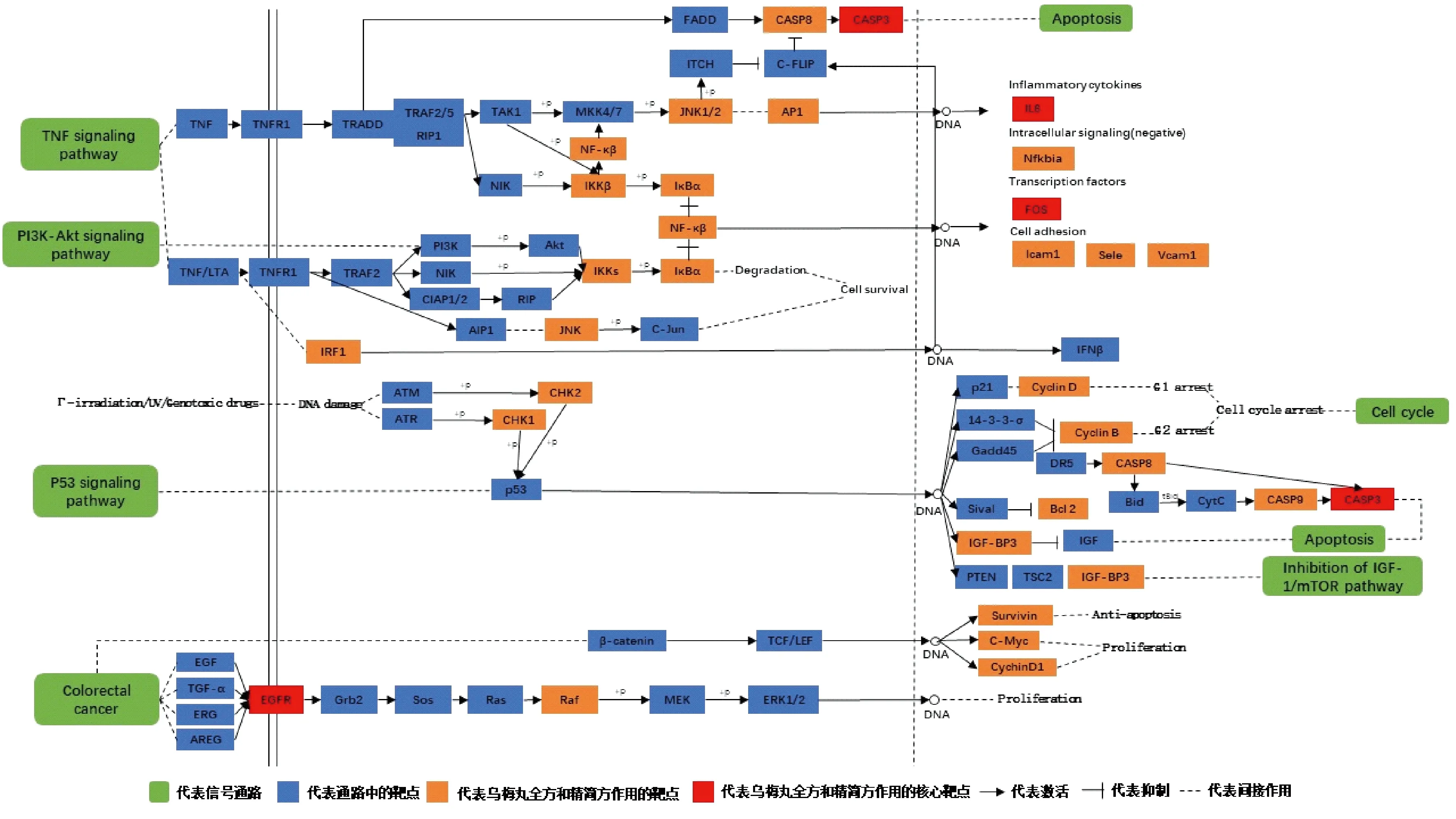
图6 乌梅丸全方和精简方作用于UC的主要通路图
3.2.5 分子对接验证结果 图4、5示,综合拓扑分析和通路富集结果,由于FOS的晶体结构没有明显适合对接的口袋位置,因此最终选择IL6、CASP3和EGFR作为受体,25 个核心成分作为配体进行分子对接,对接盒子的参数设置,受体和配体对接的最低结合自由能的绝对值越大,说明二者结合的亲和力越高。一般认为,绝对值在6~7.5之间表示受体和配体有一定的结合活性,7.5~9之间表示有较好的结合活性,大于9表示有强烈的结合活性。图7示,根据对接结果,22 个核心成分与3 个靶点都有较强的亲和力,对受体和配体最低结合自由能绝对值大于9的进行可视化。

表4 3个靶点对接盒子参数比较
4 讨论
UC主要以直肠和结肠黏膜及黏膜下层的炎症改变为主要病理特征,结肠黏膜损伤现象包括水肿、充血、溃疡以及大量炎症细胞浸润等[12]。因此,在药效实验时需要对大鼠的结肠损伤情况进行评价;IL-1β作为一种能够激活多种免疫和炎症反应的细胞因子,主要由单核细胞、平滑肌细胞和内皮细胞等分泌产生[13],UC患者血清、粪便和结肠组织中IL-1β水平明显高于正常机体[14,15];COX-2是一种与炎症密切相关、可将花生四烯酸代谢成前列腺素的诱导型环氧化酶,在正常肠黏膜的表达较低,而在UC患者的肠黏膜表达明显升高[16]。本研究发现,与正常组大鼠比较,模型组大鼠的结肠组织明显变粗,结肠质量长度比显著升高,结肠组织中IL-1β和COX-2水平显著升高,乌梅丸丸全方组、精简方组和阳性药物组大鼠的肠组织损伤情况均有所改善,结肠质量长度比下降,IL-1β和COX-2水平降低,且给药的3个组并无显著差异,说明乌梅丸全方和精简方都对TNBS诱导的UC大鼠有治疗作用,虽然全方组大鼠结肠损伤的改善情况较好,但二者差别细微。因此从药效实验可认为,乌梅丸精简方能够替代全方治疗UC,对于精简方是否具有可行性及其内在机制,则可借助网络药理学和分子对接进行更深层次的探讨分析。

表5 核心成分与3个靶点对接的最低结合自由能(kcal/mol)
中药复方治疗疾病有多成分、多靶点的特点,内在机制和作用过程极其复杂,网络药理学使研究人员从“一药一靶点”的传统观念转向“药物-靶点网络”模式[17]。该模式符合中医的整体观念,因此本研究使用网络药理学对乌梅丸精简方的可行性进行分析。本研究发现,乌梅丸全方和精简方的核心靶点基本类似,主要有IL-6、CASP3和EGFR等。GO富集发现,全方和精简方主要调节酶结合、信号传导、凋亡过程和转录等生物功能。KEGG富集发现,全方和精简方作用的UC有关的通路主要有细胞凋亡、TNF信号通路、HIF-1信号通路、大肠癌和p53信号通路等,在通路中,IL-6、CASP3、FOS和EGFR等靶点也起到了核心作用。
IL-6是一种多功能细胞因子,在机体免疫应答、炎症等过程中具有调节作用,在UC的发生和发展过程中,其表达水平与UC严重程度密切相关且呈正相关[18,19]。CASP3是一种蛋白酶,其家族在细胞凋亡中发挥着重要作用,UC发生时,肠道黏膜屏障的完整性破坏,存在上皮细胞凋亡的现象[20],CASP3表达明显增加[21]。GO和KEGG结果显示,乌梅丸全方和精简方作用于细胞凋亡这条通路,因此调控CASP3的表达对控制UC和细胞凋亡具有重要意义。EGFR是一种受体酪氨酸激酶,与配体结合参与细胞发育中的许多重要活动,如细胞增殖、分裂和凋亡等[22]。EGFR的过量表达在UC及其相关癌变中起重要作用,对EGFR的研究有助于预防、诊断和治疗UC[23]。因此文献表明,IL6、CASP3、FOS和EGFR等核心靶点在UC的发生和发展过程中具有重要意义,乌梅丸全方和精简方主要通过作用于这些靶点来治愈UC。
图7示,乌梅丸全方和精简方主要通过细胞凋亡、TNF信号通路、HIF-1信号通路、结直肠癌信号通路和p53信号通路等来改善UC。乌梅丸全方和精简方主要通过激活核因子κB(nuclear factor kappa-B, NF-κB)和IκB激酶(inhibitor of nuclear factor kappa-B kinase, IKKB)靶点调控TNF信号通路,在调控该信号通路的同时也作用于磷脂酰肌醇-3-羟激酶(PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路,进一步调节炎症反应、细胞凋亡、信号传导等生物过程,改善黏膜损伤。TNF-α作为促炎和调节因子,能促进促炎因子的释放,可与干扰素一起改变肠上皮细胞的屏障功能,增强肠黏膜和血管壁的通透性,破坏肠黏膜的完整性并形成溃疡[24]。HIF是体内氧稳态的关键调节分子, 严格监管人体内氧气水平[25],在HIF-1信号通路中起关键性作用。UC最严重并发症之一就是UC-CRC,KEGG富集结果显示,乌梅丸全方和精简方还作用于结直肠信号通路,说明乌梅丸全方和精简方可能具有预防UC发生癌变的潜在作用。p53是一种重要的肿瘤抑制因子,其介导的信号通路参与信号传导、细胞凋亡和增殖等过程。Kobayashi等[26]认为,p53的表达与UC的病理机制密切相关,其表达可能是UC与相关结肠癌发生早期的良好生物标志物和诊断工具。
对靶点和成分拓扑分析发现,乌梅丸全方和精简方的核心成分相似性极高,主要有黄酮类(槲皮素、山奈酚)、生物碱类(小檗碱、吴茱萸次碱、黄连碱、甲基黄连碱)、木脂素类(芝麻素)和三萜类(人参皂苷rh2)等成分,陈大朋等[27]筛选具有靶向抑制JAK受体的天然单体化合物,发现以上这些成分对炎性肠病有治疗作用,而分子对接结果也显示,以黄酮类为代表的核心成分与UC关键靶点(IL-6、CASP3和EGFR等)具有较高的结合活性。
综上所述,从药效学角度来看,乌梅丸全方对TNBS诱导的UC大鼠治疗作用虽比精简方略好,但无显著性差异;从网络药理学角度来看,乌梅丸全方和精简方作用于UC的核心靶点、核心成分和通路呈高度相似性。虽然乌梅丸全方比精简方对于UC的效果更好,但差异不大,在一定条件下对于UC的治疗,乌梅丸精简方更具有可行性。
