消溶稳斑方对ox-LDL诱导的人脐静脉内皮细胞炎症损伤的作用研究*
2021-11-05蒋静,邵静
蒋 静,邵 静
1河南中医药大学,河南 郑州450000;2河南中医药大学第一临床医学院
动脉粥样硬化是导致多种心脑血管疾病发生、发展的主要病理基础。冠状动脉粥样硬化斑块的破裂可诱发不稳定心绞痛、急性心肌梗死、猝死等多种心血管危急重症[1],对患者生命造成威胁。因此,如何防治动脉粥样硬化是临床研究的重点。相关研究[2]发现,炎症反应诱导的炎症因子的释放可促进动脉粥样硬化斑块中新生血管的萌发,新生血管的增多会造成动脉粥样硬化斑块内环境的失衡,增加斑块内出血、破裂的可能。另外,炎症反应也是目前得到普遍认可的导致斑块不稳定性增加甚至破裂的促发因素[3]。研究证实,单磷酸腺苷酶活化蛋白激酶(amp-activated protein kinas,p-AMPK)/沉默信息调节因子1(silent information regulator 1,SIRT1)是调节机体能量代谢、维持内环境稳态的关键调节蛋白[4-5]。AMPK参与调节机体多种炎症反应信号通路,在氧化还原反应中发挥重要作用。AMPK可以通过反馈调节,调控SIRT1的表达,SIRT1可作用于下游分子通路,干预炎症反应过程。内皮细胞SIRT1的表达、AMPK的激活可增加抑制炎症基因编码,上调组织炎症因子的释放水平,最终维持内环境的平稳,抑制氧化应激、抗炎的作用[6]。研究证实[7],AMPK可通过对SIRT1活性的调节,抑制IKKβmRNA、MMP-9 mRNA的表达上调氧化酶、炎症因子的释放阈值,从而减轻炎症反应促发的不稳定斑块的破裂,降低不良心血管事件的发生率。本研究通过建立ox-LDL诱导的人脐静脉内皮细胞炎症损伤模型,基于AMPK/SIRT1通路探讨消溶稳斑方对人脐静脉内皮细胞炎症反应的抑制作用及其机制。
1 材料与方法
1.1 实验动物30只雄性SD大鼠,体质量200~250 g,购自河南省实验动物中心,实验动物合格证号:SYXK(豫)2017-0006。
1.2 药物及材料瑞舒伐他汀钙片[阿斯利康药业(中国)有限公司,国药准字J20170008,规格:10 mg/片];消溶稳斑方(药物组成:黄芪15 g,葛根15 g,半夏10 g,水蛭10 g,佛手15 g,郁金15 g,地龙15 g,甘松10 g)浓缩成2.1 g/mL的中药浸膏;人脐静脉内皮细胞(河南中医药大学本院中心实验室提供,批号:04-400-1A);高糖DMEM培养基、PBS、胰蛋白酶-EDTA消化液胎牛血清FBS、BCA蛋白浓度测定试剂盒、RIPA裂解液、β-actin单克隆抗体、HRP标记的山羊抗兔IgG、Phospho-AMPKα(Thr172)抗体、AMPKα抗体、eECL Western Blot Kit高灵敏度化学发光检测试剂盒(北京康维世纪生物科技有限公司,批号:CW0049M);PVDF膜、脱脂奶粉、Tris碱甘氨酸、十二烷基硫酸钠、丙烯酰胺(Life Science公司,批号:LC2007);RNA提取试剂Trizol Reagent(Invitrogen Life Technologies,批号:15596018);无酶水(索莱宝,批号R1600);无水乙醇、异丙醇、氯仿、逆转录试剂盒(Invitrogen,批 号:4368814);SybrGreen Mix kit(Invitrogen,批号:A25742)。
1.3 实验仪器IX73型倒置相差显微镜(日本OLYMPUS);C170型CO2培 养 箱(德 国Binder);ST16R型离心机(北京雷勃尔);BCD-233GB型冰箱(青岛海尔股份有限公司)、ULT-1386-3型超低温冷冻柜(美国REVCO公司);37℃恒温培养箱(北京福意电器有限公司);CF16RXⅡ低温高速离心机(日立);全波长扫描式多功能读数仪(Thermo fisher);DYY-6C型电泳仪、BIO-RAD Mini-TRANSBLOT CELL、DYCZ-24DN型迷你双垂直电泳槽、TS-1脱色摇床(太仓市实验设备厂);LAS-4000 MINI型生物分子成像仪(日本富士);ABI 7500型实时荧光定量PCR仪(北京众力挽生物科技有限公司);Nanodrop 2000型核酸蛋白浓度微量测定仪(Thermo)。
1.4 实验方法
1.4.1 动物分组及药物干预 将30只雄性SD大鼠随机分为3组,对照组15只,他汀组5只,消溶稳斑方组10只,普通喂养3天后,于第4天开始灌胃。消溶稳斑方组按成人用药量的10倍给药,他汀组按成人用药量的5倍给药,对照组予蒸馏水灌胃。各组每日灌胃2次,连续3天。于末次给药1 h后,向腹腔注射10%的水合氯醛(0.3 mL/100 g),待麻醉成功后进行腹主动脉取血。每只大鼠取动脉血约8~10 mL,离心半径10 cm,3000 r/min离心15 min,取上层血清,置于恒温水浴锅中56℃、30 min水浴灭活处理。将灭活的血清用0.22 μm微孔滤膜过滤除菌,然后分装成2 mL/管,标记后放入-20℃冰箱备用。
1.4.2 人脐静脉内皮细胞的培养 将冻存管中的人脐静脉内皮细胞复苏,将细胞悬液放入离心管离心后,倒掉上清液,将细胞团块打散,加入完全培养基(10%FBS+90%DMEM混合液),置于37℃的5% CO2培养箱中培养,取第三代细胞备用。
1.4.3 细胞分组及药物干预 选择培养的第三代人脐静脉内皮细胞,将其分为空白组,模型组,他汀组,中药低、中、高浓度组,中药中浓度+抵抗素组。空白组用含10%正常大鼠血清+90% DMEM;模型组用含ox-LDL(100 mg/L)+10%正常大鼠血清+90%DMEM;他汀组用含ox-LDL(100 mg/L)+10%瑞舒伐他汀大鼠血清+90%DMEM;中药低浓度组用含ox-LDL(100 mg/L)+10%中药低浓度大鼠血清+90%DMEM;中药中浓度组用含ox-LDL(100 mg/L)+10%中药中浓度大鼠血清+90%DMEM;中药高浓度组用含ox-LDL(100 mg/L)+10%中药高浓度大鼠血清+90%DMEM;中药中浓度+抵抗素组用含ox-LDL(100mg/L)+10%中药中浓度大鼠血清+抵抗素50 ng/mL+90%DMEM。将分组后的细胞于37℃的5%CO2培养箱中静置24 h。
1.5 观察指标
1.5.1 采用Western Blot法测定p-AMPK、SIRT1水平 将药物干预24 h的细胞取出,吸除培养基,用PBS(4℃)洗2遍,加入适量组织蛋白裂解液后提取总蛋白,BCA法测蛋白浓度,行SDS-PAGE电泳分析,电泳(8 V/cm,进入分离胶后提至15 V/cm)后行蛋白质转膜,待转膜结束后,将标记过的PVDF膜放在封闭液中室温振摇封闭2 h。弃去封闭液,分别用内参蛋白和目的蛋白的一抗进行杂交,于4℃中反应过夜。取出PVDF膜,TBST漂洗,以HRP标记的山羊抗兔IgG做为二抗,室温下振摇反应1 h。取出PVDF膜,TBST漂洗,在滤纸上沥干液体。把PVDF膜浸入发光液中室温孵育3 min,进行曝光照相。
1.5.2 采用荧光定量RT-PCR法检测IKKβmRNA、MMP-9 mRNA含量 取100 mg人脐静脉内皮细胞,加入Trizol试剂1 mL,按照产品说明提取总RNA。然后将RNA逆转录为cDNA,具体参照逆转录试剂盒说明进行,引物序列见表1。将反转录实验获得的cDNA溶液10倍稀释,进行反应液配置,然后在ABI 7500 Fast上进行Real Time PCR反应。MMP-9反应条件:94℃,5 min,然后进入PCR循环,94℃预变性30 s,分别于60℃和58℃退火30 s,72℃延伸45 s,循环33次后再延伸5 min。IKKβ反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,进行40个循环,72℃充分延伸5 min,4℃保存。取PCR产物在2%琼脂糖凝胶中电泳,然后在凝胶成像系统上扫描,测定各目的基因吸光度值,分别计算其比值,以目的条带吸光度比值进行半定量分析。
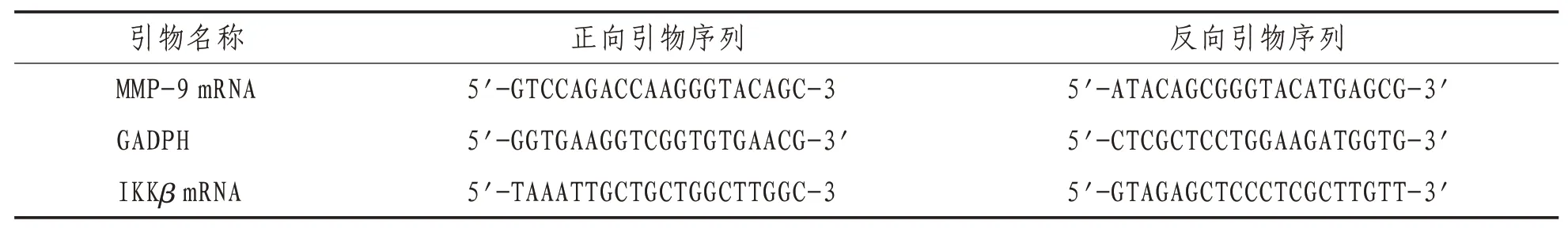
表1 引物序列
1.6 统计学方法采用SPSS 20.0软件进行数据分析,计量资料以±s表示,多组间比较采取单因素方差分析,若方差齐则采取L-S-D检验,方差不齐则采用Dunnett’T3检验;P<0.05表示差异有统计学意义。
2 结果
2.1 p-AMPK、SIRT1蛋白水平1)p-AMPK水平:与空白组比较,模型组,他汀组,中药低、中浓度组p-AMPK水平均降低,差异有统计学意义(P<0.05);中药高浓度组、中药中浓度+抵抗素组p-AMPK水平虽有降低趋势,但组间比较差异无统计学意义(P>0.05)。与模型组比较,他汀组,中药低、中、高浓度组及中药中浓度+抵抗素组p-AMPK水平均升高,差异有统计学意义(P<0.05)。与他汀组比较,中药低浓度组p-AMPK水平降低,差异有统计学意义(P<0.05);中药中、高浓度组及中药中浓度+抵抗素组p-AMPK水平升高,但差异无统计学意义(P>0.05)。2)SIRT1水平:与空白组比较,模型组,中药低、中浓度组SIRT1蛋白水平均降低(P<0.05),其余各组SIRT1蛋白水平有升高趋势,但差异无统计学意义(P>0.05)。与模型组比较,他汀组,中药低、中、高浓度组及中药中浓度+抵抗素组SIRT1水平均升高,差异有统计学意义(P<0.05)。与他汀组比较,中药低、中浓度组SIRT1蛋白水平降低差异有统计学意义(P<0.05),中药高浓度组及中药中浓度+抵抗素组SIRT1蛋白水平虽较瑞舒伐他汀组升高,但差异无统计学意义(P>0.05)。见图1、表2。
表2 各组细胞p-AMPK、SIRT1蛋白水平比较(±s)
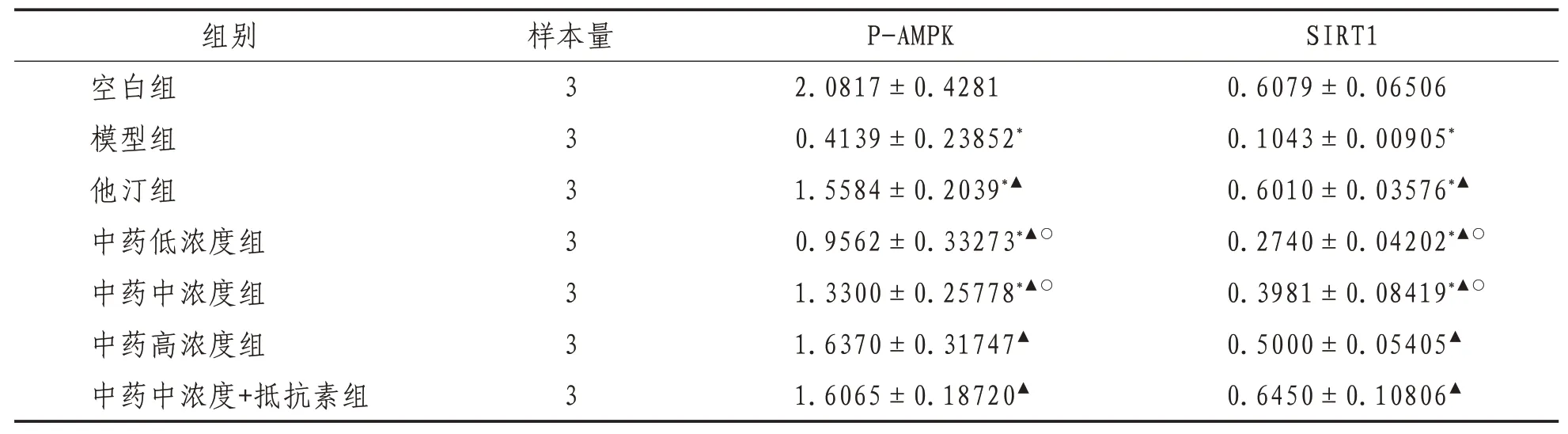
表2 各组细胞p-AMPK、SIRT1蛋白水平比较(±s)
注:*表示与空白组比较,P<0.05;▲表示与模型组比较,P<0.05;○表示与他汀组比较,P<0.05
?
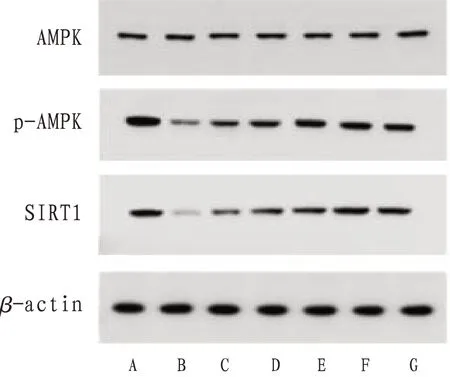
图1 各组细胞p-AMPK、STRI1蛋白表达
2.2 IKKβmRNA、MMP-9 mRNA表达量1)IKKβmRNA的表达:与空白组比较,模型组、中药低浓度组IKKβmRNA表达水平升高,差异有统计学意义(P<0.05),余治疗组与空白组间比较,差异无统计学意义(P>0.05)。与模型组比较,他汀组,中药低、中、高浓度组及中药中浓度+抵抗素组IKKβmRNA表达水平降低,差异有统计学意义(P<0.01)。与他汀组比较,中药低浓度组IKKβmRNA表达水平升高,差异有统计学意义(P<0.05);中药中、高浓度组及中药中浓度+抵抗素组IKKβmRNA表达水平升高,但差异无统计学意义(P>0.05)。2)MMP-9 mRNA的表达:与空白组比较,模型组、中药低浓度组MMP-9 mRNA表达水平升高,差异有统计学意义(P<0.05),余治疗组MMP-9 mRNA的表达水平差异无统计学意义(P>0.05)。与模型组比较,他汀组,中药低、中、高浓度组及中药中浓度+抵抗素组MMP-9 mRNA表达水平均降低,差异有统计学意义(P<0.01)。与他汀组比较,仅中药低浓度组MMP-9 mRNA表达水平升高,差异有统计学意义(P<0.05)。见表3。
表3 各组细胞IKKβ mRNA、MMP-9 mRNA表达水平比较(±s)
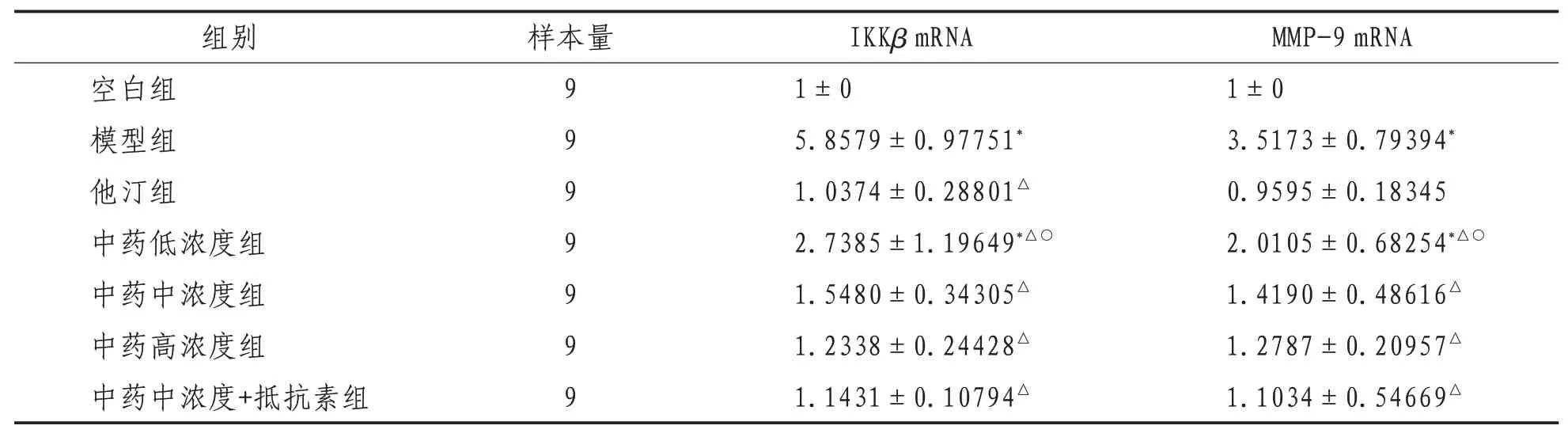
表3 各组细胞IKKβ mRNA、MMP-9 mRNA表达水平比较(±s)
注:*表示与空白组比较,P<0.05;△表示与模型组比较,P<0.01;○表示与他汀组比较,P<0.05
?
3 讨论
动脉粥样硬化属于中医学中“脉痹”范畴。笔者结合多年诊治动脉粥样硬化性疾病的临床经验,以“益气活血,化瘀通络”为法,自拟消溶稳斑方[8]。消溶稳斑方[9]由黄芪、葛根、水蛭、地龙、佛手、郁金、半夏、甘松诸药配伍而成。方中重用黄芪为君,气为血之帅,气行则血行,血行则血脉得通,血瘀得化[10];葛根与黄芪为伍,共为君药,使补而不燥,化生有源[11]。水蛭、地龙为臣药,水蛭功善破血逐瘀,地龙走窜通络,二者助君药通络行血,脉痹自除;佛手、郁金为佐药,二者宽中理气,行气解郁,调畅气机;半夏为佐药,取其祛痰下气,化痰散结之功;甘松亦为使药,性甘温,入心经,有理气、疏郁、通阳之功。此外,甘松尚有醒脾导滞,行气降逆之能,故使补而不壅,寓疏于补。诸药合用,使血行瘀得以化,气行郁得以疏,气血调和,血脉自通,脉痹自除。
SIRT1是一种NAD+依赖性组蛋白去乙酰化酶,与AMPK之间存在反馈调节机制,因此,它可通过激活AMPK,增强AMPK对烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的负调控,抑制炎症基因IKKβ mRNA、MMP-9 mRNA复制,上调炎症因子释放阈值,减轻氧化应激、炎症反应[12]。研究发现[13],动脉粥样硬化患者的血管内皮细胞表面存在的NADPH氧化酶亚基水平上升,而降低NADPH氧化酶活性则可降低氧化应激水平,进而缓解高脂、炎症等引起的血管内皮细胞损伤。研究证实,炎症损伤,可激活组织细胞中AMPK蛋白,转变为磷酸化的AMPK,而p-AMPK水平升高后则会上调位于其下游的调控蛋白SIRT1蛋白的表达[14],同时SIRT1蛋白表达的增加可催化转录因子核因子(nuclear factor-κB,NF-κB)去乙酰化反应而降低其活性,抑制炎症相关基因IKKβ mRNA、MMP-9 mRNA的转录,从而减少炎性因子的释放[15]。
本研究发现,消溶稳斑方可通过作用于AMPK/SIRT1信号通路,激活AMPK使其磷酸化,同时通过正反馈上调SIRT1水平,增加p-AMPK及SIRT1的水平来发挥抑制动脉粥样硬化斑块及损伤内皮细胞中的炎症基因IKKβmRNA、MMP-9 mRNA的表达[16],发挥抑制炎症反应、氧化应激损伤的用,从而减少炎症反应导致的人脐静脉内皮细胞损伤,降低动脉粥样硬化斑块形成的风险。
