基于一步法制备的纳米复合材料发展光电化学方法检测钙卫蛋白
2021-11-05顾鑫鑫杨海峰吴一萍
李 琪,罗 晶,顾鑫鑫,钟 琦,杨海峰,吴一萍
(上海师范大学化学与材料科学学院,上海200234)
0 引言
炎症性肠病(IBD)是不明原因的慢性肠道炎症性疾病.随着社会竞争压力增大,IBD发病率急剧上升,已成为威胁人群身体健康的主要肠道疾病之一[1].IBD患者常有腹痛、腹泻、便血、发热、消瘦等临床表现,根据这些临床表现,结合各种血液检查、粪便检查及结肠镜和X线钡剂灌肠检查等,可做出诊断.但无论是结肠镜还是X线钡剂灌肠检测,都属于入侵式检查,会给患者带来诸多不适.另外,IBD临床表现多样,个体差异大,所以目前针对IBD的诊断仍缺少有效的评价指标[2].钙卫蛋白(CP)是一种来源于中性粒细胞和巨噬细胞的含钙蛋白.当肠道发生炎症时,中性粒细胞就会对炎症做出反应,释放出CP,而且在感染部位CP的质量浓度甚至会超过1 mg·L-1.此外,CP也可在尿液、粪便、血浆、脑脊液以及结肠活检中检出[3-4].2005年英国肠胃病学年会将CP作为评估IBD患者炎症活动及黏膜愈合情况的无创性诊断指标[5].临床检测CP的意义在于,可排除非炎症性疾病[6],确定真正需要胃镜检查和活检的患者,预估和判断IBD患者治疗后复发的风险.
光电化学(PEC)传感器是一种新兴且蓬勃发展的分析方法.PEC技术在检测过程中以光作为激发源,把电极上产生的电流作为检测信号.如此,激发信号和检测信号分离,使PEC检测具有较低的背景信号.对于PEC分析,电极材料的选择和传感模式的构建在提高光电转换效率和获得理想的灵敏度等方面起着重要的作用.目前,已开发出多种光敏金属半导体材料,如碲化镉(CdTe)、硒化镉(CdSe)、氧化锌(ZnO)、二氧化钛(TiO2)、二氧化锡(SnO2)和硫化铋(Bi2S3)等.但很多材料在PEC测定的实际应用中仍受到限制,这主要归因于:1)PEC检测中常用的半导体(例如CdTe和CdSe)毒性高,稳定性也较差;2)一些半导体具有较宽的禁带,例如SnO2禁带为3.6 eV,ZnO禁带为3.2 eV,需要较高能量的激发光源.因此开发具有低成本、高效益且可低能量激发的光活性材料是PEC发展的理想之路[7-8].
本文作者利用化学反应Sn2++AuCl4-+OH-→SnO2+Au+H2O,一步合成了金纳米粒子(Au NPs)敏化二氧化锡(SnO2)的SnO2@Au NPs纳米复合材料[9].合成的SnO2@Au NPs纳米复合材料不仅具有较宽的可见光吸收范围,而且金属与半导体之间存在的肖特基势垒可以有效抑制光生电子-空穴复合,有效提高纳米复合材料的光电性能.之后,利用所制备的纳米复合材料,采用双抗体夹心方案发展了可以特异性检测CP的PEC方法.
1 实验部分
1.1 实验试剂
无水乙醇、丙酮、异丙醇、碳二亚胺(EDC)及N-羟基琥珀酰亚胺(NHS)购自Adamas公司;氢氧化钠(NaOH)、聚乙烯吡咯烷酮(PVP)、氯金酸(HAuCl4·4H2O)、聚乙二醇辛基苯基醚(Triton X-100)、Tris-EDTA缓冲液(pH=8.0)、巯基乙酸(TGA)及L-抗坏血酸-2-磷酸三钠盐(AAP)购自Sigma公司;氯化亚锡(SnCl2·2H2O)购自国药集团;CP(S100A8+A9)、钙卫蛋白抗体1(Ab1)及生物素-钙卫蛋白抗体2(biotin-Ab2)购自上海领潮生物科技有限公司;碱性磷酸酶-链霉亲和素(ALP-SA)、抗体稀释液及质量分数为2%的牛血清蛋白(BSA)封闭液购自上海凌峰化学试剂有限公司.
1.2 实验仪器
氧化铟锡(ITO)导电玻璃,深圳伟光公司南玻集团;光电化学反应仪,PEAC 200A型,天津艾达恒晟科技发展有限公司;X射线衍射仪(XRD),Rigku XRD Mini Flex,日本理学公司;电化学工作站,CHI440D,上海辰华仪器有限公司;台式匀胶机,KW-4A型,中国科学院微电子研究所;场发射扫描电子显微镜(FE-SEM),Hitachi S-4800,日本日立公司;荧光分光光度计,F4600,日本日立公司;紫外分光光度计,UV-2600,日本岛津公司;X射线光电子能谱仪(XPS),AXIS-ULTRA DLD,日本岛津公司;陶瓷纤维马弗炉,8-12T/TP,上海慧泰仪器制造有限公司;干燥箱,DZF-6000,上海慧泰仪器制造有限公司;纯水仪,Milli-Q,上海淼康实业有限公司.
1.3 制备ITO/SnO2@Au NPs纳米复合电极
利用化学反应Sn2++AuCl4-+OH-→SnO2+Au+H2O设计了一步合成法制备SnO2@Au NPs纳米复合材料,具体步骤如下.
1)配制SnO2@Au NPs前驱液.在两口圆底烧瓶中先加入0.06 g PVP和6.0 mL无水乙醇,搅拌10 min得到均一透明的溶液.接着,通15 min氧气(O2)排尽烧瓶内的空气.然后,加入1 g SnCl2·2H2O,塞住烧瓶瓶口,O2氛围搅拌5 min.接着,用注射器加入0.4 mL质量分数为1%的HAuCl4和0.2 mL Triton X-100溶液,搅拌5 min后,缓慢滴加0.6 mL 1.0 mol·L-1NaOH溶液.继续搅拌5 min,最后加入2.5 mL H2O,搅拌3 h后得到香芋紫色的前驱液.
2)制备ITO/SnO2@Au NPs电极.将步骤1中制备的前驱液(70µL)旋涂在洗净的ITO玻璃的导电面(5 cm×5 cm);自然晾干后将电极放入450℃马弗炉中煅烧2 h;取出电极,用去离子水冲洗3次,氮气(N2)吹干,得到的电极记为ITO/SnO2@Au NPs,将电极切成5.0 cm×1.0 cm规格以备使用.
3)制备ITO/SnO2电极.步骤1中不加HAuCl4,其他实验操作不变,得到的电极记为ITO/SnO2.
1.4 PEC传感器的组装
1)制备ITO/SnO2@Au NPs/TGA/Ab1电极.为了通过酰胺键(-CO-NH-)固定Ab1,先在制备好的ITO/SnO2@Au NPs电极表面(1.0 cm×1.0 cm)滴30µL TGA溶液,室温下孵育30 min,目的是使其表面吸附大量的-COOH.洗涤液冲洗3次,洗去多余的EDC和NHS.接着滴30µL 1µg·mL-1Ab1,4℃潮湿环境中孵育16 h,Ab1中的-NH2与-COOH结合形成-CO-NH-,洗涤液冲洗3次,洗去非特异性吸附的Ab1.
2)制备ITO/SnO2@Au NPs/TGA/Ab1/CP电极.在电极表面滴涂30µL BSA封闭液,4℃潮湿环境中孵育2 h封闭未结合的位点.洗涤液冲洗3次后,N2吹干,再滴加不同浓度的抗原CP(30µL),并在37℃条件下孵育1 h.
3)制备ITO/SnO2@Au NPs/TGA/Ab1/CP/Ab2电极.滴涂10µg·mL-1biotin-Ab2,37℃条件下孵育1 h.
4)制备ITO/SnO2@Au NPs/TGA/Ab1/CP/Ab2/ALP电极.滴涂10µg·mL-1ALP-SA,37℃条件下孵育30 min,碱性磷酸酶(ALP)通过链霉亲和素和生物素之间的亲和作用被固定在电极表面.
5)制备ITO/SnO2@Au NPs/TGA/Ab1/CP/Ab2/ALP/AAP电极.之后,将30µL 0.01 mol·L-1AAP滴涂到电极上,37℃条件下孵育30 min即可.以上每一步完成后都要对电极进行清洗(洗涤液清洗3次)以及N2吹干.最后,对电极进行PEC测试.
1.5 电化学阻抗(EIS)表征
通过CHI 440C电化学工作站,采用交流阻抗技术对电极进行了EIS表征,从而验证电极表面修饰是否成功.其中,三电极系统包括:本工作所制备的电极作为工作电极,银/氯化银(Ag/AgCl)电极作为参比电极,铂(Pt)丝电极作为辅助电极.含0.1 mol·L-1KCl的5.0 mmol·L-1[Fe(CN)6]3-/4-溶液为阻抗液,振幅设置为20 mV,低频设置为0.1 Hz,高频设置为100 000 Hz.整个EIS实验在安静的环境下完成.
1.6 PEC测试
电极的PEC测试是在PEAC 200A型PEC反应仪上进行的.其中,激发光源为465 nm的蓝光,开灯时间设置为10 s,关灯时间设置为10 s,实验过程光源的启动和关闭全自动化.检测系统为CHI 440C电化学工作站,采用计时电流技术进行光电检测.Ag/AgCl为参比电极,Pt丝电极为对电极,0.01 mol·L-1Tris-HCl(pH=8.0)为电解质,偏压设置为+0.4 V.
1.7 实际血液中CP的测定
血液样品的预处理过程如下:2.0 mL血液样品在3 000 r·min-1转速离心10 min.将上清液转移至试管中,并在-20℃下存贮备用[10].加标溶液是通过向血样中添加不同体积的CP母液配制得到的,最终的质量浓度分别为1.0,5.0和10.0µg·mL-1.
2 结果与讨论
2.1 SnO2@Au NPs膜的形貌表征
从宏观看,SnO2薄膜为半透明白色,而SnO2@Au NPs薄膜为半透明淡紫色.通过FE-TEM表征薄膜的微观形貌,结果如图1(a)所示,合成的SnO2纳米颗粒大小均匀且致密,粒径约5 nm,并且SnO2膜上负载着一定量的Au NPs.图1(b)为放大后的结果,可以看到Au NPs粒径约为20 nm.此外,通过图1(b)的mapping图可以清楚地看到Sn,O和Au元素的存在,进一步证明通过一步合成法成功制备SnO2@Au NPs纳米复合材料.

图1 SnO2@Au NPs膜的形貌表征.(a)SnO2@Au NPs的FE-TEM图;(b)选区的能谱mapping图
2.2 SnO2@Au NPs膜的结构表征
通过XPS技术可获得纳米复合材料的元素价态等信息.图2(a)是SnO2@Au NPs的XPS全谱图,结果表明材料中存在Sn和O元素,而铟(In)元素源于底层的ITO玻璃.通过XPS谱图并没有得到Au元素的特征谱峰.Sn 3d的XPS谱图如图2(b)所示,在486.7 eV和495.0 eV处的2个峰,分别归属为Sn 3d5/2和Sn 3d3/2的自旋态,表明该复合纳米材料中的Sn元素为+4价.通过XRD表征,可以观察到Au的存在,结果如图2(c)所示.2θ分别为26.9°,33.6°,37.8°,51.6°,61.8°和65.5°的6个特征峰归属于SnO2的(100),(101),(200),(211),(310)和(301)晶面,表明在该纳米复合材料中SnO2为四方相金红石结构(JCPDS#41-1445)[11-12].与纯SnO2相比,SnO2@Au NPs在2θ为44.7°处出现新的衍射峰,归属于单质Au的(200)晶面(JCPDS#04-0784)[13].综上结果,利用XPS和XRD技术,进一步表征了SnO2@Au NPs复合纳米材料的化学状态.
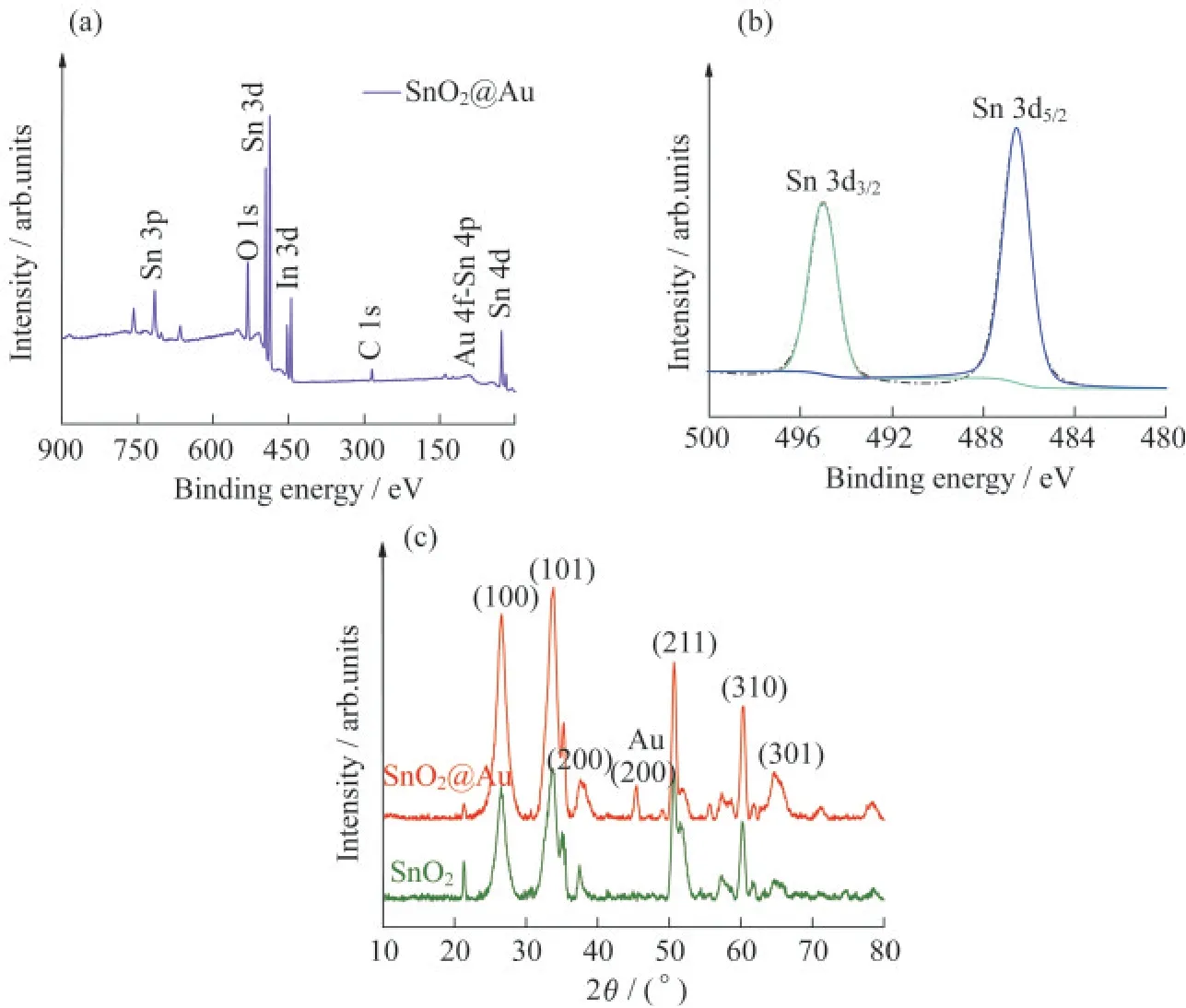
图2 SnO2@Au NPs膜的结构表征.(a)SnO2@Au的XPS全谱图;(b)Sn 3d的XPS谱图;(c)XRD结果图
2.3 材料的光学性质考察
为了考察合成的纳米复合材料是否具有理想的光学性能,通过相关检测仪器获得了材料的紫外-可见漫反射光谱和光致发光光谱(PL).如图3(a)所示,与纯SnO2在315 nm处的紫外吸收峰相比,SnO2@Au NPs复合材料在此位置的SnO2吸收峰发生了红移,表明Au NPs与SnO2成功掺杂.另外,复合材料的紫外-可见吸收峰峰强度明显增强,且对光的吸收范围拓宽到可见光区域,表明在Au掺杂后,所制备的金属-半导体纳米复合材料对光的利用率显著提高.PL是指半导体中的e-受光激发,从价带跃迁至导带,价带中留下h+.e-和h+通过弛豫达到各自的准平衡态.准平衡态下的e-和h+复合发光,形成不同波长光的能量分布光谱图[14].如图3(b)所示,Au NPs掺杂后,合成材料在730 nm处PL强度明显下降,说明异质材料中电子-空穴的复合率下降,反向表明此复合材料的传质效率如期提高.
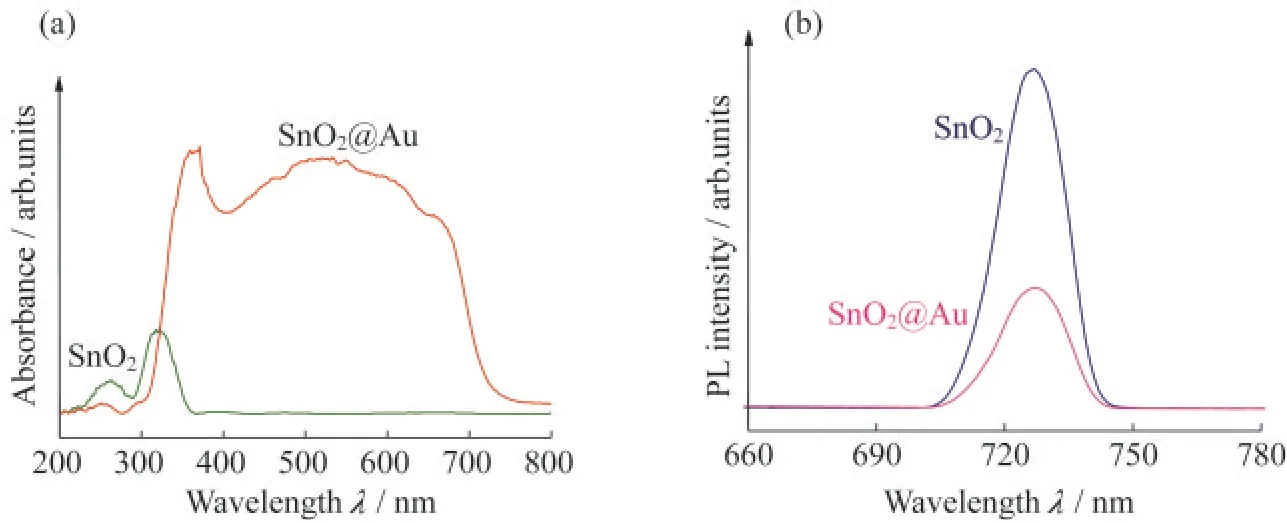
图3 SnO2和SnO2@Au NPs的(a)固体紫外-可见漫反射谱图和(b)PL图
2.4 PEC可行性分析
如图4所示,通过PEC测试对合成的材料进行了评估.在Tris-HCl(pH=8.0)电解液中,Au掺杂后,SnO2@Au NPs材料(C线)光电流强度显著高于单纯的纳米SnO2材料(B线),表明半导体纳米材料的光电性能经过贵金属纳米材料的掺杂后显著改善,与先前光学考察的结果保持一致.接着,在电解液中加入一定量的还原物抗坏血酸(AA)[15],初步验证了此材料对还原性物质的响应,如图4中D线所示,随着还原性物质AA的加入,光电流进一步升高.以上结果表明:所制备的ITO/SnO2@Au NPs电极对AA有光电响应,可实现对AAP的水解产物AA的检测分析.
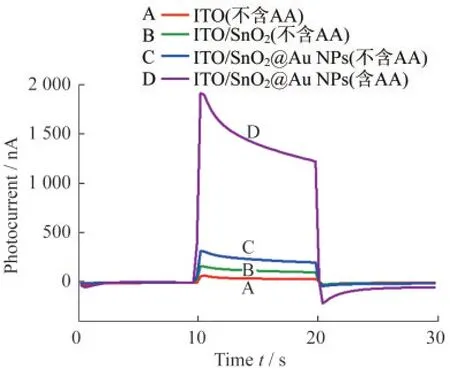
图4 不同电极在含有1.0 mol·L-1 AA的Tris-HCl溶液和不含AA的Tris-HCl溶液的光电响应图
2.5 传感机制
通过一步合成法制备得到致密稳定的SnO2@Au NPs纳米复合物,且材料的重现性良好,可在电极表面修饰识别层[16],已有的表征结果也证实生成的材料多方面性能有所提升.由于PEC检测最明显的缺点是专一性不强,为了解决该问题,设计了如图5所示的特异性良好的抗原-抗体“三明治”夹心结构的生物传感器来检测目标物.
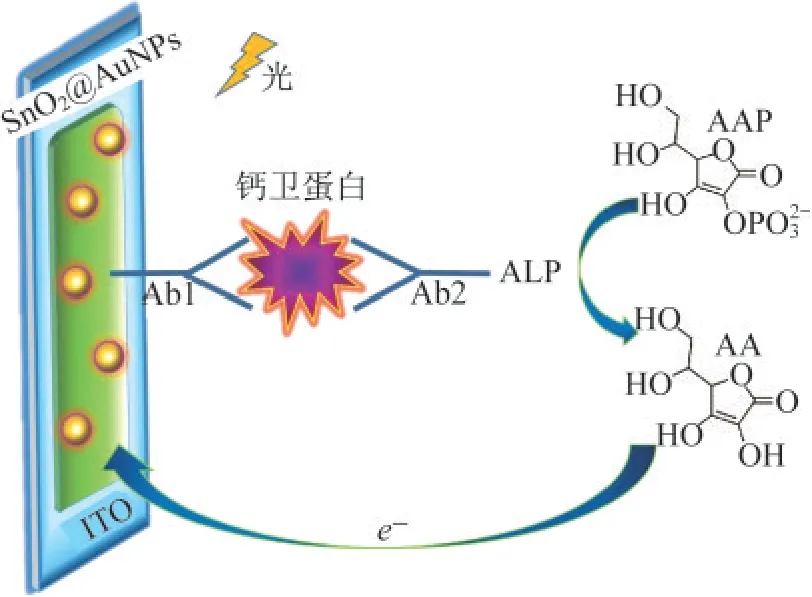
图5 免疫“夹心法”检测CP机理图
此传感器的设计从复合材料对还原物AA具有光电响应入手,在ITO/SnO2@Au NPs电极表面修饰CP的Ab1,抗原CP与抗体Ab1特异性结合,将待测物拉近电极表面.然后,CP的另一个活性位点可识别修饰有ALP的Ab2,由此形成抗体-抗原-抗体“三明治”夹心结构.ALP可催化AAP水解生成供电子体AA,增强光电信号.光照条件下,SnO2@Au NPs复合材料吸收光子,受激产生热电子,这些热电子一部分经ITO半导体导入外电路形成光电流,另一部分会与空穴复合.随着AA的产生,AA作为还原剂可以有效填补光生空穴,使得电子空穴复合率下降,光电流响应上升,由此构建光电流强度与CP浓度间的相关性.值得一提的是,由于金属-半导体异质结构界面处存在肖特基势垒,可以有效降低半导体中光生电子-空穴的复合率,促使材料光电响应增高[17].
2.6 传感器的电化学表征
为确保此传感器的成功构建,利用电化学技术对整个构建过程进行了监测表征.首先是图6的PEC响应,可见在含0.01 mol·L-1AAP的电解质溶液中,ITO/SnO2@Au NPs电极的本征信号约180 nA,当电极表面修饰上TGA后,由于TGA具有还原性,使电流信号上升到约400 nA.接着,由于TGA中的-COOH和Ab1中的-NH2易形成酰胺键[18],可将CP Ab1拉近电极表面,但抗体蛋白导电性差,使光电流降低了一点.随后,在电极表面逐步孵育BSA,CP,Ab2和ALP,显而易见,因蛋白质不导电,光电流强度也逐步下降.最后一步,修饰上ALP后,ALP可催化AAP转化成AA[19],可作为还原剂向电极提供电子,光电流显著上升至750 nA,证实了此传感器检测CP的可行性.
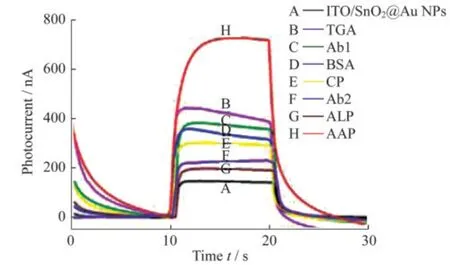
图6 不同电极层层组装后的光电响应图(电解质为0.01 mol·L-1 Tris-HCl溶液)
此外,还通过EIS技术表征了传感器的组装过程.电极的阻抗值(Ret)可用高频下半圆直径大小进行评估,较小的圆弧半径意味着在电极和电解质的界面处电荷转移效率更高[20].如图7所示,ITO/SnO2@Au NPs材料自身电阻很小,EIS结果呈现一个很小的半圆.修饰TGA后,由于TGA具有一定的还原性,可向电极传输电子,Ret减小.随着Ab1,BSA,CP,Ab2,ALP和AAP的组装,半圆逐渐增大,表明电极表面不导电层不断增厚,电极表面层层修饰成功.综上所述,PEC检测和EIS测试结果均证实PEC传感器的成功组装.
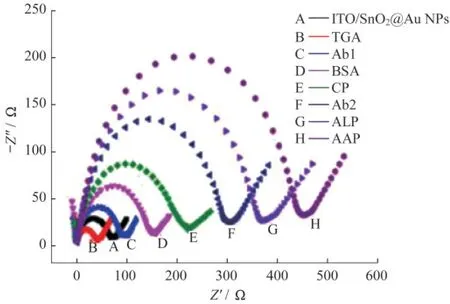
图7 不同电极层层修饰后在含0.1 mol·L-1 KCl的5 mmol·L-1[Fe(CN)6]3-/4-溶液中的EIS图
2.7 PEC检测CP
AAP在ALP的催化下被转化为AA,能给ITO/SnO2@Au NPs电极提供电子,金属-半导体界面形成的肖特基势垒可加快电子传输过程,从而使电极的光电流增强[21].图8(a)为最优实验条件下此生物传感器对不同质量浓度CP(质量浓度分别为0.01,0.10,1.00,10.00,20.00,50.00和100.00µg·mL-1)的PEC响应结果.显然,随着CP质量浓度的增加,光电流先缓慢增长,当CP质量浓度超过20µg·mL-1时,由于AA大量生成,光电流信号陡然增加.然而,当CP质量浓度超过50µg·mL-1时,CP上的结合位点有限,特异性结合的Ab2达到饱和,AAP还原生成的AA也趋于饱和,导致电子传输性能接近最大值,光电流缓慢上升,并趋于平稳.图8(b)是传感器检测CP的光电流值随CP质量浓度变化的拟合图,内插图是其中良好的线性范围(0.01~20.00µg·mL-1),标准方程为I=731.99+174.74 lg c(R2=0.992 6),其中,I为光电流值(单位nA),c为CP的质量浓度(单位质量µg·mL-1),R2为相关系数,检测限为3.2 ng·mL-1,线性范围宽且检测限低.
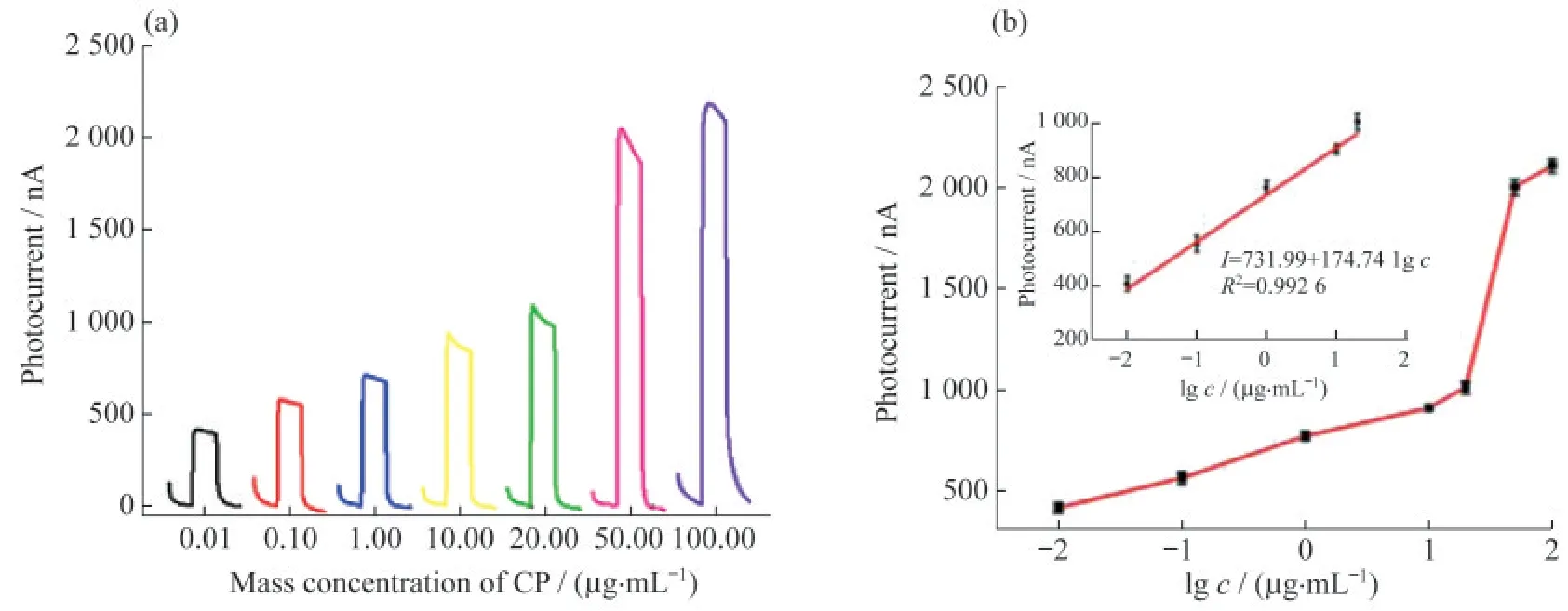
图8 CP质量浓度梯度的考察.(a)不同质量浓度CP的光电流响应;(b)对应的线性拟合图(内插图为线性部分)
此外,还考察了此传感器在实际样品中的应用.将不同质量浓度的CP(1.0,5.0和10.0µg·mL-1)加标到血样中进行处理检测,所得结果如表1所示,回收率在98.9%~103.7%之间,相对标准偏差(RSD)在1.8%~2.5%范围内,表明此PEC传感器的重现性良好.
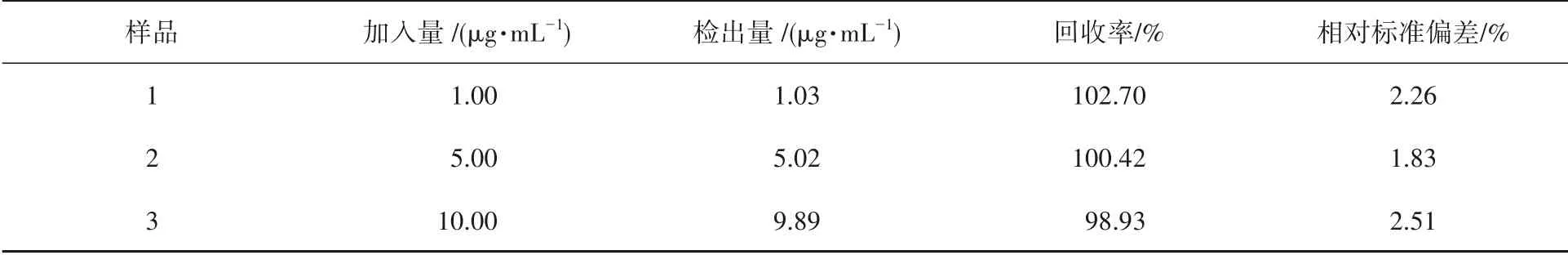
表1 实际血样中CP的检测(n=3)
2.8 传感器专一性、稳定性考察
为了对该传感器的特异性进行了考察,研究了潜在干扰物质对CP测定的干扰,结果如图9(a)所示.由于抗原-抗体的特异性结合,该传感器只对CP有响应,转铁蛋白(TRF)、人血清蛋白(HSA)的存在不会对CP检测造成干扰,该PEC传感器显示良好的选择性.另外,对传感器的稳定性也进行了考察,通过连续开/关灯约900 s,得到的光电检测结果如图9(b)所示,经过长时间检测,电流仍然保持平稳状态,几乎没有下降的趋势,电极展现了较好的稳定性.
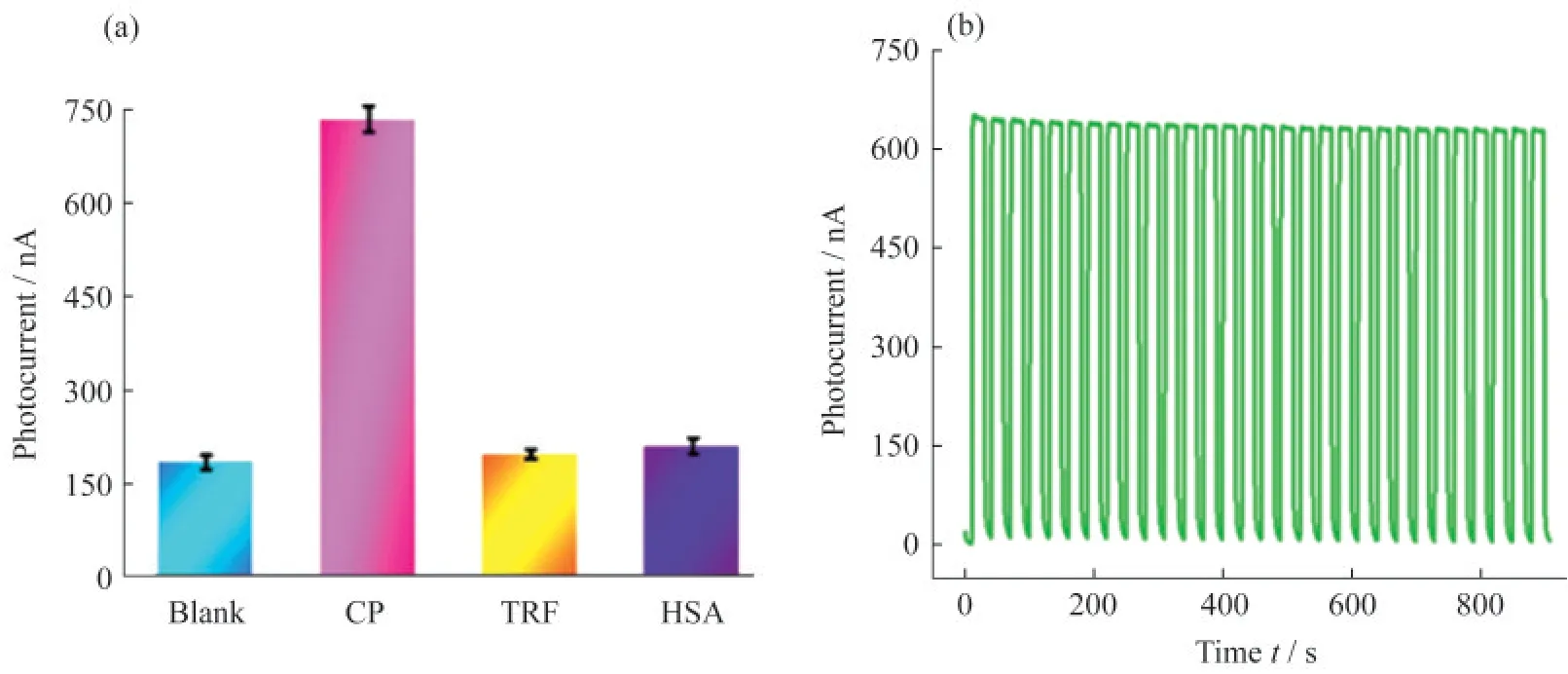
图9 传感器专一性和稳定性的考察.(a)多种蛋白质的光电信号对比;(b)传感器在0.01 mol·L-1 Tris-HCl电解液中连续开/关灯约900 s的光电性能(CP质量浓度为0.1µg·mL-1)
3 结论
本工作通过一步合法制备了光学性能良好的金属-半导体纳米复合材料.掺杂的Au NPs可以显著增强SnO2的光电性能,原因如下:1)掺杂的Au NPs由于表面等离子共振(SPR)效应拓宽了杂化材料对可见光的吸收范围;2)Au NPs良好的载流子传输性能,可以提高电极的电导率;3)当Au NPs掺杂到SnO2时,异质结构界面会形成肖特基势垒,其存在有利于电子和空穴的分离,并阻碍光生电子-空穴对的复合.其次,异质结中存在的内部电场可以诱导载流子更快的迁移,从而增强PEC性能.之后,在该纳米复合材料表面修饰CP抗体,利用“三明治”夹心模型成功实现对CP的特异性光电测定.线性范围为0.01~20.00µg·mL-1,检测限低至3.2 ng·mL-1,且传感器专一性强、稳定性好.此外,传感器也成功用于检测实际血样中的CP,获得了预期的回收率,可实现对实际样品中CP的快速检测.
