双功能酵母展示与分泌系统的构建与验证
2021-11-05王旭辉凌小敏刘军建康立山顾春银
王旭辉,周 倩,凌小敏,刘军建,康立山,顾春银
(信达生物制药(苏州)有限公司 新药研究部,江苏 苏州 215123)
近年来,体外展示技术如噬菌体展示、酵母展示在单克隆抗体或融合蛋白药物的发现与工程改造中得到广泛应用[1-6]。体外展示技术获得的候选分子,具有丰富的结合表位及种属交叉性,经过抗体的亲和力成熟,可获得更高亲和力的抗体分子[7]。与噬菌体展示相比,酵母是真核生物,具有翻译后修饰的能力;同时结合流式细胞荧光分选(简称流式分选)技术实时可见的特点,酵母展示在抗体亲和力成熟中具有更显著的优势[4]。但传统酵母展示技术只将特定蛋白展示于表面[1-3],无法同时将抗体分泌至培养基上清以用于亲和力测定;需要在哺乳动物细胞体系中表达、纯化,获得蛋白样品后方能进行亲和力测定,在通量、成本、周期上存在瓶颈。
虽已有文献提出了多种解决方案,但均存在一定的局限性。如,将酵母细胞分泌的抗体重新捕获进而展示于表面的技术[8],存在基因型与表型不能有效保持一致的风险;尽管通过使用黏性缓冲液与避免剧烈振动可以降低风险,但操作上技术难度很大,使得此方法不具备通用性。此外,2015年Adimab公司报道了一种经过改造的酿酒酵母,可在特定条件下利用人工合成氨基酸翻译终止密码子UAG,进而实现展示与分泌的切换[9],但由于UAG翻译效率的限制,使得抗体在酵母细胞表面展示的丰度大大下降,影响了文库的筛选效率。Glycofi公司将抗体可结晶片断(Fc)区域与锚定蛋白连接展示于毕赤酵母表面,通过Fc间的相互作用实现抗体半分子的展示,同时,完整的抗体分子可以分泌至培养基中[10],实现了展示与分泌同时完成的目的。但此技术使用毕赤酵母作为展示菌株,需要将文库插入毕赤酵母基因组中,限制了文库构建时的多样性。此外,Fc的分子量及形成同源二聚体等因素影响了抗体的展示效果。因此,本研究针对Fc进一步优化并将此系统移植至酿酒酵母,以开发适用于酿酒酵母、展示效率更高的双功能酵母展示与分泌系统。
本研究基于Fc展示抗体的方法[10],针对Fc进一步优化,比较重链恒定区3T366W突变(CH3Knob)、不同长度的Fc区域作为展示单元,对抗体展示与分泌效果的影响。最终,选定了CH3Knob作为展示单元,CH3Knob展示于酵母细胞表面作为“诱饵”结合含FcHole(Hole突变:T366S、L368A、Y407A)的抗体半分子;同时,含FcHole的抗体半分子可以形成同源二聚体,该完整的抗体分子分泌至培养基中,达到展示与分泌兼具的效果,并命名为双功能酵母展示与分泌系统。此系统使用更小的CH3Knob作为“诱饵”,降低了CH3Knob间形成同源二聚体的比例,使得抗体的展示效率更高[11]。双功能酵母展示与分泌系统经模拟文库验证,可高效筛选出占比仅0.01%的高亲和力菌株,满足亲和力成熟文库的筛选需要;并且,筛选出的高亲和力菌株将抗体同时分泌至培养基上清液,可直接使用上清液进行亲和力测定。结果充分说明双功能酵母展示与分泌系统搭建成功并可用于抗体的亲和力成熟改造中,从而显著提高工作效率、缩短抗体亲和力成熟的周期。
1 材料与方法
1.1 试剂、菌株、质粒与转化
引物、基因DNA片段由苏州金唯智生物科技有限公司合成;分子克隆、酵母细胞培养基等材料,大连宝生物公司;生物素化的PD-L1,Acrobiosystems公司;Mouse Anti V5-FITC,Invitrogen公司;Mouse Anti Human IgG-APC,Biolegend公司;Mouse Anti Flag M2,Sigma公司;Streptavidin-PE、Goat anti-Mouse-Alexa Fluor 647,Thermo Fisher公司;AHC传感器,ForteBio公司;G418硫酸盐、2 mL U型底96深孔板,生工生物工程(上海)股份有限公司;无机盐等,国药集团化学试剂有限公司。
本研究中所用菌株分别为酿酒酵母EBY100(ATCC),IDY104通过插入URA3位点改造EBY100获得(图1)。根据文献[11]所述方法,将基因片段PGAL1-CH3Knob-Flag-AGA2-TERMATα-PAgTEF-KanR转化入EBY100;涂布于含200 μg/mL G418抗性的YPD平板,30 ℃培养3 d获得单克隆;挑取多个单克隆用抗Flag标签的抗体流式染色筛选,最终选择Flag标签展示比例最高的克隆命名为IDY104。
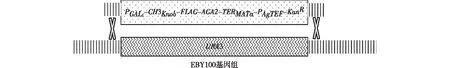
图1 IDY104菌株改造示意
本研究所用质粒如表1所示,质粒pYDN001用于Aga2p与PD-L1胞外段融合展示;质粒pYDC039、pYDC040、pYDC041分别用于Aga2p与不同长度的Fc融合展示;质粒pYDC042、pYDC089用于针对PD-L1抗原的重链可变区(VHH)AmNB1613.36、HzNB1613与Fc融合的单域重链抗体的表达。pYDC099是在pYDC041的基础上,将CH3Knob(T366W)突变成CH3WT;pYDC100是在pYDC042的基础上,将CH3Hole(T366S、L368A、Y407V)突变成CH3WT;所有CH2区进行N297A突变去除N糖基化位点,避免酵母与哺乳动物糖基化差异造成干扰。

表1 质粒构建表
参照文献[12]方法,将质粒按表2组合转入相应菌株中,获得转化质粒的菌株涂布于相应营养缺陷型平板,30 ℃静置培养3 d;挑取单克隆,接种于5 mL的相应营养缺陷型培养基30 ℃、225 r/min培养过夜;菌液3 000 r/min离心3 min弃上清;加入5 mL YPGP诱导培养基(20 g/L半乳糖、20 g/L蛋白胨、10 g/L酵母提取物、5.4 g/L Na2HPO4、8.6 g/L NaH2PO4·H2O)重悬菌体;20 ℃、225 r/min分别诱导24和72 h;诱导24 h样品收集细胞用于后续流式分析,诱导72 h样品收集培养上清液用于后续实验。

表2 酿酒酵母质粒转化表
1.2 酵母细胞流式分析与分选
将表2中组1~5菌株被诱导24 h后的细胞用PD-L1抗原染色,比较抗PD-L1抗体在酿酒酵母细胞表面的展示水平,具体步骤如下:① 取1×106个细胞,用1 mL 1×PBSA (1×PBS+1%BSA)洗涤1次,3 000 r/min离心3 min(以下离心均为此条件)弃上清液;②加入100 μL 100 nmol/L生物素化的PD-L1,室温孵育30 min;③加入1 mL 1×PBSA,离心弃上清液;④加入100 μL经1×PBSA稀释的SA-PE(1∶ 200稀释),避光冰浴20 min;⑤加入1 mL 1×PBSA,离心弃上清液,再加入500 μL 1×PBSA重悬细胞,用BD 公司的Accuri C6检测,FL2通道信号反映了酿酒酵母表面所展示的抗体水平。
将表2中组1~3菌株被诱导72 h后的上清液与展示PD-L1抗原的酵母细胞(表2中组7诱导24 h的细胞)染色,比较上清液中的抗体含量,具体步骤如下:①取1×107个展示PD-L1抗原的酵母细胞,用1 mL 1×PBSA洗涤1次,加入1 mL 1×PBSA重悬细胞;②以每孔100 μL 即1×106个细胞铺于96孔U型深孔板,离心弃上清液;③取100 μL诱导72 h的上清液加入步骤2的96孔板中,室温孵育30 min;④ 离心弃上清液,1 mL 1×PBSA洗涤1次;⑤ 加入100 μL经1×PBSA稀释的二级抗体稀释液(Mouse Anti V5-FITC以1∶ 1000稀释、Mouse Anti Human IgG-APC以1∶ 200稀释),避光冰浴20 min;⑥加入1 mL 1×PBSA洗涤1次,加入500 μL 1×PBSA重悬细胞,用BD公司的Accuri C6检测分析,FL1通道信号反映了PD-L1抗原的展示水平,FL4通道信号反映了上清中抗体的含量。
将表2中组5与组6菌株诱导24 h的细胞,按1∶ 102、1∶ 104混合为1%模拟文库、0.01%模拟文库;组5、组6、1%模拟文库、0.01%模拟文库分别与抗原染色,具体步骤如下:①各取2×107个细胞,1 mL 1×PBSA洗涤1次;②加入100 μL 10 nmol/L生物素化的PD-L1,室温孵育30 min;③1 mL 1×PBSA洗涤1次,加入100 μL经1×PBSA稀释的二级抗体稀释液(SA-PE,Mouse Anti Human IgG-APC稀释比例同上文),冰上避光孵育20 min;④1 mL 1×PBSA洗涤1次,加入1 mL 1×PBSA重悬细胞;⑤各取50 μL用BD 公司的Accuri C6检测,APC信号反映了酿酒酵母表面所展示的抗体水平,PE信号反映了展示抗体与抗原的结合强弱;⑥1%模拟文库、0.01%模拟文库剩余的细胞用Beckman公司的MoFlo XDP进行流式分选,筛选出CH3Knob阳性(APC信号)且与抗原结合(PE信号)较强的细胞群。
1.3 酵母上清样品的亲和力测定
参照文献[12]的方法,采用生物膜层干涉(BLI)技术,对诱导72 h的酵母上清液样品测定其抗体与抗原的平衡解离常数(KD)。采用ForteBio公司的Octet Red96仪器进行分析,步骤简述如下:首先平衡基线120 s;然后将酵母上清液中抗体固化至AHC传感器,将已固化的传感器置于含100 nmol/L PD-L1的溶液中,结合时间100 s;之后将传感器转移至分析缓冲液解离至少2 min,分别测定结合及解离速率;实验结果使用1∶ 1结合模型进行动力学分析。
2 结果与讨论
2.1 双功能酵母展示与分泌系统的开发
本研究基于Fc展示抗体的方法,开发出一种展示与分泌兼具的酵母展示系统(图2),即双功能酵母展示与分泌系统。在此系统中,引入T366W突变的CH3Knob序列与Aga2p融合展示于酵母表面;展示的CH3Knob可作为“诱饵”结合含FcHole的抗体半分子,同时含FcHole的抗体半分子可形成同源二聚体,该完整的抗体分子分泌至培养基中,最终实现酵母抗体展示与分泌的双重功能。
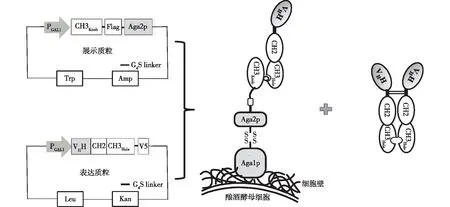
图2 展示与分泌兼具的酵母展示系统示意
以抗人PD-L1的VHH(AmNB1613.36)为例,评估双功能酵母展示与分泌系统的可行性;同时为了选出最适合酵母展示且分泌效果好的“诱饵”,构建了一系列展示质粒DKTHTCPPCP-CH2N297A-CH3Knob-Flag-Aga2p(pYDC039)、CH2N297A-CH3Knob-Flag-Aga2p(pYDC040)、CH3Knob-Flag-Aga2p(pYDC041);分别与VHH(AmNB1613.36)-DKTHTCPPCP-CH2N297A-CH3hole(pYDC042)组合转入酿酒酵母EBY100,如表2中组1~3所示。取诱导24 h的细胞,用生物素化的人PD-L1抗原染色,比较抗体AmNB1613.36的展示水平(图3(a));取诱导72 h的培养基上清液与展示人PD-L1的细胞(表2的组7)孵育染色,比较抗体的分泌水平,如图3(b)所示。由图3(a)可知:组3的抗体展示效果最优,说明使用CH3Knob作为“诱饵”抗体的展示效果最好。由图3(b)可知:组3分泌抗体的量为组1、2的10~20倍,说明使用CH3Knob作为“诱饵”抗体的分泌量最大。显而易见,使用CH3Knob作为“诱饵”,双功能酵母展示与分泌系统工作效果最好。
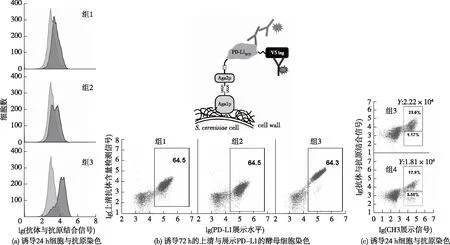
图3 双功能酵母展示与分泌系统的开发
为了证实引入CH3knob与CH3hole突变能有效减少CH3的同源二聚体形成,有助于CH3knob与CH3hole的异源二聚体形成,提高抗体的展示水平,比较了野生型与突变体组合在抗体展示水平的差异,构建了knob与hole相应的野生型质粒,按表2的组3和组4分别转入EBY100;挑取单克隆接种培养过夜再诱导24 h,各取1×106个细胞用生物素化的人PD-L1抗原染色,如图3(c)所示。比较CH3展示但不与抗原结合的部分占总CH3展示的比例,组3约为1.17%/(23%+1.17%)=4.8%,而组4为5.58%/(5.58%+12.9%)=30.2%,说明引入Knob与Hole突变组合使CH3的同源二聚体减少了约6倍。
2.2 展示菌株IDY104的构建
前文已确定CH3Knob作为“诱饵”最利于抗体的展示与分泌,其编码基因(CH3Knob-Flag-Aga2p)可以质粒形式转入菌株中,亦可整合插入菌株基因组中。相较于质粒形式,整合插入菌株基因组时基因更不易丢失,细胞展示的比例更高;同时可节省一个质粒的筛选标签,以便于在质粒上构建抗体的轻、重链文库使用。因此,将质粒pYDC041编码基因及上、下游启动子与终止子序列:PGAL1-CH3Knob-Flag-AGA2-TERMATα,与遗传霉素抗性基因PAgTEF-KanR串联,两端各加上50个碱基的URA3基因的上、下游同源臂,转入酿酒酵母EBY100取代URA3基因(图1)。外源基因片段理化后细胞涂布于含200 μg/mL G418的YPD平板,30 ℃培养3 d获得单克隆;筛选在Ura缺陷型培养基上不生长,但可在YPD+G418抗性平板生长的单克隆;挑取若干单克隆培养,再诱导细胞,用流式检测CH3Knob-Flag在酵母表面展示的水平,如图4(a)所示。由图4(a)可知:2、6、7、8号克隆均能有效展示,其中7号克隆展示比例最高,用作后续实验并命名为IDY104。
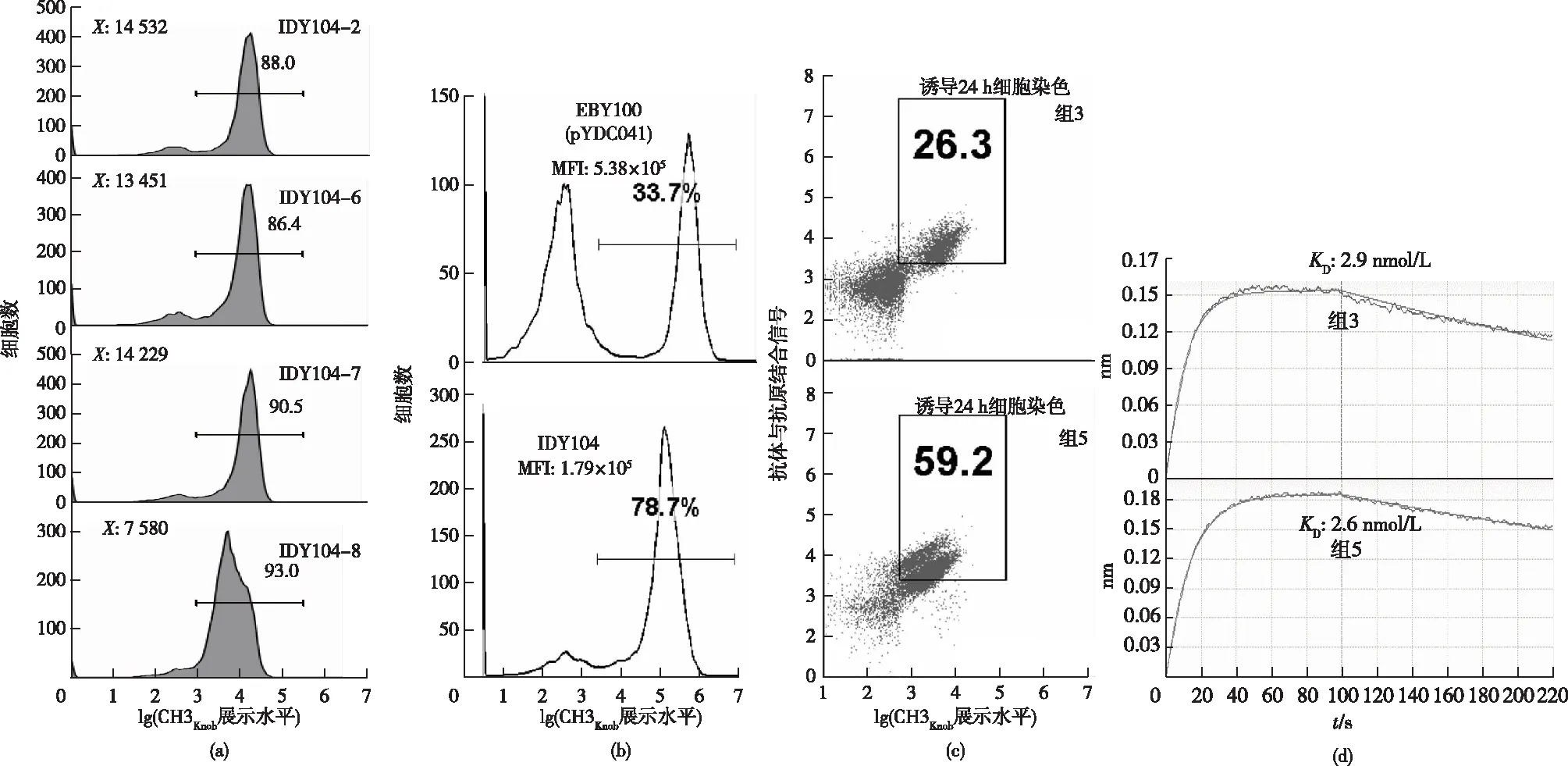
图4 IDY104菌株的构建、鉴定并与EBY100比较
为比较质粒形式或整合插入菌株基因组形式对CH3Knob展示效率的影响,将质粒pYDC041转入EBY100,与菌株IDY104比较CH3Knob的展示水平,如图4(b)所示。由图4(b)可知:IDY104展示CH3Knob的阳性比例为78.7%(>33.7%);但每个细胞展示的分子数要少2~3倍,反映出的平均荧光信号强度(MFI)1.79×105<5.38×105。此外,为比较两种形式对抗体展示效率的影响,表2中的组3、5诱导24 h的细胞与抗原染色,如图4(c)所示;由图4(c)可知:组5的抗体展示水平稍弱,Y轴的MFI:5 714<7 081。组3与组5的上清液用Octet Red96仪器检测与人PD-L1的亲和力,如图4(d)所示。由图4(d)可知:两组上清样品与其抗原的亲和力没有差别。综合而言,两组均能有效分泌与展示抗体,上清样品均可用于亲和力测定,由于IDY104菌株所需质粒更少,构建文库时更为简便,可用作后续项目的实验菌株。
2.3 双功能酵母展示与分泌系统的验证
为验证双功能酵母展示与分泌系统及其在抗体亲和力成熟中的应用,本研究将抗人PD-L1高、低的不同亲和力分子AmNB1613.36、HzNB1613分别展示于IDY104,如表2中组5与组6;将两种菌株细胞数按1∶ 100或1∶ 10 000比例混合,模拟亲和力成熟文库,论证双功能酵母展示与分泌系统及其在抗体亲和力成熟中的应用可行性。
由于HzNB1613、AmNB1613.36亲和力强弱不同,在与10 nmol/L生物素化的PD-L1抗原染色时,亲和力强的结合信号越强;将组5、组6两种菌株按1∶ 102、1∶ 104混合成1%、0.01%的模拟文库,筛选Y轴信号高的细胞群,如图5(a)所示。经过两轮筛选,每一轮随机挑取24个单克隆测序,两个模拟文库均有效富集了组5菌株(展示AmNB1613.36),如图5(b)所示。经过两轮流式分选,1%模拟文库中AmNB1613.36占比达到100%,0.01%模拟文库中AmNB1613.36占比达到92%,说明双功能酵母展示与分泌系统可高效将高亲和力突变体从文库中筛选出来。将组5、组6菌株诱导72 h的培养基上清液用Octet Red96仪器检测与抗原的亲和力,如图5(c)所示,两者培养基上清液样品均能测定与抗原的结合动力学参数。以上结果充分验证了双功能酵母展示与分泌系统及其在抗体亲和力成熟中的应用可行性,从而显著提高工作效率、缩短抗体亲和力成熟的周期。
3 结论
本研究介绍了一种双功能酵母展示与分泌系统,克服了传统酵母展示无法表达抗体至上清液的缺点,应用于抗体的亲和力改造,显著缩短时间、降低成本。此系统以抗人PD-L1的VHH抗体(AmNB1613.36)为例,初步证明了双功能酵母展示与分泌系统构建成功;通过1%、0.01%的模拟文库进一步验证,充分证实了双功能酵母展示与分泌系统可用于抗体的亲和力成熟中,从而显著提高工作效率、缩短抗体亲和力成熟的周期。
