表面活性剂添加量对微生物电合成转化二氧化碳的影响
2021-11-05王光荣宋天顺谢婧婧
王光荣,宋天顺,谢婧婧
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
随着人口的增长和经济的发展,减少传统的化石燃料燃烧产生的温室气体已成为迫在眉睫的问题[1-3]。目前,CO2作为一种潜在的碳资源,其转化固定的方法有很多,主要包括化学还原[4]、光催化[5]和生物还原等[6]。在现有技术中,微生物电合成系统 (MES) 是利用电活性微生物作为生物催化剂,在阴极表面获得电子,将CO2还原成有机化合物的一种新型微生物技术[7-8]。与生物光合作用和其他CO2固定方法相比,MES具有许多优势,如:电子受体来源广,转化效率高,成本低和反应条件温和[9-10]。
迄今为止,MES的操作效率主要受生物催化剂和电极材料的影响。MES系统中使用的生物催化剂可分为两大类:混合微生物菌群[10-11]和纯菌。其中,纯菌的生产力相对低于混合微生物菌群,但纯菌具有清晰的代谢途径,适合进行方法学的研究。主要的纯菌种类包括:Clostridiumljungdahlii[12]、Sporomusaovata[13-15]和Moorellathermoacetica[15]。更多对于MES的研究集中在对电极材料的修饰上,如在碳布和三维支架上装饰导电材料网状玻璃碳(RVC)[16]或泡沫镍[17]等,也可以利用析氢材料如碳化钼修饰电极[18],增加电子的转移效率,从而提高乙酸盐的浓度。表面活性剂是一种两亲性的分子[19],由于其会改变细胞表面的亲/疏水特性,提高细胞对营养底物的摄取和吸收[20],帮助底物进入细胞[21],增加底物利用率等[22-24],多被用于提高发酵产物的产量[19]。但还未见添加表面活性剂对MES性能的影响,尤其是对C4产物的影响。通过前期的预实验,笔者发现非离子型表面活性剂聚乙二醇对C.ljungdahlii的毒性最小,故笔者主要研究不同添加量的聚乙二醇对MES性能的影响,以期对MES中如何提高电子传递速率提供一定的理论参考。
1 材料与方法
1.1 材料及仪器
1.1.1 材料
C.ljungdahlii菌株是通过基因手段将丙酮丁醇梭菌的BAPP基因整合到Clostridiumljungdahii菌株的代谢通路中,由上海生命科学研究院植物生理生态研究所提供。
富集培养基(L):胰蛋白胨10 g,酵母粉16 g,D-果糖10 g,NaCl 0.2 g,半胱氨酸0.3 g;微量元素2 mL,维生素1 mL,刃天青0.5 mL;用HCl调节pH为6.0。
阴极液培养基(L): 酵母粉1 g,NH4Cl 1 g, KCl 0.1 g, CaCl20.02 g, MgSO4·7H2O 0.2 g, NaCl 0.8 g, KH2PO40.1 g, NaHCO31 g, Na2S 0.3 g,L-半胱氨酸盐酸盐0.3 g;微量元素10 mL,维生素1 mL,刃天青 0.5 mL;用HCL调节pH为 6.0。
阳极液培养基(L): NaCl 6 g, KCl 2 g;无机盐培养基(PETC培养基)50 mL,H2O 950 mL。
PETC培养基(L): NaCl 16 g,KCl 2 g,MgSO4·7H2O 4 g, NH4Cl 20 g, KH2PO42 g,CaCl20.4 g。
1.1.2 仪器
Keithley Instruments 2700数据采集器,美国吉时利电子有限公司;CHI 1000C、CHI 660E电化学工作站,CHI 1000C多通道恒电位仪,上海辰华仪器有限公司;H型MES反应器,广西理化有限公司;行稳阳极,中国宝鸡龙胜有色金属有限公司;GC-2010 Plus,SHIMADZU气相色谱仪,UV-1100紫外分光光度计,上海美谱达有限公司;DG 250厌氧工作站,广州华粤行仪器有限公司;Nafion 117质子交换膜,美国杜邦公司;辅酶II NADP(H)测试盒,苏州科铭生物公司;JSM-5900扫描电子显微镜,日本电子株式会社。
1.2 MES反应器的构建
采用双室H型反应器,结构见图1。由图1可知:用质子交换膜将阴、阳两室隔开,两室溶液体积均为250 mL。阴极电极材料为石墨毡,大小为5 cm×5 cm×0.5 cm,行稳阳极为具有铱和钌涂层的钛网,其物理表面积为25 cm2,阴阳极通过导线连接至电化学工作站和数据采集器,除实验因素外,外接电阻均为10 Ω。纯度为100%的CO2不断地通入MES的阴极室。使用多通道恒电位仪将阴极电位设置为-1.05 V。
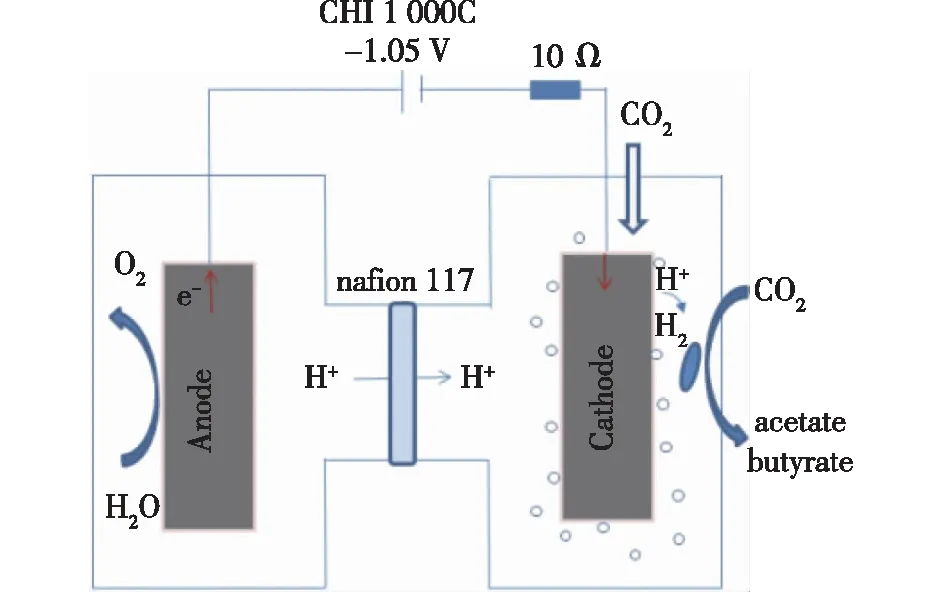
图1 微生物电合成工作原理
1.3 实验方法
1.3.1 菌种的液体活化
配置富集培养基,并于115 ℃灭菌30 min,冷却后放置在厌氧工作站中除氧,从-80 ℃冰箱取出C.ljungdahlii菌株,以10%的接种量活化,活化4~5次,当吸光度值(OD600)达到0.6时,向MES反应器的阴极室接入10 mL的菌液。
1.3.2 MES反应器的搭建与设置
本实验共搭建10组MES反应器,分别设为空白对照(CF),以及添加0.5%、1.0%、2.0%和4.0%不同体积分数聚乙二醇(PEG)的实验组,每个实验组设置2组平行实验,每天取样1 mL,测定其OD600,然后将样品通过0.22 μm水系滤膜注入样品瓶中,在样品瓶中加入5 μL 体积分数为50%的HCL,混匀并测定其产物浓度。
1.4 分析方法
1.4.1 产物及H2浓度的测定与计算
在实验前后,用配备有热导检测器的气相色谱仪测量H2浓度。在正常工作的MES反应器内进行H2含量的测定。色谱柱为Porapak Q填充柱。具体检测方法:气化室温度为120 ℃;检测器温度为100 ℃;色谱柱温度为60 ℃,保留时间为5 min,无升温程序。测量前使用N2(纯度为99.999%)连续吹扫30 min使系统脱氧。
使用配备有氢离子火焰检测器的气相色谱仪分析MES反应器溶液中的产物。色谱柱型号:Agilent HP-INNOWax毛细管柱(30 m × 0.25 mm×0.25 μm)。气化室温度180 ℃,检测器温度为270 ℃。色谱柱升温程序:起始柱温为60 ℃,保留0.5 min;按每分钟10 ℃升温至200 ℃,保留0.5 min;共计15 min。载气为N2(纯度为99.999%),流速为1.32 mL/min。
1.4.2 线性伏安曲线(LSV)的测量
在室温下,在标准三电极电化学池中进行线性扫描伏安法的测量。所有测试均在上述阴极液培养基介质中以阴极作为工作电极,行稳阳极作为对电极,Ag/AgCl电极作为参比电极。
1.4.3 还原当量的测定
使用辅酶Ⅱ NADP(H)测试盒对每组实验样品进行还原当量的测定(按照操作说明书进行)。
1.4.4 生物膜的电镜表征(SEM)
阴极表面的表面形态,根据参考文献[25]的方法固定化后,利用电子显微镜进行观察。
2 结果与讨论
2.1 PEG 对于MES 电化学性能的影响
在实验结束后,笔者对各实验组的电流和库伦效率(CEs)进行了分析,结果见图2。由图2可知:接种后立即产生电流,并在1.5 d左右变得相对稳定。1.0% PEG的电流最高,为10 mA左右;其次是0.5% PEG,其电流约为8.5 mA;再次是2.0% PEG,前5天电流均为8.0 mA左右,然后开始缓慢下降,可能是生物膜的增厚和底物浓度的增加导致反应速度降低[26-28],到第7天,2.0%PEG的电流为6 mA,和CF的电流相似;4% PEG的电流最低。同时,实验结束后,通过计算产物库伦效率。由图2(b)可知:1.0% PEG,2.0% PEG和0.5% PEG的库伦效率较为相似,约为(42±1)%,然后是CF 39.5%,4.0% PEG 的库伦效率最低为34.3%。且4.0% PEG组的电流和库伦效率均低于CF,而其余实验组均高于CF,可能是4.0% PEG抑制了细胞生长,从而降低了电子的传递速率。
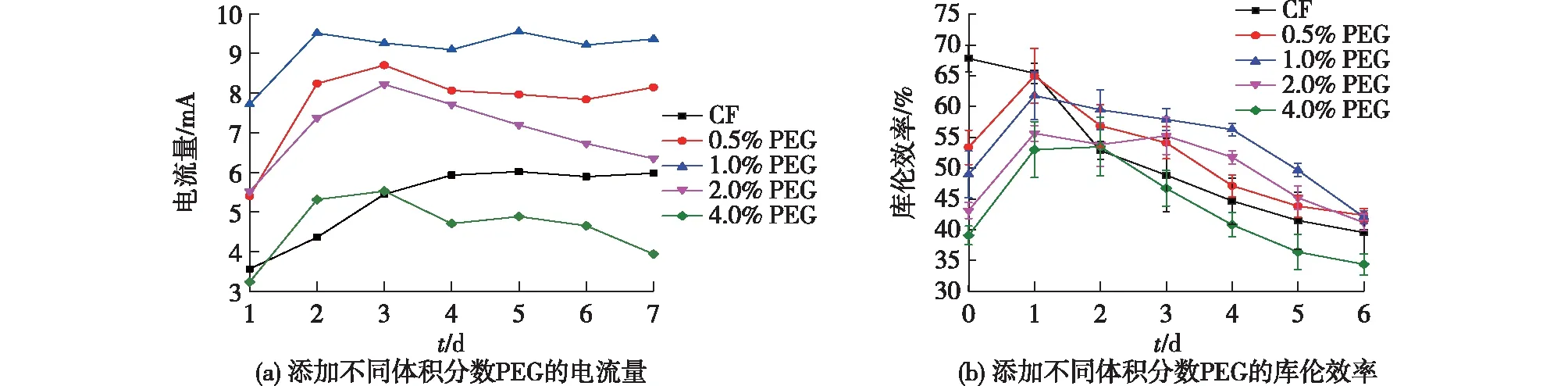
图2 添加不同体积分数PEG的电化学性能:电流量和库伦效率
2.2 PEG对MES产物的影响
实验过程中,每天监测反应器溶液中的OD600和产物浓度,结果见图3和表1。由图3(a)可知:接种后,阴极培养基的OD600在某种程度上代表了培养基中微生物的生长。由图3(a)可知:所有MES的初始OD600约为0.005,并且随着时间的延长迅速增加。在实验结束时,发现1% PEG 的OD600最高,为0.076,其次是0.5% PEG的OD600为0.070和2.0% PEG的OD600为0.066,均高于CF的OD600为0.060,而4.0% PEG的OD600要低于CF,仅为0.054。通过图3(b)、(c)和(d)观察到的MES反应器中的产物主要是乙酸盐,丁酸盐和少量乙醇。其中,1.0% PEG的最高乙酸产率为(0.73±0.11) g/L,其次是0.5% PEG,为(0.52±0.01) g/L,2.0% PEG为(0.51±0.01) g/L和CF(0.47±0.02) g/L,最低的是4.0%PEG,为(0.38±0.02) g/L。由表1可知:1.0% PEG中的乙酸盐产率为每天0.105 g/L,是CF组的 1.57倍,其次是0.5% PEG,为每天0.075 g/L和2.0% PEG,为每天0.073 g/L,分别是CF的1.12和1.09倍,4.0% PEG的乙酸产率最低为0.054 g/L,是CF的0.81倍。此外,随着时间的延长也产生了乙醇,乙醇有先增加后减少的趋势,但产物的浓度差异不大。
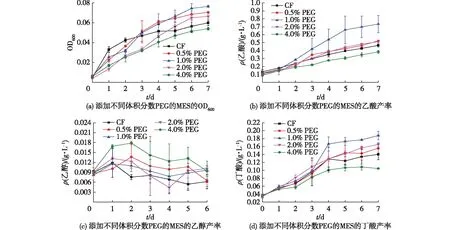
图3 添加不同体积分数PEG的MES实验:OD600以及乙酸、乙醇和丁酸产率
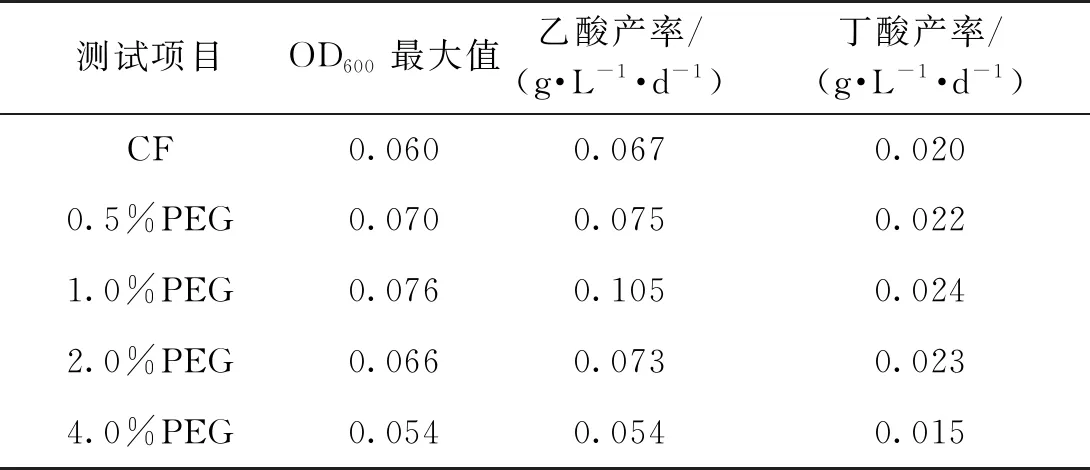
表1 添加不同体积分数PEG的OD600最大值和产物速率
在实验过程中还检测出丁酸作为C4产物且持续积累,结果见图3(d)。由图3(d)可知:1.0%PEG的MES的丁酸质量浓度最高,为(0.18± 0.01) g/L,其次是2.0%PEG,为(0.17± 0.01) g/L和0.5%PEG,为(0.16± 0.01) g/L,均要高于CF组的丁酸质量浓度(0.14± 0.01) g/L,而4%PEG的丁酸质量浓度最低,仅为(0.11± 0.01) g/L。相应的,1.0%PEG最高的丁酸产率为每天0.024 g/L,是CF的1.2倍。最后发现4.0%的PEG的产物(乙酸和丁酸)均要低于CF,可能是4.0%的添加量过高,对菌株的生长有较强的抑制作用[19]。这主要是由于C.ljungdahlii中丁酸途径的导入,可以利用来自阴极的H2作为MES中良好的电子载体,产生长链的C4产物。
2.3 生物膜分析
不同体积分数PEG的SEM图见图4。由图4可知:在阴极培养基中加入PEG有利于促进微生物的附着。图4中碳毡表面附着堆积的杆形或梭形菌株为本实验中的C.ljungdahlii菌株在实验过程中形成的生物膜,从碳毡表面菌株的附着情况可以侧面表示在MES反应器中菌株的生长情况。其中图4(c)中1.0%的PEG的实验组材料上附着的微生物最多;其次是图4(b)中0.5%的PEG实验组和图4(d)中2.0%的PEG实验组,图4(e)中4.0%的PEG实验组和图4(a)中CF的附着的微生物相差不大,在碳纤维中观察到较少的细菌。综上,由图4可以看出:低浓度PEG有利于微生物的附着,而高浓度的PEG浓度同样也不利于微生物的附着,这也和笔者的产物数据符合。

图4 CF,0.5% PEG,1.0% PEG,2.0% PEG和4.0% PEG的SEM
2.4 PEG影响MES性能的机制分析
实验结束后,除了分析其产物数据和生物膜,笔者也对其他的参数进行了分析,主要分析了线性伏安曲线、H2浓度和还原当量。
线性伏安曲线(图5)可以反映不同体积分数PEG对催化活性的影响。由图5可知:在-1.05 V时,0.5% PEG、1.0% PEG、2.0% PEG和4.0% PEG的阴极电流密度分别增加到-0.52、-0.86、-0.54和-0.36 mA/m2,具有1.0% PEG的MES的阴极电流密度比CF(-0.42 mA/m2)高2.1倍。阴极电流密度的增加表明:通过向阴极室中添加低浓度的PEG可以提高阴极的电子转移能力,加快CO2的还原速度。而4.0%的PEG的电流和电流密度均要低于CF,可能是添加高浓度PEG有一定的细胞毒性,从而抑制了菌株生长。
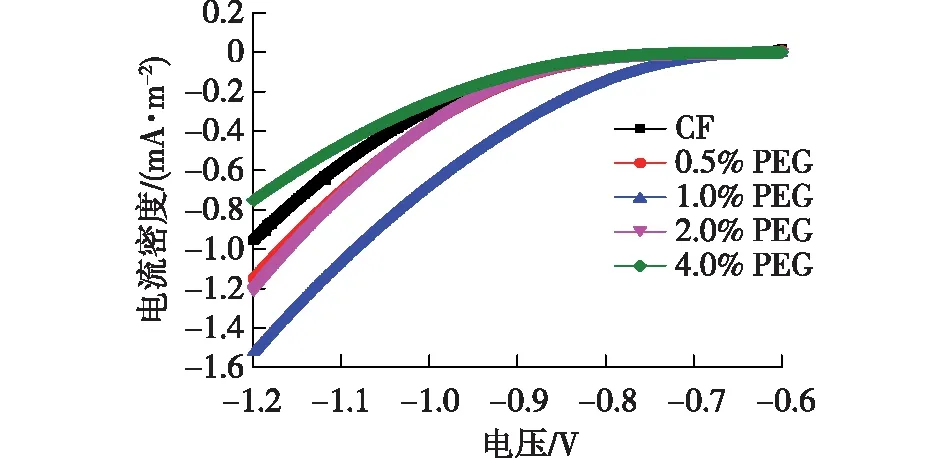
图5 实验结束后不同体积分数的PEG的线性伏安曲线
同时,笔者在实验开始前和结束后(图6)均测量了实验组的H2浓度。从图6(a)可以看出:在不使用C.ljungdahlii的情况下,H2产率随着PEG添加量的增加而增加,均远高于CF组。4.0% PEG具有最高的H2产量(1.56%)。由图6(b)可以看出:在C.ljungdahlii存在下,添加PEG的实验组在MES中产生的H2高于CF获得的H2,其中1.0% PEG 析出H2浓度最高,为0.121%,是CF(0.042%)的2.8倍;其次是0.5%PEG(0.085%),2.0% PEG(0.073%)和4.0% PEG(0.058%),分别是CF的2.02、1.74和1.38倍。
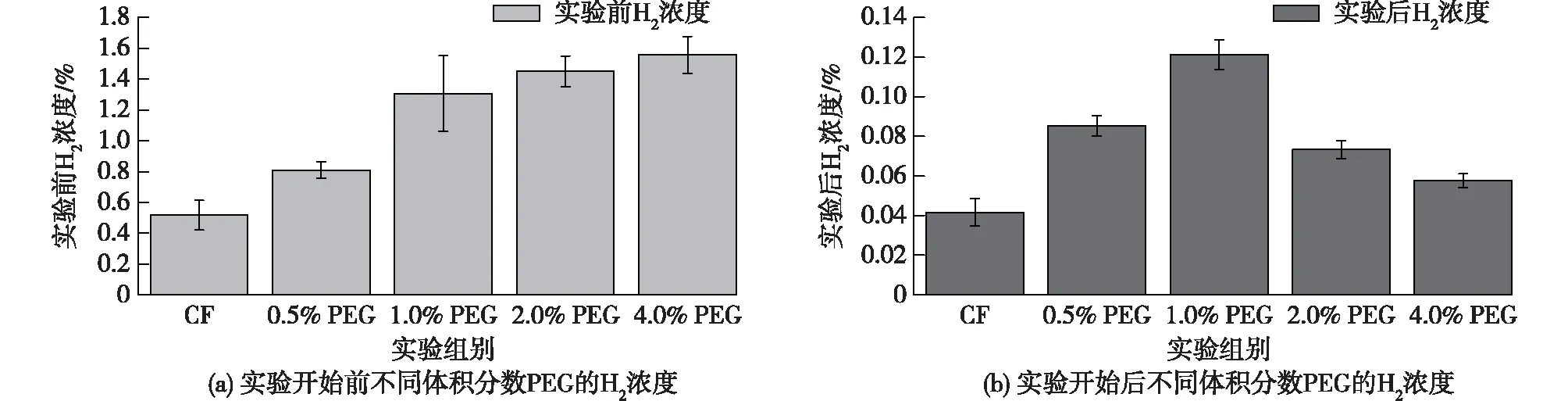
图6 实验前后不同体积分数PEG的H2浓度
由于PEG是一种非离子型表面活性剂,加入PEG可提高溶液中H2的产率,这和文献[29-30]报道的现象一致。而实验结束后各实验组的H2浓度均低于实验开始前,可能是因为MES系统中的微生物会持续消耗H2[31],C.ljungdahlii可以利用来自阴极的H2作为MES中良好的电子载体。而2.0% PEG和4.0% PEG的产H2浓度并没有随着PEG添加量的增加而增加,可能是因为随着时间的延长,过高的表面活性剂浓度反而影响了其本身的表面活性[32-33],从而影响了反应器中H2的产生。
实验结束后的还原当量见图7。由图7可知:低浓度PEG的还原当量较高,包括1.0%和0.5%的PEG,其次是2.0%的PEG,而4.0%的PEG和CF的还原当量相对较低。相应的,1.0% PEG的乙酸和丁酸累积达到的产量最高,分别为(0.73±0.11) g/L和(0.18±0.01) g/L,其中,MES丁酸产率是CF的1.21倍,乙酸产率是CF的1.58倍。在其他添加PEG的MES中观察到了相同的趋势。随着H2浓度的提高,丁酸与乙酸的增加率之差变大。这种现象表明在MES系统中H2含量即还原力在产物调节中起着重要作用。
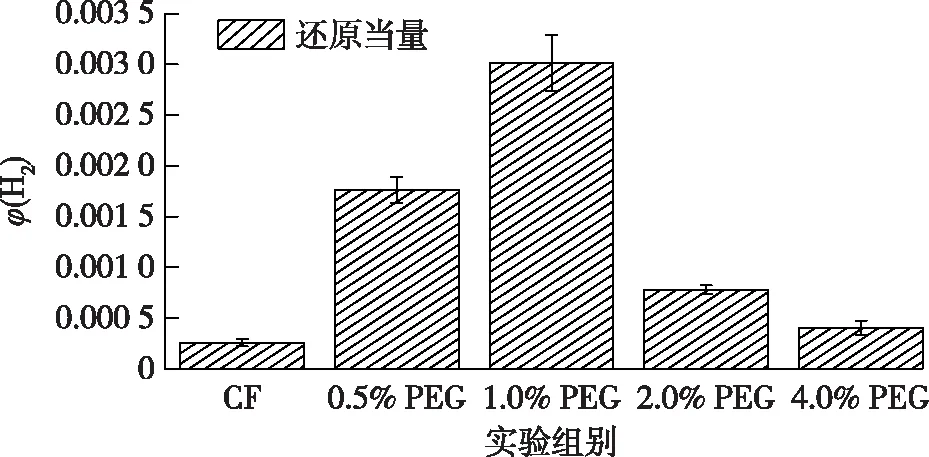
图7 不同体积分数PEG的还原当量
由以上结果可以说明:加入低浓度的PEG有助于H2的产生,从而提高代谢通路中的还原力及电子传递效率。在-1.05 V电势下会发生H2析出,从而提高电子传输速率和MES的性能。在笔者的研究中获得的产品不仅限于乙酸、丁酸产率,产量每天为0.024 g/L,这主要与引入丁酸代谢途径有关。在C.ljungdahlii的代谢途径表明(图8),C.ljungdahlii包括Wood-Ljungdahl途径,可通过该途径将CO2还原为乙酰-CoA,而乙酰-CoA可进一步转化为乙酸和乙醇[34]。在此过程中,乙醇的产生是可逆的,这解释了为什么乙醇的产生如此之低,并且在MES系统中未观察到乙醇的积累。通过将丁酸盐生产途径引入C.ljungdahlii,还可以将乙酰-CoA转化为丁酸。乙酸和丁酸均由乙酰-CoA转化而来,因此,乙酸和丁酸的产量同时增加。丁酸生产需要C.ljungdahlii代谢途径中的高浓度质子。质子来自两种不同的途径。质子可能来源于阳极中的水电解,通过H+依赖的ATPase酶转运蛋白进入细胞膜,促使细胞生长并伴随ATP的合成[35]。质子也可以由H2生成,通过被动扩散进入细胞膜,经过双功能电子传输氢化酶转化为质子[36-37]。而PEG的存在可以改善H2的产生,从而为丁酸盐的生产提供更多的质子,提高还原当量。
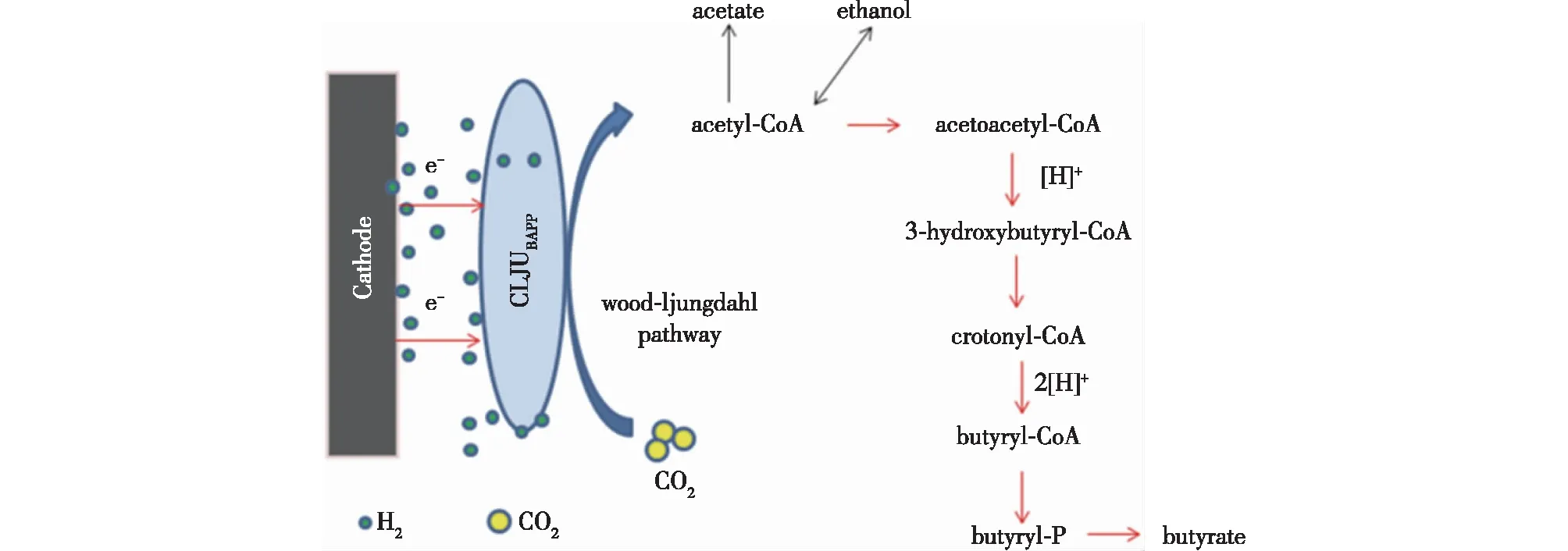
图8 C. ljungdahlii的代谢路径[34]
3 结论
研究了非离子表面活性剂PEG的添加量对MES性能的影响,结果发现体积分数为1.0%的PEG的MES性能最好,其乙酸和丁酸质量浓度能分别达到(0.73±0.117) g/L和(0.18±0.01) g/L,是CF的1.58和1.21倍。其机制可能是由于低浓度的PEG的细胞毒性相对较低,同时可以增加H2产生,从而提高了电子的传递效率,增加产品浓度。而4.0%PEG的丁酸盐浓度仅为(0.11± 0.01) g/L,要低于CF,可能是4%的添加量过高,抑制了菌株的生长。
