鼠李糖乳杆菌对肠道屏障功能的影响机制研究进展
2021-11-05唐昱婷汤加勇
唐昱婷,汤加勇,赵 华
(四川农业大学动物营养研究所/动物抗病营养教育部重点实验室,成都 611130)
集约化的养殖模式、环境及饲料中的病原体、有害物质等都给现代化规模养殖带来挑战,在这种条件下,如何提高动物免疫力和抗病力显得尤为重要。维持肠道健康是提高动物免疫力和抗病力的重要途径之一。
鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)属乳杆菌属,是产L-乳酸,不产芽孢,厌氧耐酸的革兰氏阳性共生菌,被用于生产酸奶,也是临床实验中研究最多的益生菌之一。LGG能通过抑制病原体黏附和定植平衡肠道菌群,维护肠道屏障完整性,调节肠道免疫功能等方式促进肠道健康,并且具有预防和治疗腹泻、排除毒素、提高动物生产的能力。本文主要综述LGG对肠道屏障功能的影响及可能机制研究进展,以期为益生菌产品发挥生理功能及畜牧养殖替抗提供理论基础和新的思路。
1 LGG对肠道屏障功能的影响及可能机制
肠道屏障是抵御入侵肠道有害微生物和抗原的第一道防线[1],是维持机体内环境稳定的重要屏障。任何一部分缺陷或受损都可能导致肠通透性增加、肠菌群失调,导致肠道炎症以及其他肠道疾病,严重影响畜禽肠道健康。LGG对肠道的保护作用主要体现在以下3个方面:平衡肠道菌群;维护肠道屏障结构完整;调节肠道免疫功能、增强肠道免疫力。
1.1 平衡肠道菌群
健康肠道中微生物保持着一定平衡,以此形成对抗病原体的重要保护屏障。LGG因耐酸(pH 1.8~3.2)[2]和胆盐(1%w/v)[3]能以活菌形式进入肠道,通过其强黏附能力、分泌有机酸等抑菌物质的方式抑制病原菌黏附和定植在肠上皮细胞,平衡肠道菌群,维护肠道健康。
黏附能力强是LGG的一个显著特点[3-4]。LGG对肠黏膜和黏液的黏附力主要得益于其自身结构中的胞外多糖(exopolysaccharides,EPS)[5]、菌毛 SpaCBA[6]、菌毛基因簇 spaDEF[7]、表层蛋白(surface layer protein,SLP)[8]及分泌的黏附蛋白 LGG-0816[9]协同作用,有利于LGG与病原微生物竞争结合肠细胞,刺激免疫系统,抑制病原菌的黏附和致病作用,平衡肠道菌群。彭富强等[10]研究发现,添加1010CFU/kg和1011CFU/kg LGG能显著降低21日龄肉鸡盲肠内容物中大肠杆菌菌落数,效果与添加抗生素组(抗菌肽锌40 mg/kg)相似,且有优于抗生素组的趋势。W.Panpetch等[11]用LGG处理脓毒症小鼠后减少了粪便中沙门氏菌数量,减轻了肠道泄漏。Lin R.等[12]用109CFU/day LGG和嗜酸乳杆菌补充剂处理暴露于脱氧雪腐镰刀菌烯醇(doxynivalenol,DON)的无胸腺裸鼠,通过增加阿克曼菌、恢复拟杆菌丰度平衡肠道菌群,并与对照组菌群无显著差异,同时促进有机酸(主要是丁酸)产生防止肠道受损。益生菌在低龄或是免疫能力低下动物中的益生效果仍不能确定,以上试验显示出LGG对免疫缺陷的无胸腺裸鼠也可能维持肠道健康,这一发现有利于今后为低龄或免疫能力低下动物的肠道保护提供理论依据及可能性。
1.2 维持肠道屏障结构完整
肠道屏障功能的行使主要建立在完整的肠上皮细胞和细胞间的紧密连接结构。LGG能通过刺激肠上皮细胞,促进紧密连接、黏蛋白等表达,维护肠道屏障结构完整,有效阻止细菌及内毒素等有害物质较强的刺激和正常菌群侵袭;此外,研究者发现的一种LGG外分泌蛋白p40能通过表皮生长因子受体(epidermal growth factor receptor,EGFR)介导调节磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase)/蛋白激酶 B(protein kinase B,Akt)信号途径,防止细胞凋亡、促进细胞增殖,并能对右旋糖酐硫酸钠(dextran sodium sulfate,DSS)、恶唑酮(oxazolone)、三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)等造成的肠道损伤进行修复,维护肠道屏障完整性。
1.2.1 LGG通过促进紧密连接和黏蛋白表达维护肠道屏障结构完整
LGG能通过促进紧密连接和黏蛋白表达维护肠道屏障的完整性。ZO-1起到连接细胞的作用,对维持紧密连接结构具有重要作用。E.Miyauchi等[13]用4种乳杆菌(105CFU/well)对人上皮Caco-2细胞进行处理,结果发现LGG通过增加ZO-1表达水平,显著恢复人上皮Caco-2细胞跨上皮电阻(trans-epithelial resistance,TER),从而稳定紧密连接蛋白结构和分布,减轻肿瘤坏死因子(TNF-α)诱导的细胞损坏程度,维护肠上皮屏障完整性。Mao J.D.等[14]用脂多糖(lipopolysaccharide,LPS)诱导仔猪肠道屏障受损引发腹泻时发现2.5×1010CFU/g LGG可以通过缓解ZO-1、claudin3表达降低,恢复回肠绒毛高度降低,缓解仔猪腹泻。黏蛋白2(mucoprotein-2,MUC2)是产生黏液层的关键[15],LGG能促进肠道表达黏蛋白,抑制病原微生物黏附及细菌易位。A.F.Mattar等[16]研究发现,向单层肠上皮Caco-2细胞表面添加104~108CFU/mL LGG能显著增加MUC2表达,抑制病原微生物的黏附和细菌易位,当LGG浓度达到108CFU/mL时能100%抑制细菌易位。黏液素能介导细菌的生长,LGG刺激黏蛋白的生成可能也有助于LGG的定植。
1.2.2 LGG通过分泌蛋白p40促进肠上皮细胞增殖
LGG还能通过调节肠细胞凋亡维护和修复肠道,这一功能的实现依赖于LGG分泌的蛋白p40和p75,其中p40起主要作用。PI3K/Akt信号途径在调节肠上皮细胞增殖、分化、凋亡以及迁移中发挥关键作用,通过失活几种促凋亡途径,包括Bad、Caspase9和Caspase3及通过激活细胞周期调节因子,如cyclin/cyclin-依赖性激酶(CDK),起到抗凋亡作用。研究发现,p40发挥作用主要是通过激活去整合素-金属蛋白酶17(a disintegrin and metalloproteinase 17,ADAM17)使表皮生长因子受体(EGFR)磷酸化激活PI3K/Akt信号通路[17-19],抑制细胞因子诱导的细胞凋亡[20],上调肠上皮细胞黏蛋白产生,维护肠道屏障完整性,增强肠道屏障保护作用。p40是第一个通过特定信号通路促进肠上皮稳态的益生菌蛋白,能明显减少细胞因子引起的肠上皮损伤,失去了p40的LGG上清液不能预防TNF诱导的肠上皮细胞受损。除LGG外还有一部分乳酸杆菌也能通过外分泌蛋白形式非接触性地对肠上皮细胞显示出抗凋亡和促增殖作用,但某些乳酸杆菌如嗜酸乳杆菌必须与肠上皮细胞接触发挥作用。这为益生菌的应用难点提供了新思路。目前,对这种外分泌蛋白的研究主要集中在细胞水平,在动物上的研究及应用还需进一步深入。
1.3 调节肠道免疫功能
LGG能刺激肠道相关淋巴组织(gut-associated lymphoid tissue,GALT)诱发免疫反应,产生免疫效应因子,发挥免疫作用,抵抗病原微生物对机体的侵袭;同时,LGG及其有效组分(SLP、EPS)通过Toll样受体介导调节核转录因子-κB(nuclear factor-kappa B,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、细胞外信号调节激酶(extracellular regulated protein kinases,ERK)信号传导途径对肠道细胞因子进行调节,提高机体对外来微生物入侵和疾病的防治。
1.3.1 LGG能增强免疫力
IgA能利用其高亲和力中和微生物毒素和病原体,并防止共生细菌利用低亲和力破坏黏膜表面,以非炎症方式实现免疫保护和免疫排斥,是重要的先天防御方式,能促进肠道长期稳态[21-22]。LGG能通过促进IgA产生对机体产生有效保护。Yan F.等[23]通过构建早期LGG定植模型发现新生小鼠出生后1~5 d口服LGG能促进其生长、肠上皮细胞增殖、分化及紧密连接的形成,同时越早开始口服其肠道中LGG定植率越高,最高可达70%~100%,LGG定植有利于显著提高幼龄及成年小鼠IgA产生,并显著降低 DSS诱导的TNF、KC、IL-6 mRNA表达升高,减轻肠道泄漏,增加粪便中乳酸杆菌的数量,对小鼠肠道产生长久保护作用。此外,p40对肠道免疫也显示出正面效应:p40通过激活EGFR介导上调小鼠肠上皮细胞增殖诱导配体April基因表达,促进小鼠肠道固有层B细胞产生IgA,调节黏膜免疫防止炎症,预防和改善小鼠实验性结肠炎[24-25],同时p40上调了B细胞激活因子(Baff)的表达,这也可能有利于IgA产生。此外,研究者发现结肠上皮细胞分泌胞外囊泡中的热休克蛋白90(heat shock protein 90,HSP90)能增强LGG产生p40,并增强LGG介导的肠道炎症改善[26],这揭示了LGG的抗炎作用也能被肠上皮细胞反向增强,从而维持肠道健康。这一发现为开发益生菌的衍生蛋白作为新的治疗剂提供了理论基础和新思路。
1.3.2 LGG能减轻肠道炎症
NF-κB、MAPK和ERK信号通路是动物体内重要的调节通路,他们的激活与炎症发生、细胞凋亡等密切相关。LGG及其有效组分(SLP、EPS)能通过Toll样受体介导调节 NF-κB、MAPK、ERK 信号通路,调节外来抗原诱发的炎症反应。
LGG能通过特异性激活天然免疫Toll样受体9(toll-like receptors 9,TLR9),减弱坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的发展[27]。进一步研究发现,LGG还依赖TLR2/TLR9抑制脂多糖受体TLR4 的信号传导[28-29],抑制 p65/NF-kB、p38/MAPK和ERK1/2信号转导,下调促炎因子IL-6、IL-12和TNF-α表达,减轻LPS诱导的炎症[30-31]。LGG的某些成分对机体免疫功能也有影响。Gao K.等[32]发现LGG 的表层蛋白(SLP)、胞外多糖(EPS)也能抑制p65/NF-kB、p38/MAPK和ERK1/2信号转导,下调促炎因子IL-6、IL-12、TNF-α的表达,减轻肠道炎症。而同为组分之一的CpG-寡核苷酸(CpG-ODN)显示出相反的结果,可能是CpG-ODN和LPS对小肠上皮细胞(intestinal epithelial cells,IECs)具有协同免疫刺激作用,CpG-ODN能特异性识别TLR9[33],激活TLR9后完成下游信号转导,并诱导强烈的Th1型炎症反应,这也为益生菌及宿主间的相互分子作用机制提供了新思路。
以上研究表明,LGG能通过识别、调节天然免疫和获得性免疫反应,提高抗炎因子、降低促炎因子含量提高机体对外来微生物入侵和疾病的防治。其保护肠道的可能机制为:LGG能促进丁酸等有机酸的产生,平衡肠道菌群;LGG能通过分泌蛋白p40激活PI3K/Akt信号途径促进紧密连接及黏蛋白的表达,保护肠道物理和化学屏障、预防肠细胞受损;LGG及其有效成分SLP、EPS能通过抑制TLR4的激活,抑制p65/NF-κB、p38/MAPK以及ERK1/2信号途径,抑制LPS诱导的炎性因子升高,缓解肠道炎症,同时促进IgA增强肠道免疫力(图1)。
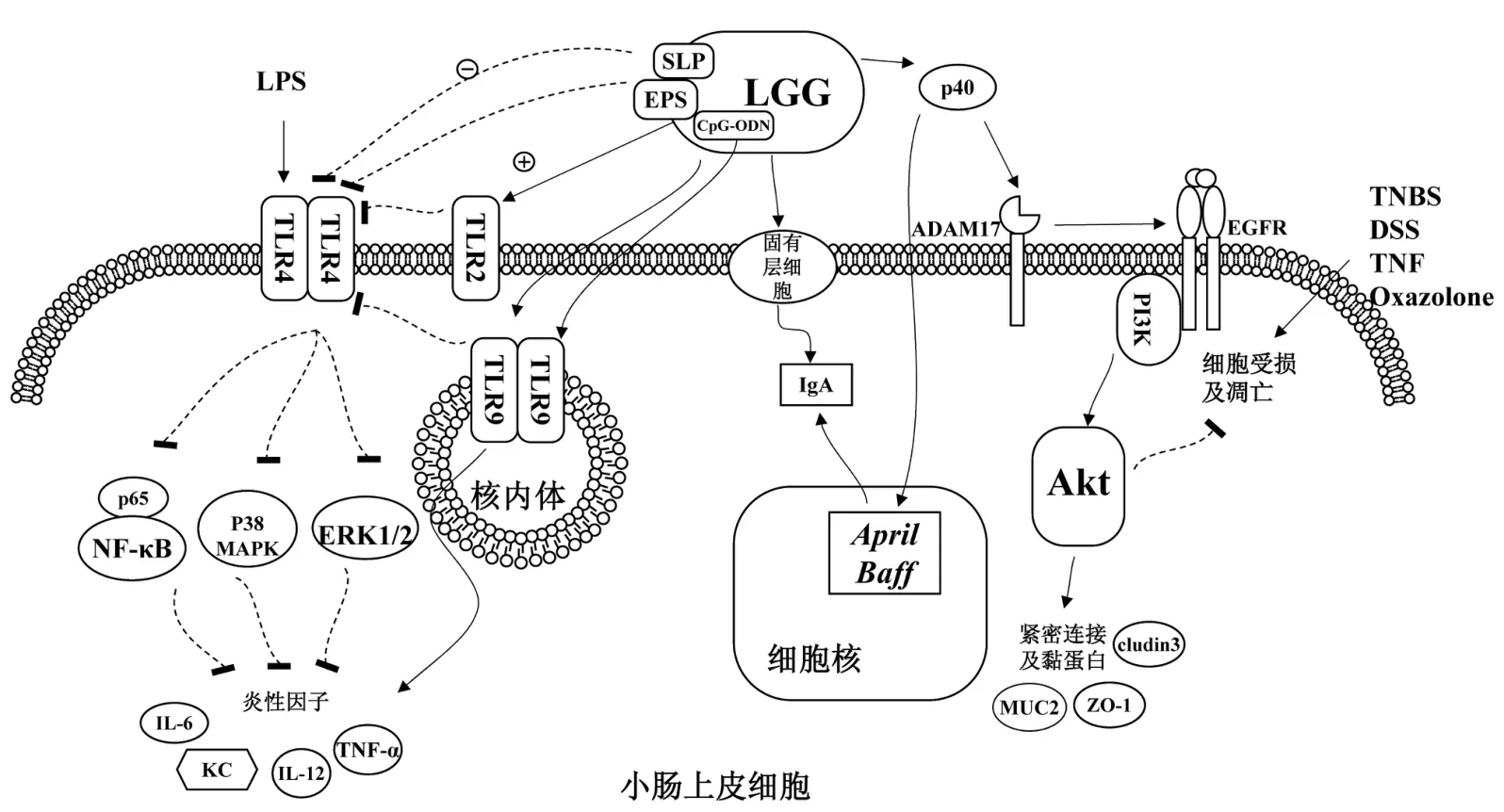
图1 LGG对肠道屏障作用机制图Figure 1 The mechanism of action of LGG on intestinal barrier
2 LGG在动物生产中的应用
LGG在近40年时间内,由于其优良的益生特性被广泛研究和应用到动物生产中。
2.1 提高生产性能
LGG能提高动物的生产性能。Chen F.等[34]研究发现,饲料中添加2×108CFU/g LGG能显著降低特定无病原体鸡(specific pathogen-free,SPF)肠道中大肠杆菌数量,提高其平均日增重(ADG),降低料肉比(FCR),改善生产性能。Zhang L.Y.等[35]研究发现,饲料中添加1010CFU/d LGG悬浮液饲喂6周能显著增加犊牛的平均日增重。M.Sewaka等[36]用10g/kg洋姜和108CFU/g LGG饲喂红罗非鱼时发现,添加益生菌后具有更高的(P<0.05)饲料转化率(FCR)、比生长速率(SGR)和平均日增重(ADG),促进了红罗非鱼的生长。
2.2 预防和减轻腹泻
LGG能有效预防及减轻病原微生物诱发的腹泻。Mao X.B.等[30]在饲料中添加109CFU/kg LGG可以一定程度缓解轮状病毒(rotavirus,RV)诱导的断奶仔猪腹泻。焦连国等[37]按照1 kg/1 000 kg饲料比例添加LGG冻干粉(1010CFU/g)连续饲喂断奶仔猪3周,提高了仔猪终末重及饲料转化率,降低腹泻发病率。Zhang L.等[38]在饲粮中添加 1.2×108CFU/g LGG 能抑制大肠杆菌引起的IL-6、IL-1β和TNF-α升高,减轻炎症,保护肠道健康,显著降低断奶仔猪腹泻率。研究表明,LGG能显著降低感染沙门氏菌小鼠的 TNF-α、髓过氧化物酶(myeloperoxidase,MPO),维持IL-10水平,比另一种植物乳杆菌ZS2058对肠道炎症有更强的缓解作用[39]。这提示LGG通过调节肠道微生物来增强肠道抗体防御以及调节机体炎性细胞因子有效减轻动物腹泻。
2.3 其他作用
LGG除了具有上述益生作用外,还具有增强肠道抗氧化、减少饲料中有害物质、维护肠道微生态平衡、增强机体免疫力等作用。LGG能显著降低酒精损伤小鼠的氧化应激并恢复肠道菌群,保护酒精性肝损伤及肠道氧化应激和炎症[40];显著降低氧化应激相关基因表达,提高超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,减轻Caco-2细胞的氧化应激[41]。饲料中的有害物质如黄曲霉毒素[42]、脱氧雪腐镰刀菌烯醇[12]、常见镰刀菌毒素[31]、重金属镉、铅[43]以及微囊藻毒素-LR[44]等会进入肠道,而LGG可以通过轻微降解毒素及吸附、固定减少毒素转运等方式保护肠道和动物健康[44-46]。LGG能促进分泌有机酸、细菌素等抑菌物质,抑制有害菌的定植,平衡菌群,维护肠道微生态平衡[12,47]。此外,LGG能增强机体免疫力以保护动物健康,LGG能增加IgA、IgG和IgM的表达,降低IL-6、IL-1β的表达,减轻TNF-α和TNF-γ诱导的屏障功能障碍、防止病原体或促炎细胞因子诱导的对肠道结构和功能的有害影响[48]。
3 小结
LGG作为一种模式益生菌对动物肠道健康展现出多方面的保护作用,除了能增强肠道物理、化学屏障功能外,还能调节肠道微生物和免疫功能,促进损伤肠道修复等,在动物生产应用上也得到良好效果。除p40外,LGG的另一种分泌蛋白p75的具体作用机制尚不清楚,还有待进一步研究。目前对益菌蛋白p40、p75及有效成分SLP、EPS的研究主要集中在细胞水平,在动物上的应用还有待进一步研究。LGG在实际生产中的最佳菌株、使用剂量、使用时间等还有待深入研究。总之,LGG在动物生产中所展现出的良好效果,尤其当动物受到有害物质刺激时起的保护作用,表明LGG未来能作为一种良好的替抗微生态制剂应用在畜牧养殖上。
