腐殖酸钠对稻虾养殖环境中水质和浮游生物的短期影响
2021-11-05葛玲瑞刘科均贾伟华谢仲桂
葛玲瑞,向 劲,刘科均,贾伟华,谢仲桂*
(1.湖南生物机电职业技术学院动物科技学院,长沙 410127;2.湖南省水产科学研究所,长沙 410153)
稻虾综合种养多指在稻田中养殖克氏原螯虾(Procambarus clarkii),是在传统稻田渔业基础上逐步发展起来的一种现代化养殖新模式,因其具备卓越的经济、生态与社会效益,产业规模在近些年得到飞速发展。截至2019年,全国稻田养虾总面积已达1 858万亩,并保持持续增长态势[1]。克氏原螯虾的繁殖及养殖生产受理化环境的较大影响,也与水生生物环境关系密切[2-4]。这一结论在稻-虾综合种养模式中同样被试验证实[5]。在更多克氏原螯虾的稻田养殖生态学研究中,丝状绿藻的分布、天然饵料丰度等浮游动、植物群落的生态特征对克氏原螯虾的生长有着重要影响[6-7]。
每年春季,稻虾养殖水体中常表现水质过瘦、青苔(丝状绿藻)过密、虾苗的天然饵料较少等问题[8-10]。腐殖酸钠(sodium humate)由于具备净水、肥底、抑菌和遮光等较多优点,被广泛应用于稻虾综合种养的前期生产中,但目前鲜见围绕腐殖酸钠调控虾沟水质作用过程的研究报道。本试验监测分析虾沟中施用腐殖酸钠后的水体理化指标及浮游动植物群落结构的短期变化,以期探究腐殖酸钠调水机制,为稻虾综合种养模式的水质管理提供科学依据。
1 材料和方法
1.1 试验场地
试验于2020年3月在湖南省湘潭县排头岭村稻虾养殖基地内(113°08′E,28°18′N)开展,选择一片10 hm2的封闭“回”形稻虾池塘,预先以土堆将稻虾试验池塘内、外沟分别阻断并铺隔膜夯实,内、外沟水深分别为0.6 m、1.15 m。如图1所示,在基地东侧的内沟和外沟分别设腐殖酸钠组采样点“HI(Humic acid sodium sites of Inside)”及“HO(Humic acid sodium sites of Onside)”,在西侧内沟、外沟设对照组“CI(Control sites of Inside)”及“CO(Control sites of Onside)”。
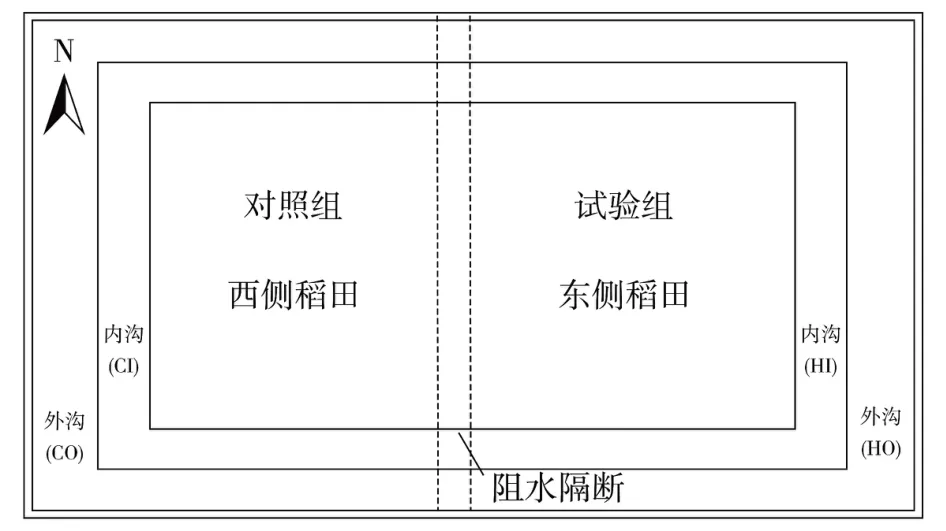
图1 虾沟采样区域划分Figure 1 Distribution of shrimp gully sampling area
1.2 试验方法
在腐殖酸钠处理组(HI及HO),一次性兑水泼洒腐殖酸钠至15 g/m3;对照组不施用腐殖酸钠,其余生产管理与腐殖酸钠处理组均保持一致。
1.3 试验采样
本试验在克氏原鳌虾的春苗培育期(3月13日~3月27日)开展,共采集3批水样,采样时间分别为:3月13日(试验前,记为 0 d)、3月 20日(试验中期,记为7 d)和3月27日(试验后期,记为14 d),腐殖酸钠处理组施用腐殖酸钠的时间为3月13日第一次水样采集之后。各样点的水样分别为虾沟中间及两端的混合水样,每批水样平行采集2次。
1.4 理化指标测量方法
水质理化数据中,现场测定水温、溶氧、pH(美国哈希HQ40d便携式水质分析仪)及透明度(塞氏盘),总氮(TN)和总磷(TP)为固定水样后,带回实验室按地表水环境质量标准(GB3838-2002)[11]中相关进行测定。
1.5 浮游生物统计方法
浮游植物的采样与处理按照《内陆水域渔业自然资源调查手册》[12]进行,种类鉴别参照《中国淡水藻类》[13];浮游动物的采样与处理按照《内陆水域渔业自然资源调查手册》《淡水浮游生物研究方法》[14]进行,种类鉴别参照《中国动物志——原生动物门》[15]、《中国动物志——淡水枝角类》[16]、《中国动物志——淡水桡足类》[17]、《中国淡水轮虫志》[18]等;优势种计算办法参照《SL733-2016内陆水域浮游植物监测技术规程》[19]进行。
1.6 数据处理方法
试验数据经Excel 2016整理后进行图表制作,运用SPSS 25.0软件对腐殖酸钠组与对照组的数据差异进行显著性检验,并对各采样点浮游动植物密度及环境变量进行冗余分析(RDA)。
2 结果与分析
2.1 理化指标变化
试验期间稻田水温范围为14.4~18.2℃,其中前7 d水温增长较快,累计升温3.1℃,后7 d天气多变,昼夜温差大,水温累计升温0.7℃。除水温外,实验组与对照组的其他环境因子变化主要采用内沟仅与内沟对比,外沟仅与外沟对比的形式进行差异分析。水体溶氧整体较稳定,始终维持在较高水平,变化范围为 5.93~7.78 mg/L(图2a),第 7 天时,实验组内沟(HI)显著低于对照组内沟(CI)(P<0.05),至试验结束时,各点恢复到接近水平;水体pH 范围为 7.79~8.46(图2b),第 7 天时,实验组内沟(HI)已开始低于对照组内沟(CI),第 14 天时已达到显著差异(P<0.05);透明度在内外沟呈现出不同水平(图2c),内沟(HI和 CI)中透明度变化范围为31~38 cm,外沟(HO和CO)平均值相对较低,变化范围为28~33 cm。试验第7日时,实验组内沟极显著低于对照组内沟(P<0.01),第14日时恢复到无显著差异;水体总氮变化范围为0.84~1.21 mg/L,在试验组与对照组间未出现显著差异(图2d),但试验开始前,总氮在内沟相对较高,至试验结束时,内沟总氮则低于外沟;总磷含量在内、外沟之间无明显差异,变化范围为 0.16~0.29 mg/L(图2e),实验组整体低于对照组,至第14天时,实验组外沟低于对照组外沟且表现出显著性差异(P<0.05)。
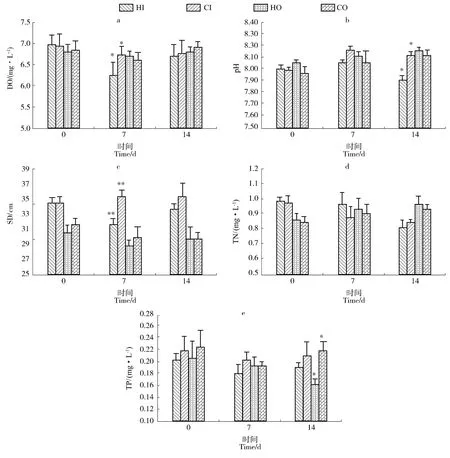
图2 各采样点在不同阶段的DO、pH、SD、TN和TP的变化Figure 2 Changes of DO,pH,SD,TN and TP at different sampling points at different stages
2.1 浮游植物群落变化
2.1.1 种类分布及优势种
通过对虾沟水样进行监测,共检测到浮游植物45属(种),隶属于6个门,分别为绿藻门、硅藻门、蓝藻门、隐藻门、裸藻门和金藻门(表1)。绿藻门种类数占绝对优势,共29种,占比64%;其次为硅藻门,5种,占比11%;裸藻门4种,占比9%;隐藻门和蓝藻门均为3种,各占比7%;金藻门仅1种,占比2%。各监测水体中,优势度最高为普林鞘藻(Oedogonium pringsheimii)和双星藻(Zygnema agardh)。

表1 浮游植物种类及占比Table 1 Species composition and distribution of phytoplankton
对试验前、中和后3次采样结果进行种类数比较(图3),结果显示,内沟(HI和 CI)整体种类数在各时期均稍高于外沟(HO和CO),而实验组与对照组各时期的种类数无明显差异。对各采样位置按时间变化独立比较,发现在试验期间各点的浮游植物种类数均有小幅上涨。
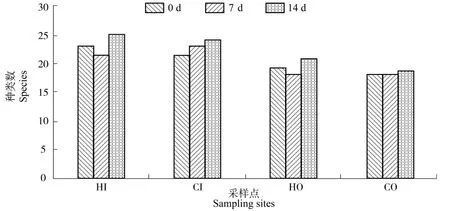
图3 各点浮游植物种类数变化Figure 3 Changes of phytoplankton species at each point
2.1.2 群落总密度及丝状绿藻占比
浮游植物密度是反映水生态状况的重要指标之一(图4)。内沟中密度最大值与最小值均出现在实验组(HI),最大值 2.1×105cells/L,为该点试验后期检出,最小值1.3×105cells/L为该点试验中期检出;外沟中密度最大值与最小值也均出现在实验组(HO),最大值9.2×103cells/L,为该点试验后期检出,最小值3.4×103cells/L,为该点试验中期检出。将实验组与对照组进行比较,实验组(HI及HO)的藻类总量均呈现出先降后增的趋势,对照组外沟基本稳定,内沟则持续增长,实验组与对照组对应采样点的密度变化无显著差异(P>0.05)。
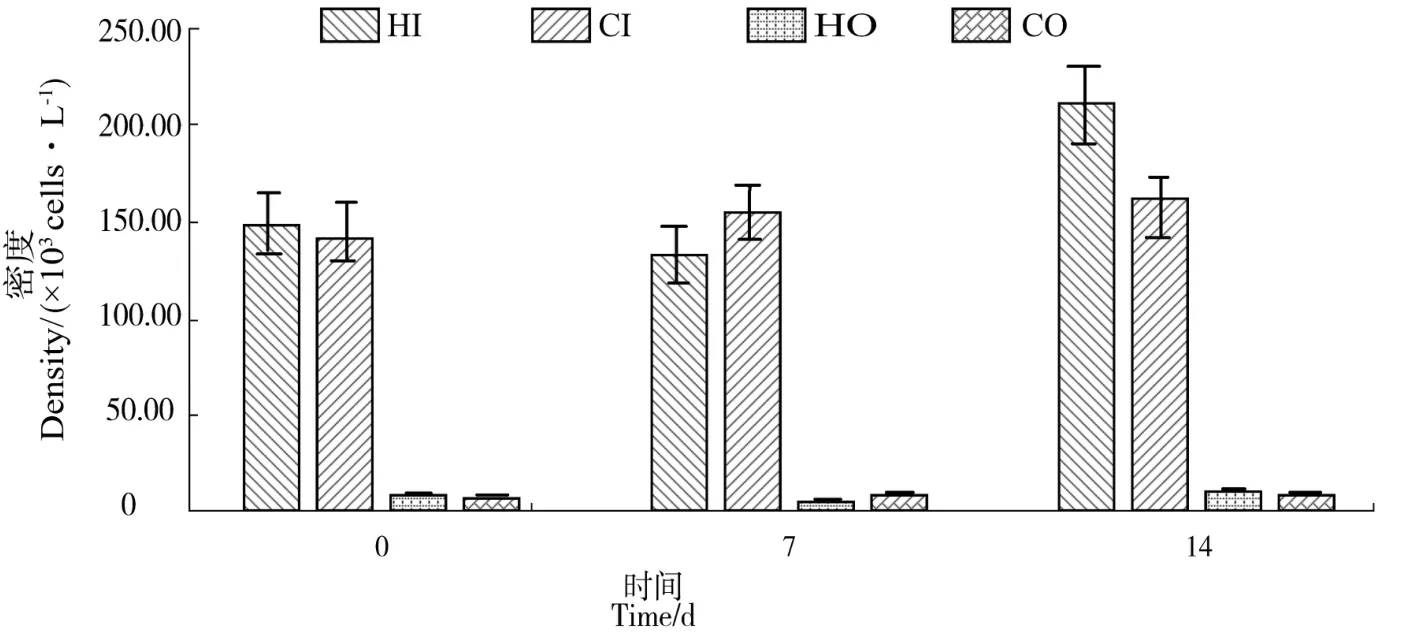
图4 浮游植物密度时空分布Figure 4 Distribution of phytoplankton density
种类分布上(表1),绿藻门种类数占据较大优势(占比64%),现将各采样点藻类密度及各门所占百分比列出,绿藻门的优势度呈现得更加明显(图5),内沟(HI和CI)中绿藻门密度甚至超过了浮游植物的95%以上,外沟(HO和CO)的绿藻门比例稍低,且表现出逐步降低的趋势,试验后期低至75%以下。实验组与对照组的绿藻门密度占比变化未见显著差异。
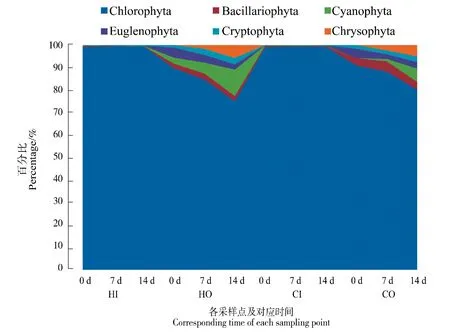
图5 各采样点浮游植物各门的密度分布Figure 5 Density distribution of phytoplankton phylum
水产养殖生产中,绿藻门的水绵、刚毛藻、双星藻、转板藻、水网藻和鞘藻等统称为丝状绿藻(即“青苔”),当其密度过大时,易对幼虾造成较大影响[20]。将各采样点的丝状绿藻细胞密度与其他藻类总量所占比例,以试验前中后期分别列出(图6),可见丝状绿藻数量在整个养殖水体的藻类中占比超过50%。由于图4显示外沟中藻类密度相对较少且较稳定,现主要对内沟中青苔占比变化进行分析。内沟中,青苔占比最高达75.6%,为实验组(HI)前期检出,密度为1.12×105cells/L;占比最低值同样出现在实验组(HI),为试验后期检出,细胞密度为 7.8×104cells/L,占比仅37.4%,相对于前期下降近40%。与此相反,对照组内沟水体(CI)中的青苔数量及占比在试验后期均出现小幅增长,占比增长近5%。
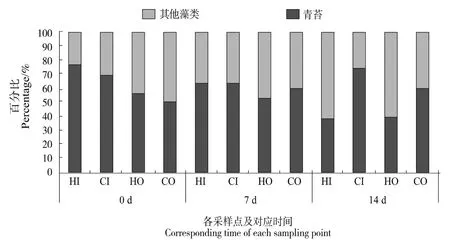
图6 丝状绿藻(青苔)与其他藻类数量变化Figure 6 Changes in the number of filamentous green algae and other algae
2.2 浮游动物群落变化
2.2.1 种类分布及优势种
如表2所示,试验中共检测到浮游动物28种。原生动物最多,共计12种,占浮游动物种类数43%;轮虫类8种,占比29%;枝角类6种,占比21%;桡足类最少,仅2种,占比7%。对各采样点分别比较,实验组内沟(HI)为20种,对照组内沟(CI)21种,差距较小;实验组外沟(HO)与对照组外沟(CO)无差距,均为16种。内沟种类数大于外沟,但东西两侧之间无明显差异。以采样时间进行种类数的比较,试验前观察到浮游动物16种,中期17种,后期共观察到19种,略有增加。整个虾沟水体中,优势种为月形刺胞虫(Acanthocystis erinaceus)和无节幼体(Nauplius)。

表2 浮游动物种类及占比Table 2 Species composition and distribution of zooplankton
2.2.2 群落及其中大中型浮游动物生物量变化
各采样点不同时期的浮游动物生物量变化如图7,最小值出现在前期(0 d)的实验组内沟(HI),为3.61 mg/L;最大值出现在后期(14 d)的对照组外沟(CO),为7.11 mg/L。试验结束时,实验组浮游动物生物量小幅增长,对照组无明显变化,但两组之间未表现出显著差异(P>0.05)。
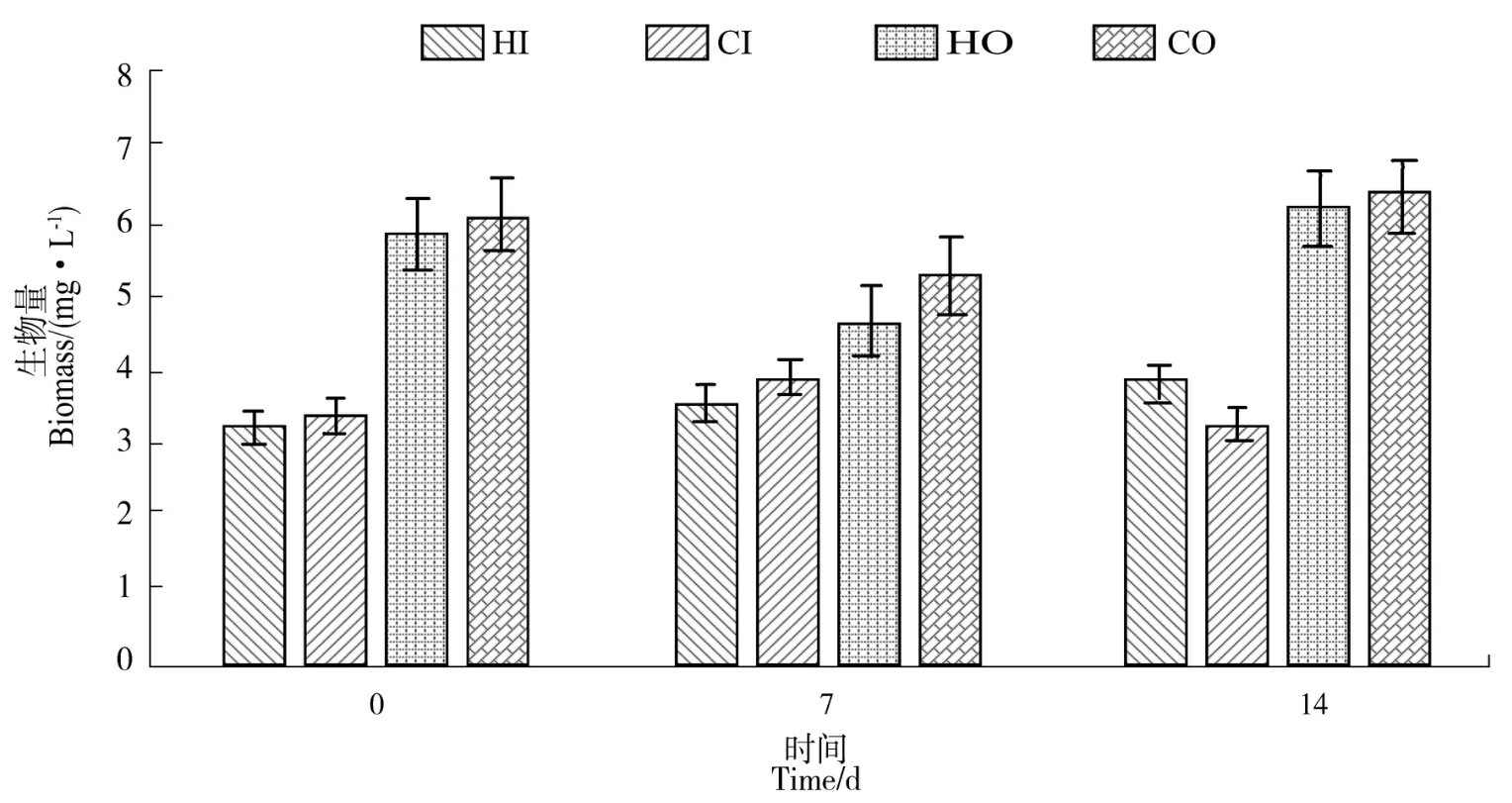
图7 浮游动物生物量时空分布Figure 7 Distribution of zooplankton biomass at different points and periods
由于轮虫、枝角类和桡足类等大、中型浮游动物作为优质动物蛋白源,是虾苗的重要天然饵料[21-24]。如图8所示,现将各水体中浮游动物生物总量与大中型浮游动物生物量(轮虫、枝角类与桡足类生物量之和)变化分别进行比较。发现虾沟中的浮游动物生物量主要由大中型浮游动物尤其是枝角类所贡献,总占比超过80%,且各采样点的占比均较稳定。按照各时期,对各点的总生物量与大中型浮游动物生物量进行Pearson相关分析,检验结果为,在试验开始时,东西两侧水体呈极显著相关(P<0.01),试验结束时两侧水体相关性略微下降,仍为显著相关关系(P<0.05)。显示出腐殖酸钠对虾沟水体中的浮游动物生物量变化有少量影响。
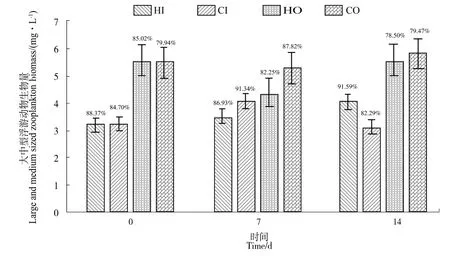
图8 大中型浮游动物生物量变化及占比Figure 8 The proportion of large and medium-sized zooplankton
2.3 浮游动植物群落与环境因子关系
用Canoco软件将各采样点的环境因子与浮游动植物群落变化进行检验,第一轴特征值小于3,因此选用冗余分析法(RDA)基于浮游动植物密度进行研究。分析结果中,方差解释率为68.0%,第一轴与第二轴的累计贡献率为89.37%,这说明前两轴能较好地反映浮游生物密度与环境因子之间的相互关系。在RDA三元图中(图9),浮游生物密度、环境因子及采样点分别由以下代码表示:采样点HI1、HI2、HI3 为实验组内沟,CI1、CI2、CI3 为对照组内沟,HO1、HO2、HO3 为实验组外沟,CO1、CO2、CO3为对照组外沟;环境变量WT为水温,DO为溶氧值,PH为酸碱度,SD为水体透明度,TN为总氮,TP为总磷;浮游生物中,Chl为绿藻门,Bac为硅藻门,Cya为蓝藻门,Eug为裸藻门,Cry为隐藻门,Prot为原生动物,Rot为轮虫类,Cla为枝角类,Cop为桡足类,Alga示浮游植物总量,Moss示丝状绿藻(青苔)总量,Zoop示浮游动物总量。
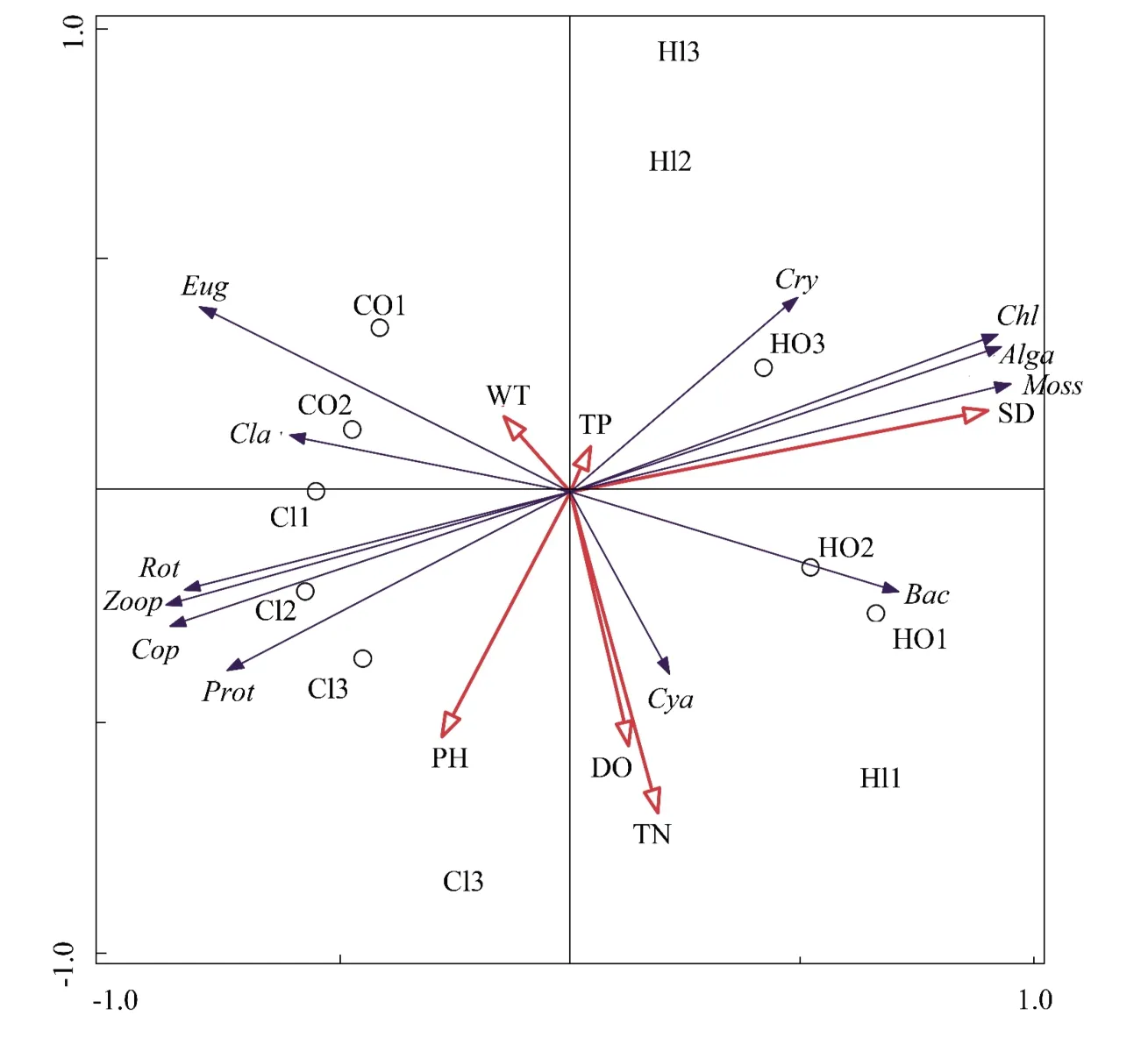
图9 稻田虾沟水体中浮游生物密度、环境变量及采样点的冗余分析(RDA)三元图Figure 9 Redundancy analysis(RDA)triplot(plankton density,environmental variables and sampling sites)in sampling water
在RDA排序图中,除透明度外,绝大多数环境因子与第二排序轴相关性较高,而绝大多数浮游生物类群密度变化(蓝藻门除外)与第一排序轴相关性较高。各浮游生物类群密度变化与环境因子的相关性差异上,裸藻门、蓝藻门和隐藻门与水温相关性较高,当水温升高时裸藻门随之增多。绿藻门、丝状绿藻总量以及浮游植物总量与透明度呈高度正相关关系,原生动物、轮虫类、桡足类及浮游动物总量则与透明度呈高度负相关关系。
3 讨论
溶氧、pH、透明度、总氮及总磷等是反映养殖水体水质的重要理化因子,当理化因子发生变化,浮游生物群落随之改变[25]。郭杰、王珂等[26]在分析长江荆江段浮游生物群落结构特征时,发现溶氧、温度和氨氮是影响浮游生物群落结构的主要因素。因此,水体理化因子是反映养殖水体水质最重要的本底数据。本研究中,腐殖酸钠在短期内(7 d时)显著降低了虾沟水体中的溶氧与透明度,当试验结束时,该差异已缩小至无显著性。对pH的影响则相对更加持久,实验组pH在试验中期小幅度低于对照组,当试验结束时,实验组pH仍然低于对照组且表现出显著性差异。腐殖酸钠对水体总氮、总磷也表现出降低作用,造成这种现象的主要原因可能是腐殖酸钠通过短期影响水体透明度、pH等,间接导致总氮及总磷在水体中的生物利用、沉降等效率发生变化。张茜、冯民权等[27]对上覆水环境条件影响底泥氮磷释放的研究中,发现pH与底泥释放至水环境中的总氮、总磷含量成正比,特别是在总磷的环境影响因子中排首位。这一结论与本研究结果完全吻合,即pH降低,水体中总氮随之小幅度降低,对总磷的降低效果相对更加明显。
目前,腐殖酸钠在水产养殖中的应用大多是基于其降低水体光照度这一物理特性。张海春[28]通过0.9 m深的水柱试验,证实了可获得平均光照度更有可能作为藻类光限制条件出现和消失的重要标志。严广寒[29]、贡丹丹等[30]分别进行光照培藻试验,证明了光照是影响浮游植物数量与群落多样性的关键要素,在一定范围内,浮游植物数量随着光照强度的增加而增加。本试验开展期间,实验组与对照组的浮游植物种类数变化呈现出一定差异(图3)。实验组(HI和HO)在试验前中期均出现小幅减少,后期再增多;对照组(CI和CO)在前中期处于稳定或增长状态,后期也有小幅增多。密度变化与种类数变化方向完全一致,实验组先降后增,藻类种类数与密度低谷均出现在试验中期(7 d),而对照组的藻类密度保持稳定或持续增长。孙杨才通过在浮游植物密度较高的池塘中进行试验,发现遮光7 d后水体叶绿素a仅剩12.1%,即遮光能达到有效控藻的目的[31]。本试验中,腐殖酸钠在短时期内(7 d)明显降低虾沟中的浮游植物生长,但周期超过一周后,抑制效果逐渐消失。这一变化趋势与前面所述水体透明度在第七天时受影响较大相吻合,即降低透明度是腐殖酸钠对浮游植物群落产生影响的重要方式。本试验结束时,实验组与对照组整体的浮游植物种类数和密度与前期相比均有增长,应该为春季水温逐步升高的原因。
丝状绿藻(青苔)是稻田、池塘等小水体中较为常见的藻类,其大量发生时,争夺水体中的养分、影响透明度、降低水温、污染水质、缠绕养殖对象,对水稻种植和淡水养殖的危害极大[32]。尽管在营养盐竞争方面,其它浮游藻类显著优于丝状绿藻[33],但是当大量丝状绿藻对透明度产生影响时,丝状绿藻对光能的竞争优势则尤其明显[34]。徐奎等[35]在研究中发现,绿藻比蓝藻的低光照耐受度更低。由于稻虾综合生态种养模式不可能采取顶棚封闭的形式进行遮光,则只能人为降低水体透明度,以达到限制丝状绿藻的目的。从丝状绿藻的密度及占比角度分析,本研究中实验组中丝状绿藻持续大幅下降,而对照组整体呈增长趋势,这一结果与徐奎[35]的研究结论一致,丝状绿藻的低光耐受度低于藻类平均值,且由内外沟差异看出,水体中丝状绿藻基数越大,腐殖酸钠的抑制效果越显著。
王利等[36-37]通过分析不同遮光梯度对浮游甲壳动物群落的影响,监测到浮游甲壳动物的生物量、丰度及多样性均随着光照强度减弱而减少。光照除了直接影响浮游动物的摄食,还能通过影响环境间接影响其群落结构。但是本研究的采样结果显示遮光未对浮游动物群落结构产生明显影响,各采样点的浮游动物种类数及生物量占比均较稳定(附表1)。试验开始时,实验组与对照组的浮游动物为极显著相关(P<0.01),试验结束时,此相关性降为显著相关(P<0.05),仅产生了少量影响,实验组与对照组的大、中型浮游动物也未表现出显著性差异。推测不同试验中遮光率差异较大是导致造成这一研究结果差异的主要原因,在王利等[36]的试验中,4组遮光梯度的透光率分别为2.8%、7.1%、17.1%及40.5%,远大于本研究中实验组与对照组的水体透明度差异。因此,腐殖酸钠对虾沟中浮游动物群落及大、中型浮游动物(虾苗饵料生物)密度未产生显著影响。
RDA分析结果中,浮游动物与多数浮游植物密度表现出负相关关系,可见在虾沟类小型养殖水体中,浮游动物对浮游植物的饵料依赖度较低。在RDA三元图中各采样点的样方分布呈现出明显规律,实验组(HI与HO)与对照组(CI与CO)分别分布于轴2两侧,实验组集中于二、三象限,而对照组集中于一、四象限,表现出两组水体之间的环境因子及浮游生物群落均发生了明显的分化现象。
4 结论
腐殖酸钠能明显改变稻田虾沟中水环境因子和浮游植物群落,表现为在短时期内(7 d)能显著降低水体中溶氧及透明度,影响浮游植物生长,第14天时抑制效果逐步减少,但降低pH的持续时间相对较长。腐殖酸钠对浮游动物群落分布及大、中型浮游动物的生长无明显影响。在稻虾生产中,适量使用腐殖酸钠,可持续抑制丝状绿藻(青苔)的生长,且基数越大,抑制效果越显著。
