miR-145通过调控PDCD4表达抑制缺氧/复氧所诱导的心肌细胞凋亡
2021-11-05张朝华刘旭帮朱银川汤建民
张朝华,刘旭帮,朱银川,汤建民
急性心肌梗死(AMI)是临床上常见的急性重症疾病。随着人们生活节奏加快、饮食结构改变以及人口老龄化的影响,AMI的发病率呈逐年升高趋势,现已高达45~55/10万[1,2]。AMI患者常诱发心肌缺血再灌注(MIRI),引起心肌细胞凋亡,心肌细胞凋亡是导致AMI患者并发慢性心力衰竭,且死亡的主要原因[3,4]。
miRNA是长度约22个核苷酸的非编码单链RNA分子,其可通过与mRNA的3'互补结合而调控相关基因的表达,在细胞增殖、分化和蛋白表达上发挥重要的调控作用[5,6]。目前,越来越多研究表明,miRNA不仅作为诊断AMI的生物标志物[7],且参与调控心肌缺血再灌注引起心肌细胞凋亡,是治疗心肌缺血再灌注的潜在靶点[8]。此外研究表明,miR-145不仅被发现在急性冠脉综合征患者的血浆中低表达[9],且在急性心肌梗死大鼠心肌组织中低表达[10]。然而,miR-145表达对心肌缺血再灌注引起的心肌细胞损伤的影响还未知。本研究建立缺氧复氧(H/R)诱导的H9c2细胞体外模型以模拟心肌缺血再灌注引起的心肌细胞损伤,不仅研究了miR-145表达对H/R诱导的心肌细胞凋亡的影响,还初步探讨了其内在的分子机制。
1 材料与方法
1.1 实验试剂RNAiso plus和PrimeScript RT reagent Kit with gDNA Eraser购买自日本TARAKA公司;胎牛血清、DMEM高糖培养基、transwell小室、Lipofectamine™ 2000转染试剂均购买自美国ThermoFisher SCIENTIFIC公司;双荧光素酶报告基因检测试剂盒购买自中国碧云天生物技术有限公司;GoTaq® qPCR Master Mix购买自中国Promega公司;qPCR引物、miRNA及程序性细胞死亡因子4(PDCD4)序列均由生工生物工程(上海)股份有限公司合成;pcDNA3.1质粒购买自中国云周生物科技有限公司。
1.2 细胞培养与转染H9c2细胞培养在添加10%胎牛血清的DMEM高糖培养基中,培养条件是37℃和5% CO2。在6孔板中接种1×106H9c2细胞;24 h后,按照Lipofectamine™ 2000转染试剂盒说明书所示的转染步骤将miR-145-NC(5'-CUGCACG GAAGGGACUCUAUGGGA-3')、miR-145-mimic(5'-GUCCAGUUUUCCCAGGAAUCCCU-3')、pcDNA质粒和pcDNA-PDCD4重组质粒分别转入H9c2细胞内。转染6 h后,更换细胞培养基,将细胞继续培养到37℃和5% CO2条件下以用于后续实验。
1.3 缺氧/复氧模型将H9c2细胞接种在6孔板内,12 h后将细胞放到缺氧(95%N2和5%CO2)培养箱中在37℃下培养12 h,更换培养基后,将细胞转移到正常氧气环境(空气+5%CO2)二氧化碳培养箱中培养继续培养4 h。
1.4 实时荧光定量PCR在细胞直接加入适量的RNAiso以提取RNA。根据提取RNA的含量加入ddH2O溶解RNA。根据PrimeScript RT reagent Kit with gDNA Eraser试剂盒说明书将提取的RNA反转录成cDNA。PCR参数:37℃/60 min,85℃/5 s。RT-qPCR:根据GoTaq® qPCR Master Mix试剂盒说明书制备20 μl RT-qPCR系统,使用ABI 7500荧光定量PCR仪器进行扩增。PCR参数设定:95℃/30 s,[90℃/5 s,65℃/30 s]-40个循环。以β-actin作为mRNA的内参,以U6作为miRNA的内参。用2-△t△t法计算目的基因的相对表达量。qPCR所用到的引物如下:miR-145-F: 5'-C CTTGTCCTCACGGTCCAGT-3', miR-145-R: 5'- A ACCATGACCTCAAGAACAGTATTT-3'; PDCD4-F: 5'- GGGAGTGACGCCCTTAGAAG-3', PDCD4-R: 5'- ACCTTTCTTTGGTAGTCCCCTT-3'; U6-F: 5'- AUAAAUCCCUUUACACCUCTT-3', U6-R: 5'-AA UAAAUCCCUUUACACCUCTT-3'; β-actin-F: 5'- AGCCCATCCTTCGAGTACAAA-3', β-actin-R: 5'-TCTTGGTGCGATAACTGGTGG-3'.
1.5 蛋白表达检测使用RIPA裂解液(R0010,Solarbio,中国)从细胞中提取总蛋白,检测总蛋白质的浓度。在90 V恒定电压下,通过10%SDSPAGE分离50 μg总蛋白。将蛋白从SDS-PAGE凝胶转移到PVDF膜上,5%脱脂牛奶室温封闭1 h。用PBS缓冲溶液洗涤膜3遍后,将膜与PDCD4抗体在4℃孵育过夜。室温下添加二抗孵育2 h。用磷酸盐缓冲液-洗涤3次后,加入ECL溶液进行检测。
1.6 细胞凋亡检测收集经不同方式处理的H9c2细胞,预冷的PBS缓冲溶液洗涤2遍,然后按1~5×105个细胞加入100 μl 1×Binding buffer重悬,加入5 μl Annexin V-FITC和10 μl PI染色液,室温避光孵育10~15 min,加入400μl 1×Binding buffer后上机检测细胞凋亡。
1.7 荧光素酶基因报告检测通过PCR技术扩增含有miR-145的3'-UTR的PDCD4结合序列,将野生型(WT)或突变型(MUT)的基因序列克隆到pmirGLO质粒上以获得pmirGLO- PDCD4 WT/MUT,使用Lipofectamine™ 2000转染试剂将重组质粒与miR-145-NC或miR-145-mimic一起转入H9c2细胞中。48 h后,根据双荧光素酶报告基因试剂盒说明所述步骤检测荧光素酶活性。
1.8 统计学分析方法研究数据通过Graphpad Prism 5(Graphpad Prism,美国)行数据统计学分析和绘制图表。两组将通过Student's t检验比较差异,P<0.05为差异具有统计学意义。
2 结果
2.1 缺氧/复氧对H9c2细胞miR-145和PDCD4表达的影响如图1所示,与对照组相比,经H/R处理后的H9c2细胞miR-145表达显著降低,而PDCD4 mRNA和蛋白表达均显著升高(图1),差异有显著统计学意义(P<0.001)。
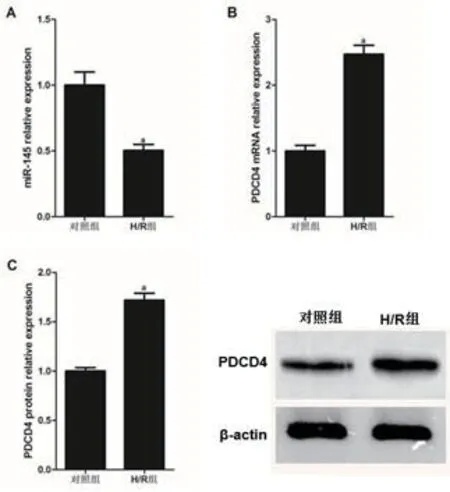
图1 H/R抑制miR-145表达而促进PDCD4表达
2.2 上调miR-145抑制缺氧/复氧诱导的H9c2细胞的凋亡通过向H9c2细胞中转如miR-145-mimic以上调miR-145的表达。如图2所示,经H/R处理后,与转入miR-145-NC的H9c2细胞相比,转入miR-145-mimic的H9c2细胞中miR-145表达显著升高,且凋亡的H9c2细胞比例显著降低(图2),差异有统计学意义(P<0.001)。

图2 上调miR-145表达抑制H/R诱导的H9c2细胞凋亡
2.3 miR-145靶向抑制H9c2细胞中PDCD4表达如图3所示,miR-145与PDCD4基因存在互补序列。荧光素酶基因系统检测显示,miR-145-mimic可显著抑制WT-PDCD4组的荧光酶活性,而不影响MUT-PDCD4组荧光素酶活性,且miR-145-mimic显著抑制H9c2细胞中PDCD4蛋白的表达(图3),差异有统计学意义(P<0.001)。
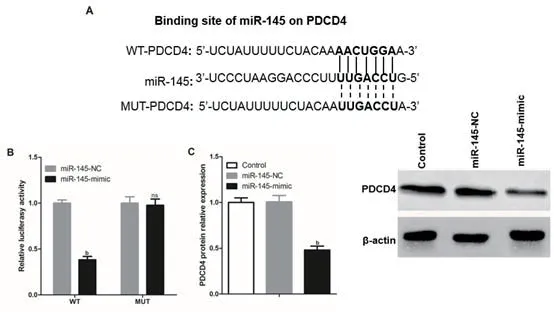
图3 PDCD4是miR-145的靶基因
2.4 上调PDCD4促进缺氧/复氧诱导的H9c2细胞的凋亡通过向H9c2细胞中转入pcDNA-PDCD4以上调PDCD4的表达。如图4所示,经H/R处理后,与转入空载pcDNA质粒的H9c2细胞相比,转入pcDNA-PDCD4重组质粒的H9c2细胞中PDCD4蛋白表达显著升高,且凋亡的H9c2细胞比例显著升高(图4),差异有统计学意义(P<0.001)。

图4 上调PDCD4表达促进H/R诱导的H9c2细胞凋亡
3 讨论
近年来心血管疾病的发病率居高不下,占全球死因首位,其中AMI不仅是所有心血管疾病中发病率最高的疾病,且死亡率极高[11,12]。近年来经皮冠状动脉介入治疗(PCI)的广泛应用降低了AMI患者的死亡率,但部分患者术后不可避免的发生心力衰竭,经研究与心肌缺血再灌注引起的心肌细胞凋亡有关[13,14]。进一步深入研究心肌梗死PCI术后心肌细胞凋亡的分子机制,准确评估AMI患者PCI术后心力衰竭的严重程度,不仅可为AMI患者PCI术后临床治疗提高理论依据,且有助于延缓心肌梗死后心力衰竭的疾病进展。
microRNA是近年来新发现的一种对哺乳动物细胞内基因转录翻译进行调控的非编码小RNA,尽管其并不直接编码蛋白质,但却通过对靶基因转录和翻译的调控的间接参与哺乳动物细胞的分化、增殖、转移及凋亡[15,16]。本研究发现,miR-145经H/R处理的心肌细胞内表达降低,而上调miR-145的表达可抑制H/R诱导的心肌细胞凋亡,提示我们miR-145是H/R诱导的心肌细胞凋亡的抵抗基因。miR-145位于人染色体5q23.5位置上,之前关于miR-145的研究主要集中在癌症中,miR-145已被发现在多种恶性肿瘤组织中低表达,并发挥抑癌基因的作用,如miR-145在膀胱癌中充当肿瘤抑制因子的作用而直接调节FSCN1的表达[17];miR-145在乳腺癌组织中低表达,并与淋巴结转移、肿瘤分期以及肿瘤大小有关[18]。而近期研究发现,miR-145不仅被发现在急性冠脉综合征患者的血浆中低表达[9],且在急性心肌梗死大鼠心肌组织中低表达[10]。在AMI大鼠模型中miR-145的表达水平与心肌组织中心肌细胞的凋亡有关,上调miR-145可抑制心肌梗死大鼠心肌组织中心肌细胞的凋亡[10]。结合研究结果表明,miR-145抑制H/R诱导的心肌细胞凋亡。
进一步研究miR-145抑制H/R诱导的心肌细胞凋亡的分子机制,通过生物学信息网站(www.targetscan.org)对miR-145靶基因进行预测,选择程序性细胞死亡因子4(PDCD4)与细胞凋亡密切相关的分子进行研究。研究发现,H/R诱导PDCD4基因表达升高,且miR-145靶向抑制心肌细胞中PDCD4蛋白的表达。上调PDCD4上调H/R诱导的心肌细胞凋亡。之前研究表明[19],CRP基因沉默可通过上调miR-21表达而抑制PDCD4蛋白表达,增强心肌细胞H9c2的活力。梁丽英等[20]研究发现,miR-21可通过靶向抑制PDCD4的表达减轻大鼠心肌细胞损伤。闫旭等[21]研究指出,人参皂苷Rb1通过上调miR-21表达而抑制PDCD4蛋白的表达,进而抑制H/R诱导的心肌细胞凋亡。表明PDCD4不仅参与心肌细胞损伤的调控,且可作为药物靶点保护H/R诱导的心肌细胞凋亡。
综上所述,缺氧/复氧通过抑制miR-145的表达和促进PDCD4蛋白表达而诱导心肌细胞的凋亡,而上调miR-145可通过抑制PDCD4蛋白的表达而抑制缺氧/复氧所诱导的心肌细胞凋亡。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
