结核病患者N-乙酰基转移酶2编码基因多态性检测与异烟肼合理用药专家共识
2021-11-05首都医科大学附属北京胸科医院中国防痨杂志编辑委员会
首都医科大学附属北京胸科医院 《中国防痨杂志》编辑委员会
异烟肼(INH)作为一线抗结核药物中单一杀菌力最强的药物,是非异烟肼耐药结核病治疗标准方案中的首选。异烟肼在体内存在不同的代谢通路,其中最重要的通路是在N-乙酰基转移酶2(N-acetyltransferase-2,NAT2)的作用下将其乙酰化为乙酰异烟肼。大量研究显示,NAT2的编码基因的基因多态性对于异烟肼的代谢速度有重要影响,由此导致服用标准剂量(5 mg/kg)异烟肼治疗的患者的血药浓度呈现明显差异(3~7倍)[1-6]。而依据NAT2基因多态性,可将人群分为三种类型:快乙酰化型、中间乙酰化型和慢乙酰化型。2015年国家卫生和计划生育委员会颁布的《药物代谢酶和药物作用靶点基因检测技术指南(试行)》中明确推荐开展NAT2基因多态性检测项目,以指导异烟肼的个体化用药剂量选择。美国食品药品监督管理局也已将NAT2列为指导异烟肼个体化用药的检测指标。2017年,韩国发布的临床用药基因检测指南中明确指出,在使用异烟肼进行抗结核治疗时,应进行NAT2基因型检测。尽管国内外指南均推荐进行NAT2基因型检测以指导异烟肼的个体化用药,但鉴于多种原因,临床实践中NAT2基因检测率并不高,尚无NAT2基因多态性检测相关的技术规范,也缺乏依据患者乙酰化类型调整异烟肼个体化用药剂量的共识,影响了根据NAT2基因型差异调整异烟肼用量的个体化治疗策略的实施。为规范中国结核病患者NAT2基因型检测流程、科学合理地依据NAT2基因型检测结果指导异烟肼用药剂量的合理选择,首都医科大学附属北京胸科医院和《中国防痨杂志》编辑委员会共同组织结核病治疗领域和药理学领域的知名专家,结合现有指南及公开发表的专业文献,经充分讨论,形成本共识。
一、NAT2基因检测的临床意义
(一)NAT2基因多态性
NAT2基因定位于人类8号染色体8p22,编码区全长820 bp,共编码290个氨基酸。研究证实,NAT2基因多态性对NAT2酶的表达、稳定性,以及催化活性有重要影响。截至2016年4月18日,人类NAT2等位基因数据库已报道了50个多态性位点(http://nat.mbg.duth.gr/Human%20NAT2% 20alleles_2013.htm),可组成上百种NAT2等位基因型,并列举了每种等位基因所属的表型(快型或慢型)。NAT2基因主要存在7个常见的单核苷酸多态性位点,分别是191G→A、282C→T、341T→C、481C→T、590G→A、803G→A、857G→A[2],可组成27个以上的等位基因型,其中,*4型为野生型,为正常的快代谢等位基因。191G→A为等位基因*14 各亚型共有位点,属慢型等位基因,该位点突变在非洲人群中的频率较高,而在亚洲人群中几乎为零(数据来源:NCBI dbSNP数据库,rs1801279);341T→C为等位基因*5各亚型共有位点,属慢型等位基因;590G→A为等位基因*6各亚型共有位点,属慢型等位基因;857G→A为等位基因*7各亚型共有位点,属慢型等位基因。据文献报道,等位基因*5、*6、*7可解释东方人群和高加索人群中98%以上的慢乙酰化代谢,*5、*6、*7在中国人群中的等位基因频率分别为3.3%、21.2%、11.7%[3]。282位点通常与590或857位点联合突变,分别形成等位基因*6A和*7B;341、481、803位点联合突变形成等位基因*5B。*5B、*6A、*7B 为最常见的NAT2等位基因亚型(*5B为*5的亚型,*6A为*6的亚型,*7B为*7的亚型),占所有突变的90%以上。由于341T→C为*5共有,590G→A为*6共有,857G→A为*7共有,而*5B、*6A、*7B是最常见的突变亚型等位基因,且341T→C与481C→T联合突变形成*5B。因此,多数研究通过检测341或481位点来判断等位基因*5B或*5的存在,检测590位点来判断等位基因*6A或*6的存在,检测857位点来判断等位基因*7B或*7的存在。
鉴于NAT2基因7个常见的单核苷酸多态性位点中有一些常以连锁形式存在,依据国内外数据报道,推荐建立NAT2基因多态性位点检测技术时应包括191、341、590和857等4个位点,由此就能够鉴定几乎所有的突变类型,确定患者的NAT2基因型,判定患者的异烟肼乙酰化类型。
(二)NAT2基因多态性与异烟肼代谢的关系
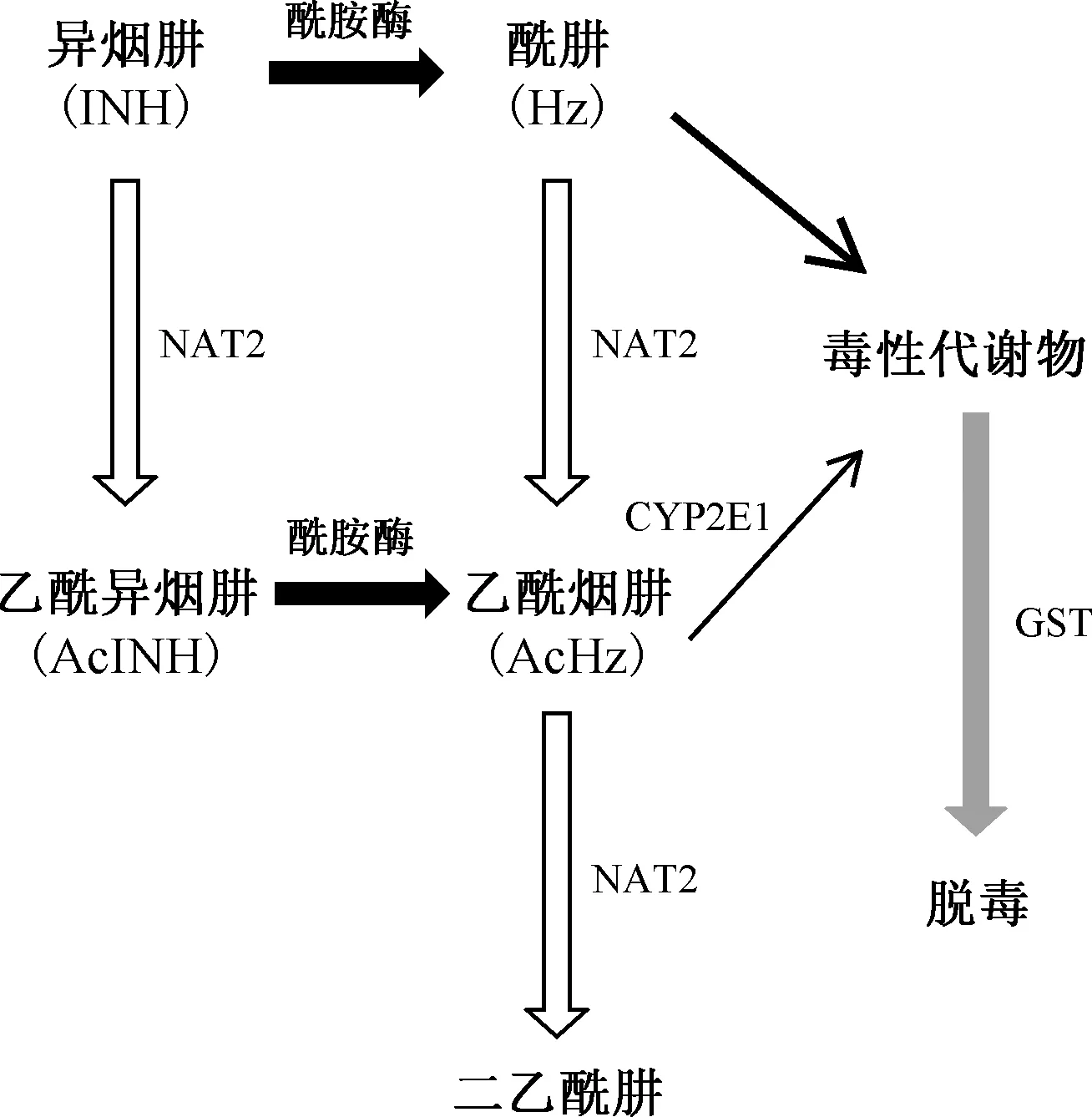
注 CYP2E1:细胞色素P4502E1;GST:谷胱甘肽巯基转移酶;NAT2:N-乙酰基转移酶2图1 人体内异烟肼代谢途径[4]
异烟肼在人体内主要存在两条代谢通路,如图1 所示,其大部分(50%~90%)在NAT2酶的作用下乙酰化为乙酰异烟肼(AcINH),之后在酰胺酶(amidase)的作用下生成乙酰烟肼(acetyl hydrazine,AcHz),另有一小部分异烟肼直接由酰胺酶催化水解为酰肼(hydrazine, Hz),已知酰肼对肝细胞有毒性作用。NAT2、细胞色素 P4502E1(CYP2E1)、谷胱甘肽巯基转移酶(GST)、超氧化物歧化酶(SOD)等均参与异烟肼的代谢过程,其中,NAT2发挥决定性作用。根据携带等位基因的类型进行表型的划分:携带2个快代谢等位基因者为快代谢型(RM),携带1个快代谢等位基因和一个慢代谢等位基因者为中间代谢型(IM),携带任意2个慢代谢等位基因者为慢代谢型(SM)[1]。对于快代谢型人群,异烟肼在体内代谢生成乙酰异烟肼的速度要明显快于其他类型,也由此造成此类型人群血中异烟肼浓度明显低于其他类型;而慢代谢人群对异烟肼乙酰化代谢速度较其他类型明显降低,而对异烟肼的水解作用加强,导致酰肼聚集,易于引发肝功能受损等不良反应[4]。来自我国的研究数据都表明,我国人群中以中间代谢型最为常见,约占40%~50%;快代谢型次之,约占30%~35%;慢代谢型较为少见,约占15%~20%[2-6]。
充足的数据表明,NAT2基因多态性是造成不同人群服用异烟肼之后血药浓度差异的主要原因(可解释85%以上的差异),而NAT2以外的异烟肼通路代谢所产生的酰肼与肝功能损伤的发生密切相关。推荐对结核病患者及时开展NAT2基因型鉴定,辅助对可能出现的低药物浓度和可能带来的肝脏损伤风险进行预判。
(三)NAT2基因多态性对异烟肼药代动力学各项指标的影响
NAT2基因型对异烟肼代谢类型的影响可通过对异烟肼及其代谢产物血药浓度的实时监测进行验证。根据患者NAT2基因型判定的快型、中间型、慢型等三种代谢类型患者之间的异烟肼血药浓度存在明显差异。服用相同剂量异烟肼情况下,不同代谢类型患者间异烟肼的血药浓度表现为快代谢型<中间代谢型<慢代谢型,而作为主要代谢产物的乙酰异烟肼的血药浓度则呈现出相反的状态,即快代谢型>中间代谢型>慢代谢型。由此,中间代谢型和慢代谢型患者的血中乙酰异烟肼与异烟肼比值(RA/I)要明显低于快代谢型患者,揭示NAT2基因型对异烟肼的代谢能力有较大影响[5-9]。
由于不同NAT2基因型的人群代谢异烟肼的速率不同,不同基因型人群在服用异烟肼后的血浆药物浓度及药物时间-浓度曲线下面积[AUC(0-∞)]存在较大差异,总体趋势是慢代谢型>中间代谢型>快代谢型。
(四)NAT2基因对异烟肼早期杀菌活性(early bactericidal activity,EBA)的影响
抗结核药物EBA试验是通过连续监测每天采集痰液中存活的结核分枝杆菌数量的变化,评估单一药物或新治疗方案对新诊断的涂阳肺结核患者的杀菌活性。EBA常作为药物治疗初期效果的评价指标之一。有研究通过设置 37.5 mg、75 mg、150 mg、300 mg、600 mg等5个剂量组研究不同剂量对异烟肼EBA的影响,结果表明:随着剂量增加,异烟肼血药浓度增高,异烟肼的平均EBA也相应增加,血药浓度是影响EBA的重要因素[10]。研究还发现,服药2 h后异烟肼血药浓度为 2~3 mg/L时,异烟肼平均EBA最大;且在同等异烟肼剂量下,不同乙酰化代谢类型患者的平均EBA结果为慢代谢型>中间代谢型>快代谢型。
在一定范围内,异烟肼的用量、服药后的血药浓度与EBA呈正相关。有必要考虑依据患者的乙酰化代谢类型适当调整异烟肼用药剂量,使患者血药浓度达到理想的浓度范围,以提高疗效。
(五)NAT2基因与异烟肼引发的肝损伤关系
抗结核药物所致药物性肝损伤是我国药物性肝损伤常见原因之一,轻者表现为一过性转氨酶升高,重者可致肝衰竭,甚至危及生命。大量研究显示,NAT2慢乙酰化基因型是发生药物性肝损伤的高危因素之一(OR值为2~5)[11-18]。而减少慢代谢型患者的异烟肼用量可以维持理想的血药浓度并减少肝功能损伤的发生[19]。因此,慢代谢型患者较其他基因型患者更易于发生肝功能损伤,建议对接受异烟肼治疗的慢代谢型患者在治疗过程中密切关注各项反映肝功能的指标的变化,可尝试依据血药浓度适当降低异烟肼用量。
(六)依据乙酰化代谢类型调整异烟肼剂量
多项基于NAT2基因型、药物剂型、体质量、性别等因素与异烟肼药代动力学及药效的研究表明,NAT2基因型自身可解释88%的个体差异。有研究评估了依据患者NAT2基因型的不同,按照慢代谢型、中间代谢型和快代谢型者分别服用2.5 mg/kg(0.5倍标准剂量)、5 mg/kg(标准剂量)和7.5 mg/kg(1.5倍标准剂量)的异烟肼剂量,获得了更好的治疗成功率,并减少了肝功能损伤的发生[19-23]。2015年7月,国家卫生和计划生育委员会颁布的《药物代谢酶和药物作用靶点基因检测技术指南(试行)》[1]也给出了基于NAT2基因型的异烟肼用药指导建议,即:建议降低NAT2慢代谢型(携带2个慢代谢型等位基因或单倍型)个体异烟肼的用药剂量以预防蓄积中毒和周围神经炎;中间代谢型(携带1个慢代谢型等位基因和1个快代谢型等位基因)和快代谢型(具有2个快代谢型等位基因)患者可常规使用异烟肼进行治疗。
综上所述,综合目前NAT2与异烟肼剂量研究的结果,建议对不同NAT2基因型的结核病患者参考其代谢类型进行异烟肼用量的调整,剂量应用的总体原则是快代谢型>中间代谢型>慢代谢型。在目前仍缺乏足够的证据之前,建议根据患者乙酰化代谢类型和血药浓度进行剂量的调整,可以目前较为公认的服药2 h后理想的血药浓度3~6 mg/L作为目标浓度进行剂量的调整。
二、NAT2基因检测流程、质控及报告内容和解读规范
(一)NAT2检测技术基因位点的选择
NAT2等位基因型组合有上百种,而*5B、*6A、*7B是最常见的突变亚型等位基因,占所有突变的90%以上,其代表等位基因分别为341T→C、590G→A、857G→A;其中,341T→C与481C→T联合突变也会形成*5B,而481C→T为同义突变,不影响NAT2代谢表型,可选择性进行检测;282C→T通常与590G→A或857G→A联合突变,分别形成等位基因*6A和*7B,而282C→T为同义突变,不影响NAT2代谢表型,也可选择性进行检测。推荐在我国使用的NAT2检测技术的检测位点至少应包括341T→C、590G→A和857G→A等3个位点,对于有可能在国际应用的检测技术,建议考虑再增加191G→A位点的检测。
(二)NAT2基因多态性检测的适用人群
基于现有指南及公开发表的专业文献中纳入的研究人群,NAT2基因检测适用于治疗方案中包含异烟肼的结核病患者。鉴于目前NAT2基因型对儿童及特殊疾病群体异烟肼用药的研究较少,临床证据不充分,本指导原则不适用于儿童和特殊疾病群体等。
(三) 检测基本流程
1.样本采集:NAT2基因检测对象为人基因组DNA,样本类型可以选择人体组织样本、唾液、外周全血、白细胞等,推荐使用人外周静脉血和唾液检测。其中,全血采集量以3~5 ml为宜,使用抗凝剂进行抗凝处理;抗凝剂首选乙二胺四乙酸(EDTA)抗凝剂或枸橼酸钠抗凝剂,禁止使用肝素抗凝剂。唾液样本推荐使用具有结核分枝杆菌灭活性保存液的采集装置进行采集,采集量以1~3 ml为宜。唾液样本采集时,需要用舌头刮蹭上下颚,保证脱落细胞的数量;建议采样前30 min内勿进食、饮水、吸烟等,勿在采样之前漱口。血液样本在2~8 ℃可储存7 d,不能尽早进行提取的样本可于-20 ℃及以下长期储存。
2.DNA提取:DNA质量是检测成功的关键因素。对于不同类型标本的人基因组DNA的提取可以选用商品化的DNA提取试剂盒进行。有条件的情况下,提取的DNA建议先进行质量评估,即测定浓度和纯度,之后再用于NAT2基因检测。
3.NAT2基因的检测:NAT2基因检测是对人类基因组DNA 上的单核苷酸多态性进行检测,检测方法仍以Sanger测序法作为“金标准”[17-18]。已陆续有更加简便、快速方法的建立和应用的报道,诸如PCR-RFLP法[2,21]、qPCR法[13]、探针熔解曲线法[8,24],等等。实验室可在充分了解不同检测方法的优缺点及局限性后根据实际情况选择应用,在使用前需对该检测体系的敏感度、特异度、重复性和稳定性进行验证。
4.质量控制:实验室的总体设计与要求应参考《分子病理诊断实验室建设指南(试行)》《医疗机构临床基因扩增检验实验室工作导则》等行业文献和要求。检测人员、分析人员、报告分析人员和提供咨询人员应具备相应专业背景,且经过相应培训取得上岗资质。实验室区域设置和环境需要满足实验环节和仪器要求,检测相关的仪器设备必须定期维护和校验。建议NAT2检测实验室应建立质量管理体系,对于标本采集和处理、实验操作、结果分析和报告分析各个环节均需要建立标准作业程序文件,实验操作程序须经过性能验证或确认。实验环节需要设置阴性和阳性对照。
5.检测报告:NAT2基因突变检测的报告内容应包括检测结果及对结果的诠释,且能够被临床医师理解;其他内容应涵盖患者及标本基本信息、提取方法、检测方法、检测试剂及仪器、相关临床意义,以供临床医师全面参考。建议从接收标本到发出报告周期不超过5个工作日,以及时满足临床需求。
6.检测报告解读:基于国外数据库及大量的文献报告,以推荐的341T→C、590G→A和857G→A等3个位点为例,对检测结果及其临床意义做以下参考建议(表1,2);若开展的NAT2突变检测项目涉及更多NAT2基因上的突变位点,可参考专业数据库(http://nat.mbg.duth.gr/)进行结果的判读,但最终的解释需依据各类信息(包括来自群体数据库、疾病数据库、文献和患者病史的信息)进行综合评判。

表1 NAT2基因型与乙酰化代谢类型对应关系

表2 患者的乙酰化代谢类型及异烟肼用药建议
三、总结
精准化治疗是结核病化疗的发展方向。在异烟肼用药之前对患者NAT2基因型进行检测,并以此为依据选择个体化的异烟肼用药剂量,减少药物不良反应的发生,有助于提高结核病精准化治疗水平。然而,关于不同NAT2基因型患者的最适异烟肼剂量,以及如何合理应用高剂量异烟肼等重要内容,目前国内外均处于研究阶段,未来可能会有更详实的数据指导更加精准的异烟肼用量选择。构建我国大样本NAT2基因突变数据库并进行规范解读,可以指导与规范NAT2基因检测在我国的临床应用,改善相应患者的治疗策略。随着中国人群的NAT2基因检测项目开展,以及NAT2基因突变对疗效影响的研究更加深入,对结果的解读也将更加准确。
执笔者黄海荣、王隽、初乃惠
专家组成员(排名不分先后) 马玙、初乃惠、黄海荣、高孟秋、段鸿飞、于霞、陆宇、马丽萍、聂文娟、王隽(首都医科大学附属北京胸科医院/北京市结核病胸部肿瘤研究所);陈效友(首都医科大学附属北京地坛医院);王黎霞、李敬文、范永德(《中国防痨杂志》期刊社);沙巍、范琳、顾瑾(同济大学附属上海市肺科医院);张文宏(复旦大学附属华山医院);吴雪琼、梁建琴(中国人民解放军总医院第八医学中心);曹文利(北京老年医院);蔡青山(杭州市红十字会医院);陈晓红(福建省福州肺科医院);陈裕(河南省传染病医院);邓爱花(江西省胸科医院);邓国防(深圳市第三人民医院);杜鹃、刘冠、周铭(武汉市肺科医院);韩文革(山东省潍坊市第二人民医院);金龙(黑龙江省传染病防治院);李昕洁、邝浩斌(广州市胸科医院);李志惠(河北省胸科医院);梁瑞霞(河南省胸科医院);刘爱梅(广西壮族自治区龙潭医院);刘玉峰(青岛市中心医院北部院区);潘洪秋(江苏省镇江市第三人民医院);孙鹏、杨国立(吉林省结核病医院);王华(安徽省胸科医院);仵倩红(陕西省结核病防治院);杨坤云、易恒仲(湖南省胸科医院/湖南省结核病防治所);张侠(南京市第二医院);党丽云、任斐(西安市胸科医院);石莲(沈阳市胸科医院);吴春(长春市传染病医院);邱超(佳木斯市肿瘤医院)
