化脂复肝颗粒对非酒精性脂肪肝TLR4/NF-κB通路及脂肪铁死亡的调控及机制研究
2021-11-05叶苗青薛敬东李粉萍杨跃青何瑾瑜唐颖慧
叶苗青,薛敬东,李粉萍,杨跃青,何瑾瑜,唐颖慧
(陕西省中医医院,陕西 西安 710003)
非酒精性脂肪肝是指除酒精和其他明确损肝因素外所致的肝细胞内脂肪过度沉积、肝脏弥漫性脂肪浸润为主要临床特征的疾病,疾病后期通常会向肝硬化乃至肝癌进行演变,对人们的身体健康构成严重威胁[1-2]。目前国内有约1/3的人群患有非酒精性脂肪肝,且随着人们生活方式的转变,非酒精性脂肪肝的发病率在逐渐增高,已经成为一个重大公共卫生问题。化脂复肝颗粒是根据陕西省中医医院名中医张瑞霞主任研制的治疗脂肪肝的经验方制成的中成药,其可减轻四氯化碳诱导的小鼠急性肝损伤,可明显降低乙硫氨酸诱导的脂肪肝大鼠的总胆红素和TG含量,减轻脂肪肝重量和肝脏病理损伤[3]。张欣等[4]和李小瑞等[5]报道采用化脂复肝颗粒治疗脂肪肝患者的总有效率分别达到86.9%和86.7%,证实化脂复肝颗粒具有降低血脂、保肝降酶及改善脂肪肝临床表现的作用,但目前化脂复肝颗粒治疗非酒精性脂肪肝的机制并不十分明确。近年相关研究发现“铁死亡”是脂肪肝中最先发生的细胞死亡,抑制铁死亡几乎可以完全抑制肝炎发病[6]。本课题即以铁死亡为切入点,深入研究了化脂复肝颗粒治疗非酒精性脂肪肝的作用机制。
1 实验材料与方法
1.1动物 选取健康6~8周龄雄性C57小鼠60只,体重(20±2)g,由上海斯莱克实验动物中心提供,动物许可证号:SCXK(沪)2018-0005。饲养于SPF级动物实验室中,饲养环境温度23~25 ℃,湿度40%~70%,昼夜明暗交替(12 h/12 h),每笼4~5只,自由活动。
1.2药物及试剂、仪器 化脂复肝颗粒,陕西省中医医院提供;去铁胺(铁死亡抑制剂),Sigma公司;RNA抽提试剂盒、逆转录试剂盒、SYBR Green实时荧光定量试剂盒,TAKARA公司。7150型全自动生化分析仪,日本日立;切片机(RM2035)、LEICA ASP300自动脱水机、LEICA EG1160石蜡包埋机,德国LEICA公司;高速冷冻离心机5810R,德国Eppendorf公司。
1.3实验方法 小鼠适应性饲养1周,按体重随机取10只作为正常组,给予普通饲料喂养,自由饮食饮水;余50只给予高脂高糖饲料(62.8%配合饲料+20%猪油+10%蛋黄粉+5%蔗糖+2%胆固醇+0.2%丙硫氧嘧啶)喂养10周建立非酒精性脂肪肝模型。分别于造模开始和造模10周末随机处死2只小鼠,摘取肝脏做HE染色,评估肝脏脂肪变程度,观察造模是否成功。将40只造模成功小鼠随机分成模型组、化脂复肝颗粒高剂量组、化脂复肝颗粒低剂量组、去铁胺组,每组10只。化脂复肝颗粒高、低剂量组分别给予化脂复肝颗粒20 g/kg、10 g/kg灌胃,去铁胺组给予去铁胺(50 mg/kg)腹腔注射,正常组及模型组给予等量生理盐水灌胃,1次/d,连续6周。灌胃期间各造模小鼠继续给予高脂高糖饲料喂养。
1.4检测指标及方法
1.4.1血液学指标 灌胃结束后,小鼠禁食不禁水12 h,称重后眼眶取血,经离心取血清,采用全自动生化分析仪检测血清中总胆固醇(TC)、三酰甘油(TG)、谷丙转氨酶(ALT)和谷草转氨酶(AST)水平,采用ELISA检测试剂盒检测血清肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)水平。
1.4.2肝湿重和肝脏指数 取血后开腹,分离肝脏并称重,计算肝脏指数(肝重/处死时体重×100%)。
1.4.3肝脏组织病理学观察 肝脏组织经4%多聚甲醛溶液固定,梯度酒精脱水,常规石蜡包埋,5 μm切片,HE染色后在光镜下读片。
1.4.4肝脏组织中乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)含量 取液氮冻存的约0.1 g肝脏组织, 按1∶9的比例在冰浴上加入预冷的生理盐水,高速匀浆,经离心后取上清,采用ELISA检测试剂盒检测 LDH、MDA、SOD含量。
1.4.5肝脏组织中Toll样受体4(TLR4)、核转录因子-κB p65(NF-κB p65)、溶质载体家族7成员11(SLC7A11)、前列腺素内过氧化物合酶2(PTGS2) mRNA表达量 取50 mg肝脏组织,加1 mLTrizol研磨匀浆,加1/2 Trizol体积的氯仿提取,并用异丙醇或纯酒精沉淀RNA后,用DEPC水溶解抽提总RNA;取1 μg RNA用SuperScriptTMII Reverse Transcriptase反转录试剂盒将RNA反转录成cDNA,用SYBR Green染料法进行扩增检测。引物序列:Bactin-F 5’-GGCTGTATTCCCCTCCATCG-3’,Bactin-R 5’-CCAGTTGGTAACAATGCCATGT-3’;TLR4-F 5’-TTCTGCAATGTCTCTGGCAGG-3’,TLR4-R 5’-GCTGAGACTTGGTAGGGCCA-3’;NF-κB p65-F 5’-TGCGATTCCGCTATAAATGCG-3’,NF-κB p65-R 5’-ACAAGTTCATGTGGATGAGGC-3’;SLC7A11-F 5’-TTACCACCATCAGTGCGGAG-3’,SLC7A11-R 5’-GCAACAAAGATCGGGACTGC-3’;PTGS2-F 5’-CATCCCCTTCCTGCGAAGTT-3’,PTGS2-R 5’-GGCCCTGGTGTAGTAGGAGA-3’。反应体系: Power SYBR®Green Master Mix 10 μL,10 μmol/L Forward Primer 0.5 μL,10 μmol/L micro-R 0.5 μL,SDW 8 μL,CDNA 1.0 μL,用DEPC水定容到总体积20 μL。反应条件:95 ℃ 1 min,1个循环;95 ℃ 15 s,60 ℃ 25 s, 40个循环,60 ℃处收集荧光;55~95 ℃绘制溶解曲线。每个样品重复3次,用2-ΔΔct法计算基因的相对表达量。

2 结 果
2.1各组小鼠血清TC、TG、ALT和AST水平比较模型组血清TC、TG、ALT、AST水平均明显高于正常组(P均<0.05);化脂复肝颗粒高剂量组和去铁胺组血清TC、TG、ALT、AST水平均明显低于模型组和化脂复肝颗粒低剂量组(P均<0.05),化脂复肝颗粒高剂量组和去铁胺组各指标比较差异均无统计学意义(P均>0.05)。 见表1。

表1 正常组和非酒精脂肪肝各组小鼠血清TC、TG、ALT、AST水平比较
2.2各组小鼠血清TNF-α和IL-1β水平比较 模型组血清 TNF-α和IL-1β水平均明显高于正常组(P均<0.05);化脂复肝颗粒高、低剂量组和去铁胺组血清TNF-α和IL-1β水平均明显低于模型组(P均<0.05),化脂复肝颗粒高剂量组和去铁胺组均明显低于化脂复肝颗粒低剂量组(P均<0.05),化脂复肝颗粒高剂量组和去铁胺组比较差异均无统计学意义(P均>0.05)。见表2。

表2 正常组和非酒精脂肪肝各组小鼠血清TNF-α和IL-1β水平比较
2.3各组小鼠肝湿重和肝脏指数比较 模型组小鼠的肝湿重和肝脏指数均明显高于正常组(P均<0.05);化脂复肝颗粒高剂量组和去铁胺组小鼠的肝湿重和肝脏指数均明显低于模型组(P均<0.05),各药物组间比较差异均无统计学意义(P均>0.05)。见表3。

表3 正常组和非酒精脂肪肝各组小鼠肝湿重及肝脏指数比较
2.4各组小鼠肝脏组织病理形态学表现 HE染色显示,正常组肝脏组织中细胞排列紧密,细胞核大而圆,且位于正中央;模型组肝脏组织中细胞排列疏松,细胞间出现大量脂滴;各药物组细胞排列较模型组紧密,脂滴数也减少,以化脂复肝颗粒高剂量组和去铁胺组改善更明显。见图1。
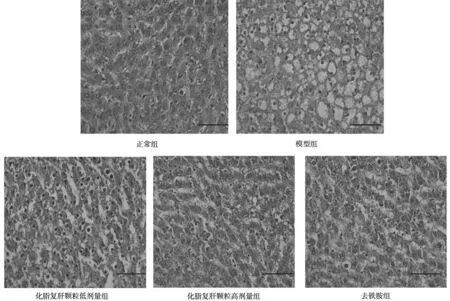
图1 正常组和非酒精脂肪肝各组小鼠肝脏组织HE染色表现(×200)
2.5各组小鼠肝脏组织中SOD和MDA含量比较模型组SOD含量明显低于正常组(P<0.05),MDA含量明显高于正常组(P<0.05);化脂复肝颗粒低、高剂量组和去铁胺组SOD含量均明显高于模型组(P均<0.05),MDA含量均明显低于模型组(P均<0.05);各药物组间比较差异均无统计学意义(P均>0.05)。见表4。

表4 正常组和非酒精脂肪肝各组小鼠肝脏组织中SOD和MDA含量比较
2.6各组小鼠肝脏组织中TLR4、NF-κB p65、SLC7A11、PTGS2 mRNA 表达量比较 模型组TLR4和NF-κB p65 mRNA表达量明显低于正常组(P均<0.05),SLC7A11与PTGS2 mRNA表达量均明显高于正常组(P均<0.05);化脂复肝颗粒高剂量组和去铁胺组TLR4和NF-κB p65 mRNA表达量均明显高于模型组和化脂复肝颗粒低剂量组(P均<0.05),SLC7A11与PTGS2 mRNA表达量均明显低于模型组和化脂复肝颗粒低剂量组(P均<0.05);化脂复肝颗粒高剂量组和去铁胺组各指标比较差异均无统计学意义(P均>0.05)。见表5。

表5 正常组和非酒精脂肪肝各组小鼠肝脏组织中TLR4、NF-κB p65、SLC7A11、PTGS2 mRNA表达量比较
3 讨 论
非酒精性脂肪肝的发病机制尚不明确,目前被广泛认可的是“二次打击学说”。由胰岛素抵抗而形成的单纯性脂肪肝为第一次打击,二次打击是指第一次打击后,脂肪过量蓄积的肝细胞发生氧化应激与脂质过氧化物(LPO)所引起的炎症递质产生、线粒体功能障碍,肝星状细胞激活,从而导致肝细胞的炎症、坏死与纤维化。其他学说认为非酒精性脂肪肝亦与遗传因素、肠道菌群紊乱、脂肪细胞因子失调、慢性低度炎症反应、免疫功能紊乱等相关[7]。
铁死亡是一种特殊细胞死亡模式,2012年由Brent R. Stockwell提出[8],指的是当细胞胱氨酸运输蛋白受到抑制,胞内谷胱甘肽(GSH)会被耗尽,最终导致谷胱甘肽过氧化物酶(GPX4)的失活,导致脂质过氧化积累,达到一定程度即可诱发细胞死亡,GPX4受到抑制(如RSL3)也可以直接导致这一作用。目前发育等生理活动过程是否有铁死亡机制的参与还不是很清楚,但很多疾病均与铁死亡有关,包括神经退行性疾病[8-9]、局部缺血再灌注损伤[10]、肾衰竭[11]、肿瘤[12]等均与铁死亡有密切关系。铁离子螯合剂及很多抑制或缓解脂质过氧化的药物均可抑制铁死亡的过程,包括亲脂性抗氧化剂、脂质过氧化抑制剂等。铁死亡过程必须有氨基酸、铁以及脂类代谢物参与,谷氨酰胺也有着重要作用[13]。在正常的生理作用中,胞外谷氨酰胺以及脂类代谢物特别是多元不饱和脂肪酸会诱发铁死亡[14]。铁是脂类代谢物累积和铁死亡必不可少的因素[15]。在此过程中的许多分子如VDAC、GPX4、HSPβ1、NRF2、NADPH、TP53、SLC7A11等都直接或间接地跟铁死亡相关[16]。
本实验结果显示,模型组小鼠血清TC、TG、ALT、AST、TNF-α、IL-1β水平和肝湿重、肝脏指数肝脏组织中MDA含量,SLC7A11、PTGS2 mRNA表达量均明显高于正常组,肝脏组织中SOD含量及TLR4、NF-κB p65 mRNA表达量均明显低于正常组;化脂复肝颗粒高剂量组和去铁胺组血清TC、TG、ALT、AST、TNF-α、IL-1β水平和肝湿重、肝脏指数肝脏组织中MDA含量,SLC7A11、PTGS2 mRNA表达量均明显低于模型组,肝脏组织中SOD含量及TLR4、NF-κB p65 mRNA表达量均明显高于模型组,化脂复肝颗粒高剂量组和去铁胺组各指标比较差异均无统计学意义。病理观察显示化脂复肝颗粒高剂量组和去铁胺组细胞排列较模型组紧密,脂滴数明显减少。 提示化脂复肝颗粒具有显著的降脂、抗炎、抗氧化损伤及保肝作用,推测其作用机制与TLR4/NF-κB信号通路和铁死亡直接相关,为非酒精性脂肪肝的治疗提供了新的思路及靶点。
利益冲突:所有作者均声明不存在利益冲突。
