四君子汤对结肠癌肝转移小鼠Wnt/β-catenin信号通路的抑制作用研究
2021-11-05马漪,谢琼
马 漪,谢 琼
(湖南中医药大学第一附属医院,湖南 长沙 410000)
结肠癌是常见的胃肠道肿瘤之一,好发于直肠与乙状结肠交界处,其发病与年龄、性别、饮食习惯及遗传等多种因素有关。目前结肠癌主要采用手术治疗,然而对于晚期或转移的患者,治疗效果并不理想。肿瘤转移是多数癌症患者死亡的主要原因,结肠癌的主要转移方式为肠壁环行发展、纵径蔓延及深层浸润,此外结肠癌还可通过淋巴管、血流转移。肝脏是结肠癌扩散转移的主要部位,患者的预后与肝转移密切相关,因此对于结肠癌及其肝转移治疗药物的研发是目前研究重点[1]。Wnt/β-catenin通路是与肿瘤细胞增殖及转移相关的信号通路,该通路的激活能够通过增强结肠癌细胞增殖能力,进而诱导结肠癌在体内血行转移,促进结肠癌肝转移的发生、发展等[2-3]。四君子汤是中药复方汤剂,研究发现其能够增强肿瘤患者免疫力,提高肿瘤细胞对化疗药物的敏感性,促进肿瘤细胞凋亡,抑制结肠癌等多种肿瘤的发生及转移,减少化疗不良反应[4],但其对结肠癌肝转移的作用效果及机制尚不明确。本实验研究了四君子汤对结肠癌肝转移小鼠的肿瘤抑制作用及对Wnt/β-catenin通路的调节作用,旨在进一步明确四君子汤的药理作用。
1 实验材料与方法
1.1实验动物 SPF级BALB/c雄性小鼠50只,6~8周龄,体重18~20 g,购自湖南省实验动物中心,许可证号:SYXK(湘)2020-0003,饲养于动物房。
1.2仪器与设备 Mx3000P实时荧光定量PCR仪(美国 Agilent公司);HC-2518R高速冷冻离心机(上海臣莲生物科技发展有限公司);Infinite F50酶标仪(瑞士Tecan公司);Gel Doc EZ凝胶成像仪(美国BIO-RAD公司);CX43荧光倒置显微镜(日本OLYMPUS公司);RM2235石蜡切片机(德国Leica公司)。
1.3药品及试剂 四君子汤(由人参9 g、白术9 g、茯苓9 g、甘草6 g组成)由中药饮片制成生药含量为1 g/mL的汤剂(北京同仁堂股份有限公司);HCT116细胞(中国科学院上海细胞库);PCR反应试剂盒(德国Qigen公司,批号:219073);TRIzol Invitrogen总RNA提取试剂盒(北京索莱宝科技有限公司,批号:15596026);XAV939(美国MedChemExpress公司,货号:HY-15147,纯度98.71%);TRIzol试剂、cDNA合成试剂盒(赛默飞世尔科技有限公司,货号分别为15596018和M1662);TUNEL细胞凋亡检测试剂盒、Wnt3a及β-catenin兔多克隆抗体、GAPDH兔单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(碧云天生物科技公司,批号分别为C1086、AF8352、AF0066、AF1186、A0208);RIPA裂解液、ECL化学发光试剂盒、HE染液(武汉赛维尔生物科技有限公司,货号分别为G2002、G2014、G1005);PCR引物设计及合成(南京金斯瑞生物科技有限公司)。
1.4分组、造模及给药 将50只小鼠随机分为结肠癌肝转移组、四君子汤低剂量组、四君子汤中剂量组、四君子汤高剂量组及XAV939组,每组10只。取对数生长期的HCT116细胞,调整细胞密度为2.5×107/mL,将小鼠麻醉后开腹,参照文献[5]方法,按照0.2 mL/只向小鼠脾脏内注射HCT116细胞悬液,缝合腹腔,7 d后以小鼠肝脏部位可触及米粒大小包块视为造模成功。然后四君子汤低、中、高剂量组分别按照3.5 g/kg、7 g/kg、14 g/kg(参照文献[6]方法计算给药量,以生药含量计)的剂量灌胃给予四君子汤,XAV939组按照文献[7]方法腹腔注射10 mg/kg 的XAV939,结肠癌肝转移组灌胃给予等量生理盐水,均1次/d,连续21 d。
1.5检测指标及方法
1.5.1小鼠体重、肝脏重量及肝脏指数 各组小鼠称体重后处死,分离肝脏,称肝脏重量,计算小鼠肝脏指数(肝脏重量/体重×100%)。
1.5.2肝脏组织病理及肝组织转移灶数量 取小鼠肝组织,用4%多聚甲醛固定,石蜡包埋,切成4 μm厚的标本,常规HE染色,显微镜下盲法进行观察,并计算各样本转移灶数量。
1.5.3肿瘤细胞凋亡率 小鼠处死后分离肿瘤组织,经4%多聚甲醛固定后制成4 μm厚石蜡切片,按照TUNEL试剂盒方法对各组小鼠肿瘤组织切片进行染色,使用含有DAPI的抗荧光淬灭剂封片,分别在荧光显微镜下以360 nm和500 nm激发波长下观察,每张切片取5个视野,观察并计算TUNEL染色阳性细胞数,计算肿瘤组织细胞凋亡率。细胞凋亡率=阳性细胞数/总细胞数×100%。
1.5.4肿瘤组织中Wnt3a及β-catenin mRNA表达量 采用RTq-PCR法测定:取肿瘤组织,用TRIzol试剂提取总RNA,逆转录合成cDNA,使用PCR反应试剂盒进行RTq-PCR反应。引物序列:Wnt3a正向引物为5’-CCTCGTTCAGGATGTGGTTT-3’,反向引物为5’-TCTGGTGATATCGTGGGTGA-3’;β-catenin正向引物为5’-ACTGGAAGAGCTGTGTGACG-3’,反向引物为5’-GGAGGTGGTGAAGATGAAGC-3’;β-actin正向引物为5’-ACACTGTGTGCCCATCTACGAGG-3’,反向引物为5’-AGGGGCCGGACTCGTCGTCATACT-3’。以β-actin为内参,结果采用2-ΔΔCt法计算各基因相对表达量。
1.5.5肿瘤组织中Wnt3a及β-catenin蛋白表达量 采用Western blot法测定:取肿瘤组织,裂解匀浆后取上清,蛋白经加热变性后,用二喹啉甲酸法测定总蛋白浓度,用10%的聚丙烯酰胺凝胶电泳进行分离,将分离出的蛋白质转移到PVDF膜上,依次使用1∶500稀释的Wnt3a、β-catenin兔多克隆抗体以及山羊抗兔IgG(1∶1 000稀释)孵育后,滴加ECL试剂显影,凝胶成像系统中成像后,以GAPDH为内参,使用ImageJ软件计算各蛋白相对表达量。

2 结 果
2.1各组小鼠体重、肝脏重量及肝脏指数比较 四君子汤低、中、高剂量组及XAV939组小鼠体重、肝脏重量及肝脏指数均明显低于结肠癌肝转移组(P均<0.05),且四君子汤中、高剂量组及XAV939组均明显低于四君子汤小剂量组(P均<0.05),四君子汤高剂量组及XAV939组均明显低于四君子汤中剂量组(P均<0.05),四君子汤高剂量组与XAV939组比较差异均无统计学意义(P均>0.05)。见表1。

表1 各组结肠癌肝转移小鼠体重、肝脏重量及肝脏指数比较
2.2各组小鼠肝组织病理变化及转移灶数量比较
结肠癌肝转移组小鼠肝组织充血水肿,可见明显肿瘤转移灶;四君子汤低、中、高剂量组及XAV939组小鼠肝组织充血水肿减轻,肝组织转移灶数量明显少于结肠癌肝转移组(P均<0.05),且四君子汤中、高剂量组明显少于四君子汤低剂量组(P均<0.05),四君子汤高剂量组明显少于四君子汤中剂量组(P<0.05),四君子汤高剂量组与XAV939组比较差异无统计学意义(P>0.05)。见图1及图2。

图1 各组结肠癌肝转移小鼠肝组织病理HE染色表现 (×200)

图2 各组结肠癌肝转移小鼠肝组织转移灶数量比较
2.3各组小鼠肿瘤细胞凋亡情况比较 结肠癌肝转移组、四君子汤低剂量组、四君子汤中剂量组、四君子汤高剂量组及XAV939组小鼠肿瘤细胞凋亡率分别为(4.61±0.55)%、(10.07±0.94)%、(15.40±1.71)%、(21.78±1.13)%、(19.58±0.70)%,四君子汤低、中、高剂量组及XAV939组均明显高于结肠癌肝转移组(P均<0.05),且四君子汤中、高剂量组及XAV939组均明显高于四君子汤小剂量组(P均<0.05),四君子汤高剂量组及XAV939组均明显高于四君子汤中剂量组(P均<0.05),四君子汤高剂量组与XAV939组比较差异无统计学意义(P>0.05)。各组肿瘤细胞凋亡TUNEL染色表现见图3。

图3 各组结肠癌肝转移小鼠肿瘤细胞凋亡TUNEL染色情况
2.4各组小鼠肿瘤组织中Wnt3a及β-cateninmRNA表达量比较 四君子汤低、中、高剂量组及XAV939组小鼠肿瘤组织中Wnt3a及β-catenin mRNA表达量均明显低于结肠癌肝转移组(P均<0.05),且四君子汤中、高剂量组及XAV939组均明显低于四君子汤小剂量组(P均<0.05),四君子汤高剂量组及XAV939组均明显低于四君子汤中剂量组(P均<0.05),XAV939组均明显低于四君子汤高剂量组(P均<0.05)。见表2。

表2 各组结肠癌肝转移小鼠肿瘤组织中Wnt3a及β-catenin mRNA表达量比较
2.5各组小鼠肿瘤组织中Wnt3a及β-catenin蛋白表达量比较 四君子汤低、中、高剂量组及XAV939组小鼠肿瘤组织中Wnt3a及β-catenin蛋白表达量均明显低于结肠癌肝转移组(P均<0.05),且四君子汤中、高剂量组及XAV939组均明显低于四君子汤小剂量组(P均<0.05),四君子汤高剂量组及XAV939组均明显低于四君子汤中剂量组(P均<0.05),XAV939组均明显低于四君子汤高剂量组(P均<0.05)。见图4。
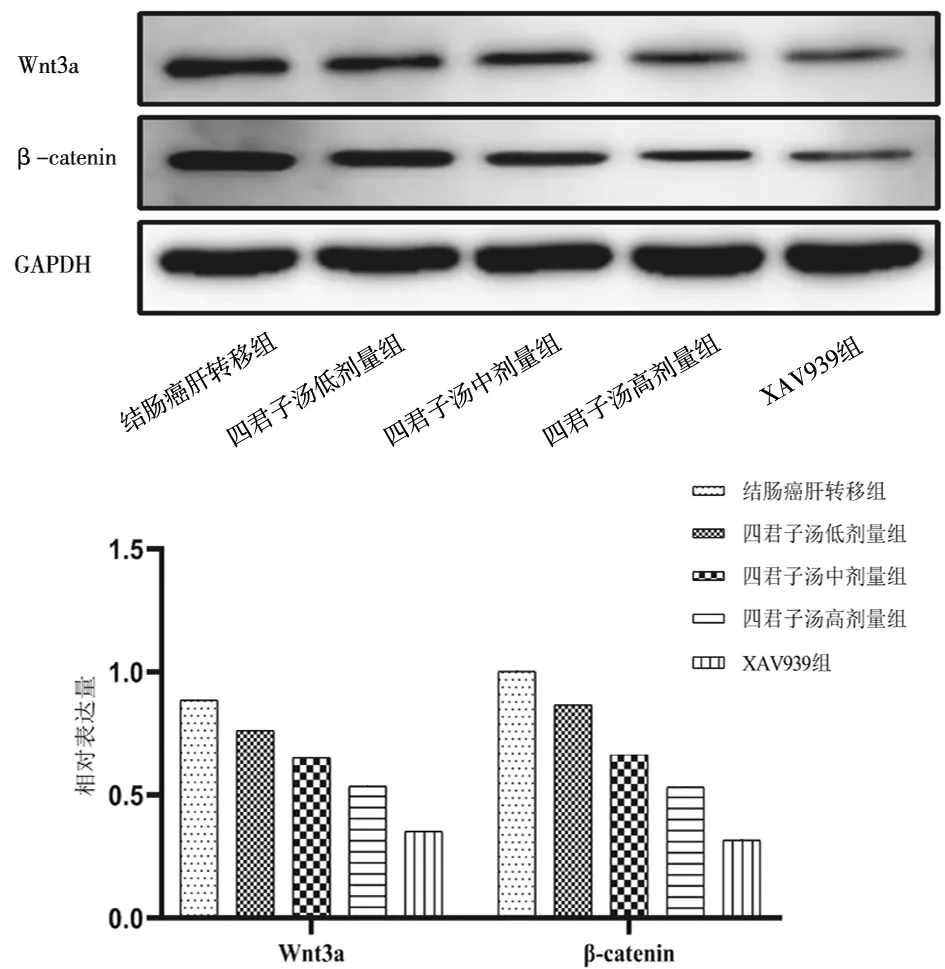
图4 各组结肠癌肝转移小鼠肿瘤组织中Wnt3a及β-catenin蛋白表达情况
3 讨 论
结肠癌为常见的消化道恶性肿瘤之一,其发病率占胃肠道肿瘤的第3位,其可通过淋巴管及血流转移、局部侵犯等方式转移[8-9]。研究表明,结肠癌患者中肝转移发生率高达50%[10],对于结肠癌肝转移临床主要采用手术及介入治疗等手段治疗,对于不可切除的结肠癌肝转移,以5-氟尿嘧啶等药物化疗为主,患者预后差[11]。
四君子汤具有益气健脾的功效,用以治疗脾胃气虚证。近年来,四君子汤在结直肠癌的辅助治疗中显示出一定优势。刘良等[12]研究表明四君子汤能够修复化疗引起的小鼠胃肠道损伤,改善小鼠免疫功能。岳顺[13]研究发现,四君子汤能够提高直肠癌患者术后辅助化疗疗效,改善患者腹胀和便溏症状,提高患者免疫力。俞志高[14]研究发现四君子汤能够显著改善结肠癌患者胃肠道功能。李斌等[15]报道四君子汤能够降低结肠癌荷瘤小鼠瘤重,降低血清炎症因子水平,进而抑制肿瘤进展。徐云丹等[16]发现四君子汤可以增强结肠癌HT-29细胞对5-氟尿嘧啶的化疗敏感性。由此可见四君子汤在结肠癌的治疗中具有较大潜力。
肝脏指数反映了肝组织充血水肿状态及肿瘤转移灶生长程度;转移灶数量则直接反映了肿瘤细胞的恶化程度。本实验结果表明,与结肠癌肝转移组比较,四君子汤各剂量组小鼠肝脏指数显著降低,转移灶数量也显著减少,且与四君子汤的剂量表现出依赖性,同时TUNEL染色显示肿瘤细胞凋亡率随四君子汤剂量的增加而逐渐升高,这提示四君子汤能够呈剂量依赖性的显著抑制结肠癌肝转移小鼠的肿瘤生长,促进肿瘤细胞凋亡,抑制结肠癌肝转移灶的进一步恶化。
Wnt/β-catenin通路是细胞增殖过程中必需的信号转导通路,在肿瘤的进展过程中通过促进肿瘤细胞增殖及抑制肿瘤细胞凋亡等多种途径导致了肿瘤的进一步恶化及进展[17-18]。目前研究发现Wnt/β-catenin通路与肝细胞癌、结肠癌、胃癌、乳腺癌的发生发展、转移、侵袭及细胞耐药均有明显相关性[19-20]。杨晓等[21]研究表明Wnt/β-catenin通路参与HCT116细胞的分裂及凋亡等生理过程,抑制Wnt/β-catenin通路能够诱导结肠癌HCT116细胞凋亡。任建琳等[22]研究发现Wnt/β-catenin通路与结肠癌HT29细胞血行转移有关,抑制Wnt/β-catenin通路相关蛋白水平能够抑制皮下荷瘤大鼠HT29细胞的转移。武健等[23]研究发现SW480细胞转移侵袭机制与Wnt/β-catenin通路蛋白异常升高有关。由此可见,在结肠癌的多器官转移等进展过程中Wnt/β-catenin通路起着重要作用。XAV939是药理机制明确的Wnt/β-catenin通路抑制剂,故本实验用其作为阳性对照药物。本实验结果表明,四君子汤各剂量组小鼠肿瘤组织中Wnt3a及β-catenin mRNA及蛋白表达量均明显低于结肠癌肝转移组,表明四君子汤能够通过抑制Wnt/β-catenin通路相关蛋白的表达,进而抑制结肠癌肝转移。
综上所述,四君子汤能够减少结肠癌肝转移小鼠的转移灶数量,促进肿瘤细胞凋亡,其机制可能与调节Wnt/β-catenin信号通路有关。
(致谢:特别感谢湖南中医药大学基础医学院许佳老师在实验中给予的支持和帮助!)
利益冲突:所有作者均声明不存在利益冲突。
