披针叶黄华内生真菌的分离与鉴定
2021-11-04赵文星吴可欣郭梓豫张云昊唐丽辉刘奕伶莫重辉赵宝玉
赵文星,吴可欣,郭梓豫,张云昊,唐丽辉,刘奕伶,莫重辉,赵宝玉,路 浩*
(1.西北农林科技大学动物医学院,杨凌 712100; 2.青海大学农牧学院,西宁 810016)
披针叶黄华(Thermopsislanceolata),又名“黄花苦豆”“野决明”“牧马豆”,蒙古语 “他日巴干-希日”,为豆科(leguminoseae)野决明属(Thermopsis)植物[1]。披针叶黄华为多年生草本植物,资源相当丰富[2-4],广泛分布于我国东北、华北和西北各省区[5]。披针叶黄华多生长于草原沙丘、河岸砾滩、林下灌丛,在河谷、沟渠等地也可零星生长,偶见农田及路旁,一般散生,条件合适时也能形成小群落[6,7]。该植物凭借其发达的根系、超强的抗逆性等特性,分布范围和分布强度逐步扩大[8],能耐-37 ℃的低温,在东北、青藏高原等高寒地域亦可良好越冬,同时也能在退化盐碱化的土壤中较好生长[9]。披针叶黄华可做药用[10],具有兴奋呼吸、祛痰、止咳、止痛、抗炎等功效[11-12]。新鲜状态下具有特殊的苦味,牲畜一般不采食,若误食其种子或全草后则会发生慢性中毒,干枯后毒性减弱[13]。林源等[14]研究发现,引起披针叶黄华中毒的主要成分是喹诺里西啶生物碱(Quinolizidine)类[15],其中广泛存在的有黄花碱(Thermopsine)、金雀花碱(Cytisine)[16]等。
植物内生真菌(endophytic fungi)是指生活史部分或者全部寄存在植物体内的各个组织或者器官内,生存状况良好,并且没有引起任何感染的真菌[17]。这些内生真菌具有促进植物生长发育,提高植物抗逆性的作用[18],其次生代谢产物拥有多种结构类型(如生物碱、聚酮、萜类等)[19],有抗肿瘤、抗氧化性、抗菌等功能[20],在医药、农业、环境保护等方面广泛应用[21]。因而,植物内生真菌中的活性代谢产物为抗生素、抗癌药物及农药的研究与开发提供了重要研究方向,同时也具有重要的经济价值[22]。刘建利等[23]从苦豆子植物中分离出多种内生真菌,其叶最多,茎次之,根最少,优势菌属为链格孢属(Alternariasp.)、枝梗茎点霉属(Dendrophomasp.)。孙璐等[24]从毛序棘豆中分离的内生真菌中茎最高,根次之,叶最少,链格孢属(Alternariasp.)、镰孢霉属(Fusariumsp.)为优势菌属。但目前有关披针叶黄华内生真菌的种类及种群分布情况尚不清楚。
鉴于此,本试验采用表面消毒法分离披针叶黄华内生真菌,运用形态学和5.8S rDNA-ITS序列分析进行内生真菌种属鉴定,探讨披针叶黄华内生真菌的种类及种群分布特点,可为披针叶黄华内生真菌次生代谢产物的开发与利用提供重要参考依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 试验所用的披针叶黄华新鲜植物样本(包含根、茎、叶和种子),于2020年7月在青海省湟中县(东经101°17′18″,北纬37°16′26″,海拔3216.6 m)采集,干燥处理后,实验室保存备用。
1.1.2 主要试剂 2%NaClO、葡萄糖(广东光华);无水乙醇(成都克隆);琼脂粉、苯酚(北京索莱宝);氯仿(西陇科学);中性树胶(国药集团);植物基因组DNA提取试剂盒(北京天根);真菌通用引物ITS 1和ITS 4(西安热默尔);75%乙醇(山东安捷);巯基乙醇;Hieff Canace®Gold高保真DNA聚合酶;马铃薯葡萄糖琼脂培养基(PDA):琼脂(20 g·L-1),马铃薯(200 g·L-1),葡萄糖(20 g·L-1)和无菌去离子水等。
1.1.3 主要仪器 恒温培养箱(中仪国科);冷冻离心机(德国Sigma);TG16A台式高速离心机(上海卢湘);BGP Power 600通用电泳仪(北京天诚);超净台(苏州净化);高压蒸汽灭菌锅(上海博讯);PCR基因扩增仪(美国Biorad);冰箱(TCL);光学显微镜(厦门麦克奥迪);水浴锅(天津泰斯特)。
1.2 方法
1.2.1 植物样品的表面消毒 首先将洗净的披针叶黄华植物组织剪成3 cm左右的小段,用无菌去离子水浸泡2~3 h,在超净台中按照以下步骤进行表面消毒处理:75%乙醇消毒30 s,无菌水漂洗1 min,2%NaClO消毒2 min(NaClO为消毒作用较强的试剂,其消毒时间需要根据不同组织性质作适度调整,并通过试验筛选出最适的消毒时间),无菌水漂洗1 min, 重复操作4次。
1.2.2 披针叶黄华内生真菌的分离与纯化 用菌丝尖端切割法[25]对披针叶黄华植物内生真菌进行分离纯化,并将纯化菌株培养、编号并计算分离率(isolation rate,IR),用于判断披针叶黄华各组织部位(根、茎、叶和种子)内生真菌浸染的程度。
1.2.3 披针叶黄华内生真菌的形态学鉴定 参考孙璐等[24]对植物内生真菌的形态学鉴定的方法,对该植物进行鉴定。
1.2.4 披针叶黄华内生真菌的基因组DNA提取与5.8S rDNA-ITS序列分析 按照植物基因组DNA提取试剂盒说明,提取分离纯化的披针叶黄华菌丝DNA。然后利用PCR扩增技术对提取到的披针叶黄华内生真菌的5.8S rDNA-ITS片段进行扩增。采用20 μL反应体系:真菌通用引物ITS 1和ITS 4各1 μL,DNA模板1 μL, Hieff Canace®Gold高保真DNA聚合酶10 μL,ddH2O 7 μL。反应条件:94 ℃预变性5 min;94 ℃变性20 s,55 ℃ 退火20 s,72 ℃延伸1 min,重复上述操作33次;72 ℃终延伸10 min;最后4 ℃保温。反应结束后,将纯化的产物送至杨凌奥科公司进行测序。
1.2.5 内生真菌的系统进化分析 将内生真菌对应的序列输入NCBI的DNA数据库进行BLAST比对,挑选出吻合度最高的序列,在MEGA 7.0软件中构建系统发育树(所用方法为邻接法,自展次数为1 000次),根据系统发育进化树中组群亲缘关系对菌株进行分类。
2 结 果
2.1 内生真菌分离
以2%NaClO的消毒时间为时间梯度,对披针叶黄华植物组织进行表面消毒,得出以下结果:披针叶黄华不同组织适宜的消毒时间有所不同,根的消毒时间主要集中在2和2.25 min;茎的消毒时间在1.50、1.75和2.00 min;叶的消毒时间在1.50、1.75和2.00 min; 种子的消毒时间在2.00和2.25 min。而印记对照平板中,消毒时间为1.00和1.25 min的均被污染;消毒时间为1.75和2.00 min的分离到的内生真菌菌落总数最多。
2.2 披针叶黄华内生真菌形态学鉴定
将纯化菌珠的菌落特征与菌丝特性的观察结果与《真菌鉴定手册》[26]进行比较,初步鉴定试验中从披针叶黄华各组织样品分离出的内生真菌。
青霉属(Penicilliumsp.)是披针叶黄华的优势菌属,其菌落特征为菌落形状规则,背面黄色,表面颜色由外向里依次为白色、淡黄色、墨绿色,该菌生长速度为2.4 mm·d-1。菌丝特征为菌丝淡黄色,顶端尖细,有隔膜,分支(图1A1、A2);弯孢霉属(Curvulariasp.)是生长速度最快的菌属,其菌落特征为菌落灰绿色,边缘呈白色毛絮状整齐,背面墨绿色,疏松菌丝气生生长,生长速度为17.5 mm·d-1。菌丝特征为菌丝灰绿色,分支,有隔膜(图1B1、B2)。
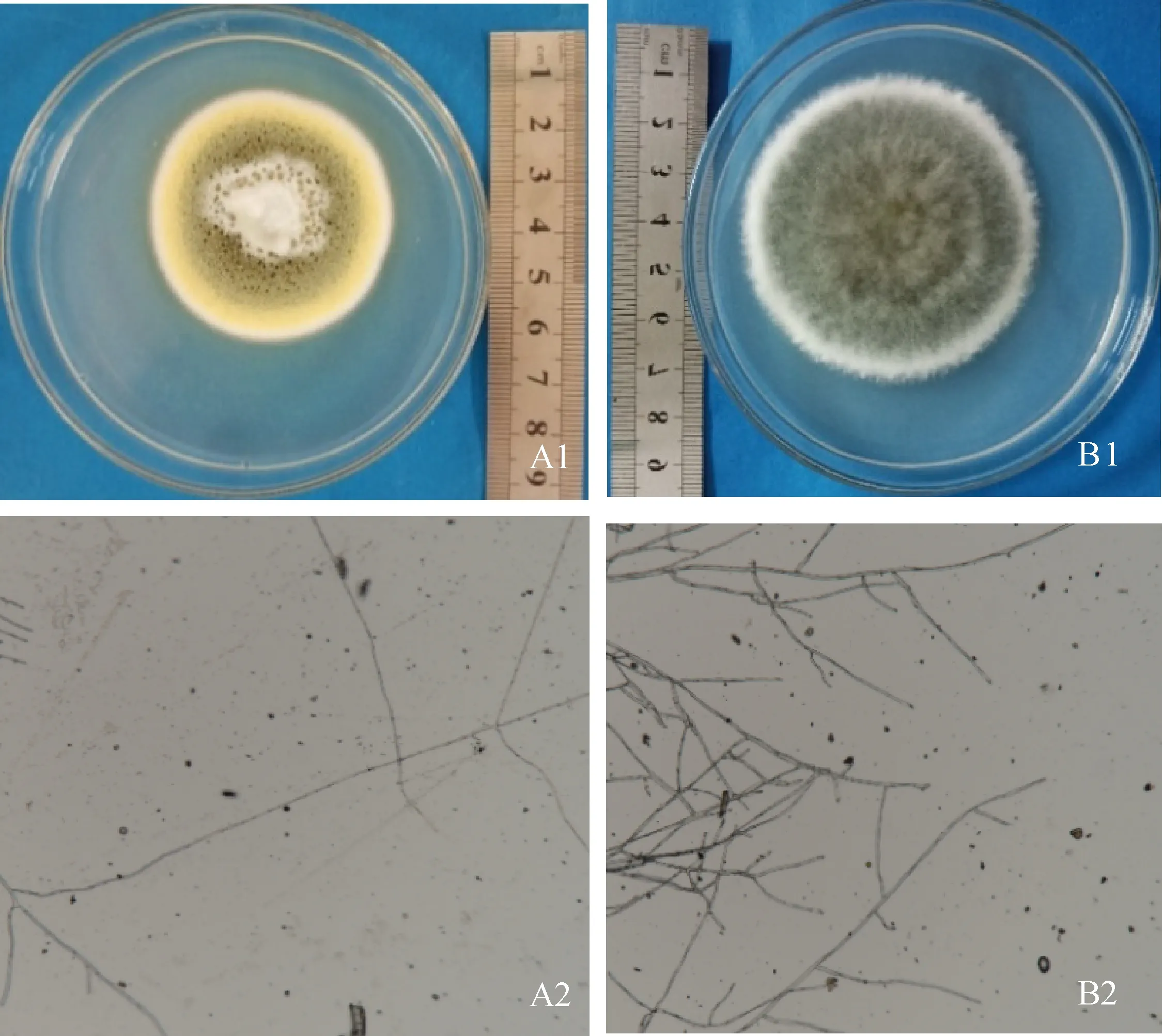
A.青霉属;B.弯孢霉属A. Penicillium sp.; B. Curvularia sp.图1 披针叶黄华典型内生真菌菌落及菌丝形态Fig.1 Typical colonies and mycelium morphology of endophytic fungi in Thermopsis lanceolata
2.3 内生真菌种属鉴定
将分离到的菌株序列在NCBI的DNA数据库中进行BLAST比对,得出的结果在《真菌鉴定手册》中查询从而确定种属,具体结果如表1所示。从披针叶黄华各组织中共分离获得29种内生真菌,分属于7纲、9目、11科、12属,其中6种未定属。

表1 披针叶黄华内生真菌鉴定结果
2.4 内生真菌在不同组织分布特点
将鉴定的结果整理并计算出不同菌属在不同组织的相对分离频率(表2)。结果显示,披针叶黄华内生真菌总相对分离频率为79.31%,叶的内生真菌分离率最高(41.38%),茎次之(37.93%),然后为种子(13.79%),根的最少(6.90%)。不同植物优势菌属亦有不同,叶内青霉属(Penicilliumsp.)较常见;茎内链格孢属(Alternariasp.)和节孢霉属(Arthriniumsp.)较多;种子中曲霉属(Aspergillussp.)为主;根内则仅有镰孢霉属(Fusariumsp.)。
2.5 披针叶黄华内生真菌的5.8S rDNA-ITS序列分析
使用MEGA7.0软件,将披针叶黄华内生真菌的5.8S rDNA-ITS序列构建系统进化树,具体见图2所示。由图2可以看出,分离得到的29种菌株(含有 6种未命名菌株),根据组群亲缘关系可以将除去裂褶菌属(Schizophyllumsp.)剩余的菌株,分成种群Ⅰ(自检支持率76%)和种群Ⅱ(自检支持率98%)。细化又可将种群Ⅰ分为种群A(自检支持率58%)、种群B(自检支持率100%),将种群Ⅱ分为种群C(自检支持率83%)和种群D(自检支持率98%)。
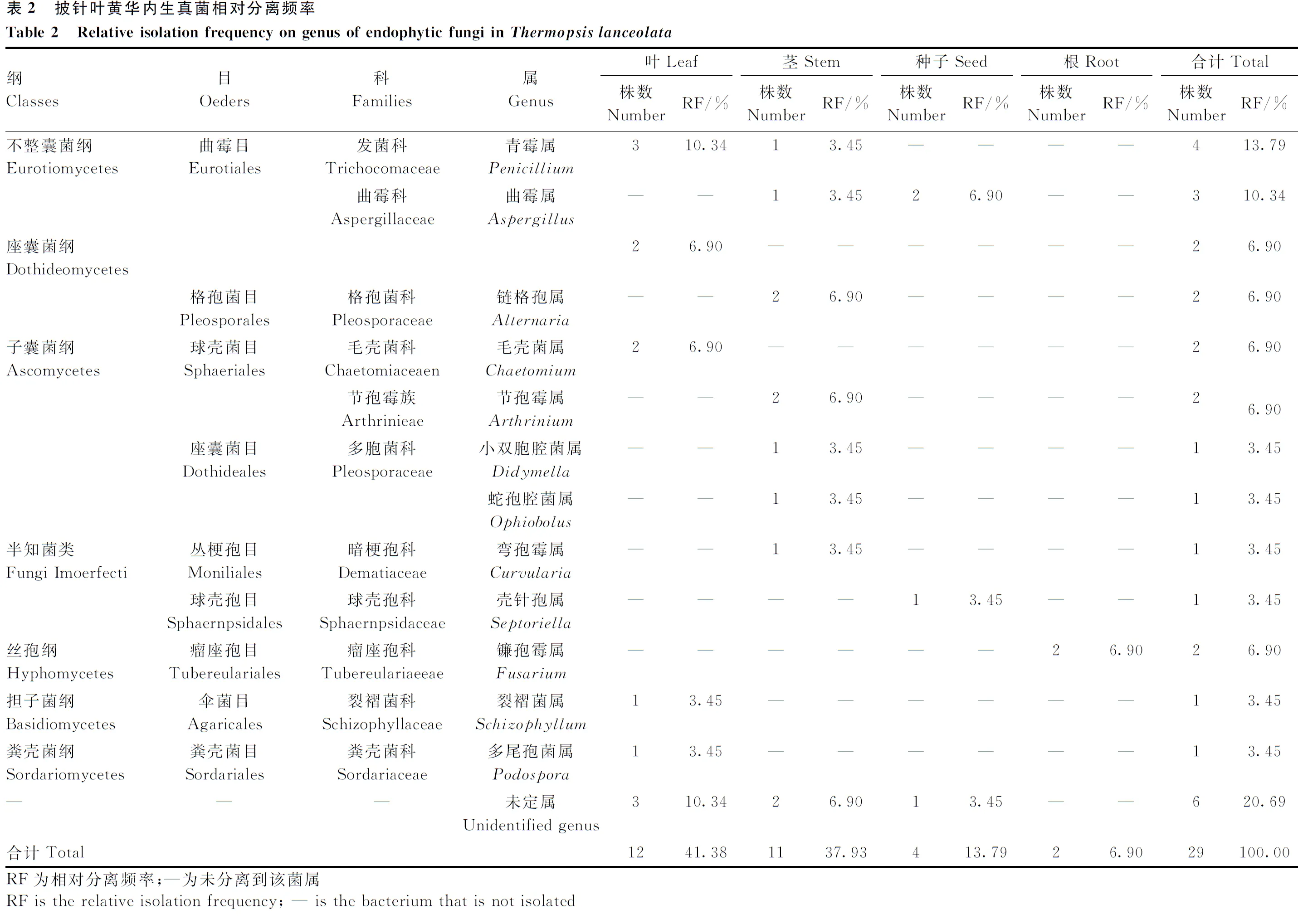
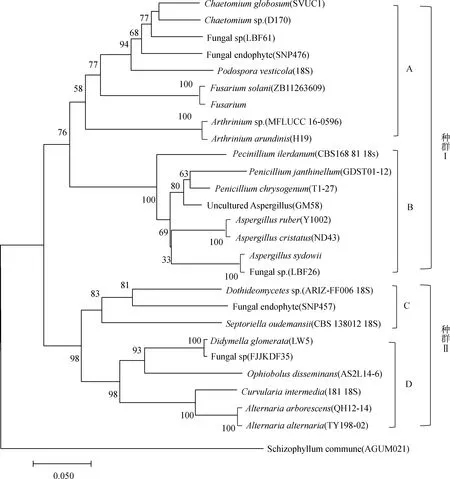
图2 基于5.8S rDNA-ITS序列由邻近法构建的系统发育树Fig.2 Phylogenetic tree constructed with the program Neighbor-joining (NJ) based on 5.8S rDNA-ITS sequences
3 讨 论
本试验采用植物表面消毒法和PDA培养基对披针叶黄华组织样品进行消毒,能够确保分离到的真菌是内生真菌,但同时也可能对组织中的真菌造成一定的影响[27]。消毒过程中,时间过短会因达不到消毒目的而导致污染,消毒时间过长则影响内生真菌分离的种类和数量,由此可见筛选最佳消毒时间尤为重要[28]。本试验将2%NaClO的消毒设定几个时间梯度进行筛选,结果显示,披针叶黄华根的最佳消毒时间为2 min,叶的最佳消毒时间为1.75 min,种子的最佳消毒时间为2.25 min,茎的最佳消毒时间为2 min。由此可见,同一植物不同部位的最佳消毒时间有所不同。
本试验表明,披针叶黄华中叶的内生真菌分离率最高,茎次之,种子和根较少。这可能是因为叶较薄且相对表面积较大而最易受到浸染,而种子硬度较高、试验中创造出的新鲜创面不足等因素造成分离率较低。关于披针叶黄华种子特性,王进等[29]研究表明,苦豆子与披针叶黄华种子的健壮度和硬实率都很高,含水量都很低且差异不显著;同时,两种豆类在宽度、厚度和相对密度上没有显著差异,故可推测两种植物的种子特性可能差异不大。余永涛[30]等从苦豆子中共分离到27株真菌,主要分布于叶、茎部位,花中较少,而种子和根部组织中始终未分离到真菌,这与本试验结果基本相似。另外,黄恩霞等[31]对藏沙蒿内生真菌分离过程中发现,花内分离到的真菌种类最多,其次是根,然后是茎,叶内分离率最低;而陈青青等[32]发现,在白芨各组织内生真菌的分离中根的分离率最高,茎次之,叶最低。以上结果与本试验中披针叶黄华内生真菌分离情况有差异,由此说明不同植物受内生真菌侵染的程度也不同。
本试验共分离出29种菌株,属于7纲、9目、11科、12属,其中,6株未定属。青霉属(Penicilliumsp.)在茎和叶中均分离出,而曲霉属(Aspergillussp.)在茎和种子中均分离出,由此可见这两种菌在披针叶黄华中定植比较广泛。披针叶黄华优势菌属—青霉属(Penicilliumsp.)属于腐生类真菌,是自然界中一类重要的分解者,可以产生结构类型丰富的活性次级代谢产物,这些次级代谢产物在抗菌、抗氧化、抗肿瘤等药物开发中发挥重要作用[33-34],而茎中发现的链格孢菌属(Alternariasp.)其发酵产物具有一定抗氧化和细胞毒的潜力,表明披针叶黄华内生真菌能产多种具有药理活性的化合物[35-36]。除此之外,在披针叶黄华中分离出的诸如小双胞腔菌属(Didymellasp.)、蛇孢腔菌属(Ophiobolussp.)、弯孢霉属(Curvulariasp.)、多尾孢菌属(Podosporasp.)等内生真菌的次生代谢产物成分及是否有药理活性化合物还需进一步深入研究。
4 结 论
经过对披针叶黄华各组织内生真菌的分离与鉴定,共发现12属29种内生真菌;在披针叶黄华各组织中,叶中分离到的内生菌种类最多,茎次之,之后为种子和根;披针叶黄华植株叶中的优势菌属为青霉属(Penicilliumsp.),其在叶和茎中均有分布。
