褪黑素对镉致鸭大脑皮质毒性损伤的保护作用
2021-11-04张文华闻双全徐明畅马勇刚顾建红刘学忠卞建春刘宗平
张文华,闻双全,王 莉,徐明畅,马勇刚,邹 辉,顾建红,刘学忠,卞建春,刘宗平,袁 燕*
(1. 扬州大学兽医学院,扬州 225009; 2.江苏高校动物重要疫病与人畜共患病防控协同创新中心,扬州 225009)
根据有毒物质和疾病登记局(ATDSR)排名,镉(cadmium,Cd)作为毒性排名第7的重金属,广泛存在于自然环境中,可通过多种途径进入人体。并因其极长的生物学半衰期和很低的排泄速率,可在机体多种器官组织内长期蓄积,诱发肝毒性、肾毒性以及神经毒性等[1]。越来越多的证据表明,镉暴露可能是某些神经系统疾病(包括嗅觉障碍、记忆障碍和阿尔茨海默病)的重要诱因之一[2],虽然镉所致神经毒性的具体机制尚不清楚,但有研究表明,氧化应激及炎症与其密切相关。作为氧化应激敏感的转录因子之一,核因子 NF-E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)能够在机体对抗氧化应激的过程中发挥重要作用。在生理条件下,大部分 Nrf2 在细胞质中处于非活动状态;但当受到氧化应激刺激时,Nrf2可发生核转位(由细胞质进入细胞核)并调节相关抗氧化基因的转录[3]。炎症反应一般由炎症因子介导,研究表明,镉能显著上调炎症调节因子和炎症因子,呈现出明显的致炎特性[4],但对于镉导致炎症的具体机制尚不清楚。
褪黑素(N-acetyl-5-methoxytryptamine,melatonin)是一种吲哚类激素,除了人体松果体之外,视网膜、小肠和皮肤也能大量合成褪黑素。最近研究表明,褪黑素除了具有调节生物节律功能之外,还具有多种生物学功能,包括抗氧化、抗炎和抗凋亡等[5]。研究发现,褪黑素在镉诱导的肝损伤[6]、骨损伤[7]、卵巢损伤[8]中都有显著的保护作用,但目前关于褪黑素对镉毒性的影响研究主要集中在哺乳动物上,而对禽类研究报道较少。本试验以鸭大脑皮质为研究对象,从氧化损伤和炎症角度研究镉对鸭脑的毒性作用机制及褪黑素的保护效应,为进一步提高对镉毒性作用的认识,以及预防和治疗镉中毒提供理论依据。
1 材料与方法
1.1 试验动物
20日龄高邮鸭16只,由江苏省苏邮鸭场提供。
1.2 主要试剂
褪黑素购自上海麦克林生化科技有限公司;丙二醛(MDA)、总抗氧化能力(T-AOC)检测试剂盒购自南京建成生物工程研究所;肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)检测试剂盒购自上海酶联生物科技有限公司;抗Nrf2抗体购自日本MBL公司,抗β-actin、HO-1、Histone H3单克隆抗体购自CST公司;二抗购自美国Jackson公司;BCA蛋白浓度测定试剂盒、胞浆与核蛋白抽提试剂盒购自碧云天生物技术有限公司;氯化镉(CdCl2)购自国药集团化学试剂有限公司。
1.3 动物分组与处理
将16只20日龄高邮鸭随机分为4组,分别为对照组(Con)、褪黑素组(Mel)、镉组(Cd)、镉与褪黑素共处理组(Cd+Mel),每组4只。各组鸭按以下方式进行处理:对照组鸭自由采食饮水;褪黑素组鸭自由采食,同时每天自由饮用含有0.2 mg·L-1褪黑素的水;镉组鸭自由饮水,同时每天自由采食拌有2 mg·kg-1氯化镉的饲料;镉与褪黑素共处理组鸭每天自由饮用含有0.2 mg·L-1褪黑素的水,同时自由采食拌有2 mg·kg-1氯化镉的饲料,持续60 d。试验结束后,颈动脉放血处死并摘取鸭大脑皮质,部分固定于4%多聚甲醛内用于制作石蜡切片,其余部分置于冻存管内,标记,于-80 ℃保存备用。
1.4 试验方法
1.4.1 测定氧化损伤相关指标 按照南京建成生物工程研究所提供的试剂盒说明书测定鸭大脑皮质中MDA和T-AOC的水平。
1.4.2 测定炎症相关指标 按照上海酶联生物提供的ELISA试剂盒说明书检测鸭大脑皮质中TNF-α、IL-1β的含量。
1.4.3 免疫组化染色 石蜡切片经二甲苯脱蜡、乙醇复水后,在柠檬酸盐缓冲液中煮沸,用抗原修复缓冲液处理。然后用3% H2O2孵育,去除内源过氧化物酶,在室温下用山羊血清封闭1 h,抗Nrf2抗体(1∶200稀释)4 ℃孵育过夜,二抗室温孵育2 h,然后用DAB显色液处理,正置荧光显微镜观察并拍照。
1.4.4 Western blot法检测Nrf2和HO-1蛋白表达量 称取鸭大脑皮质并加入适量的裂解液和蛋白酶抑制剂,然后用电动研磨器在冰上充分研磨制备成匀浆,置于冰上30 min后超声使其进一步裂解,然后4 ℃,12 000 r·min-1离心10 min,取上清,即为总蛋白。按照碧云天生物技术有限公司提供的胞浆与核蛋白抽提试剂盒说明书提取核蛋白。BCA法测定蛋白浓度并调整至相同浓度后加SDS-PAGE Loading Buffer,沸水煮10 min。用10% SDS-PAGE胶100 V恒压电泳90 min,250 mA恒流90 min转印至PVDF膜,5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,ECL发光显色。用Image J软件进行灰度值分析,以Histone H3为内参计算核Nrf2相对蛋白表达量,以β-actin为内参计算HO-1相对蛋白表达量。
1.5 数据分析
应用SPSS 26.0统计软件对数据进行显著性t检验和单因素方差(one-way ANOVA)分析,结果以“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 镉与褪黑素对鸭大脑皮质中MDA含量的影响
结果如图1所示,与对照组相比,镉组鸭大脑皮质MDA含量极显著升高(P<0.01);与镉组相比,镉与褪黑素共处理组鸭大脑皮质MDA含量显著降低(P<0.05);对照组、褪黑素组、镉与褪黑素共处理组之间鸭大脑皮质MDA含量无显著差异(P>0.05)。
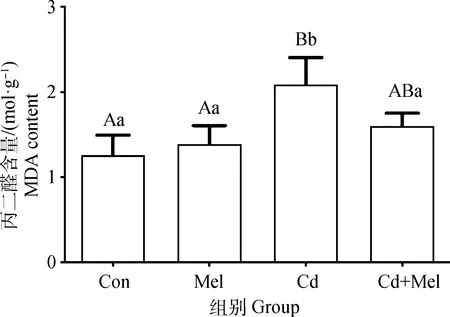
标有不同大写字母表示差异极显著(P<0.01),标有不同小写字母表示差异显著(P<0.05),标有相同小写字母表示无显著差异(P>0.05),下同Results marked with different uppercase letters indicate extremely significant difference (P<0.01), different lowercase letters indicate significant difference (P<0.05), while same lowercase letters indicate no significant difference (P>0.05). The same as below图1 镉与褪黑素对鸭大脑皮质中MDA含量的影响Fig.1 Effect of cadmium and melatonin on MDA content in cerebral cortex of duck
2.2 镉与褪黑素对鸭大脑皮质中T-AOC水平的影响
结果如图2所示,与对照组相比,镉组鸭大脑皮质T-AOC水平极显著降低(P<0.01);与镉组相比,镉与褪黑素共处理组鸭大脑皮质T-AOC水平显著升高(P<0.05);对照组、褪黑素组、镉与褪黑素共处理组之间鸭大脑皮质T-AOC水平无显著差异(P>0.05)。
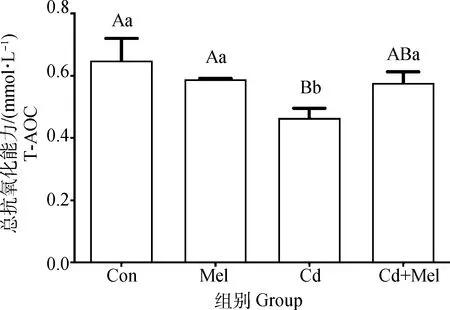
图2 镉与褪黑素对鸭大脑皮质中T-AOC水平的影响Fig.2 Effect of cadmium and melatonin on T-AOC level in cerebral cortex of duck
2.3 镉与褪黑素对鸭大脑皮质中TNF-α含量的影响
结果如图3所示,与对照组相比,镉组鸭大脑皮质TNF-α含量极显著升高(P<0.01);与镉组相比,镉与褪黑素共处理组鸭大脑皮质TNF-α含量极显著降低(P<0.01);对照组、褪黑素组、镉与褪黑素共处理组之间鸭大脑皮质TNF-α含量无显著差异(P>0.05)。

图3 镉与褪黑素对鸭大脑皮质中TNF-α含量的影响Fig.3 Effect of cadmium and melatonin on TNF-α content in cerebral cortex of duck
2.4 镉与褪黑素对鸭大脑皮质中IL-1β含量的影响
结果如图4所示,与对照组相比,镉组鸭大脑皮质IL-1β含量极显著升高(P<0.01);与镉组相比,镉与褪黑素共处理组鸭大脑皮质IL-1β含量极显著降低(P<0.01);对照组、褪黑素组、镉与褪黑素共处理组之间鸭大脑皮质IL-1β含量无显著差异(P>0.05)。
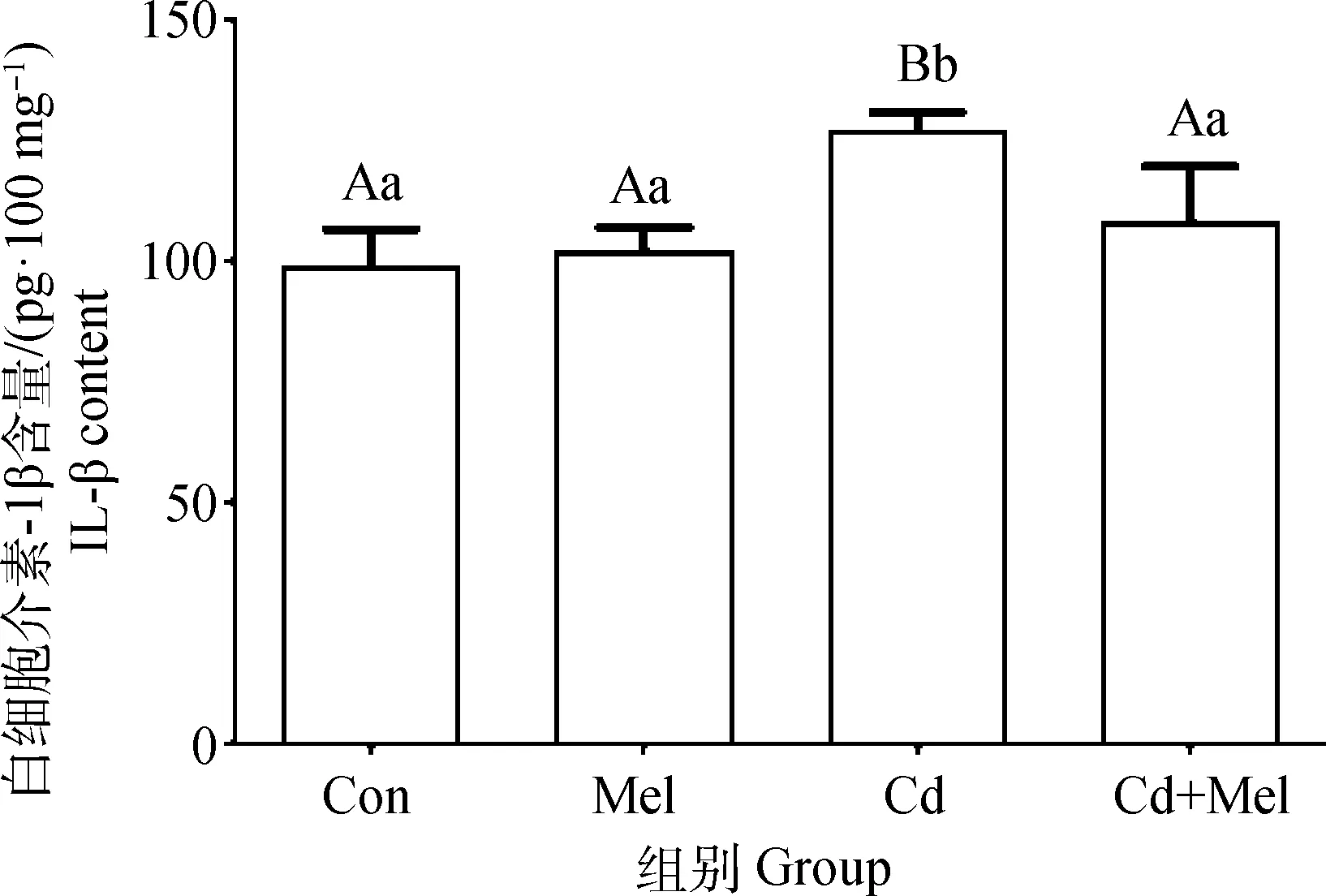
图4 镉与褪黑素对鸭大脑皮质中IL-1β含量的影响Fig.4 Effect of cadmium and melatonin on IL-1β content in cerebral cortex of duck
2.5 镉与褪黑素对鸭大脑皮质中Nrf2核转位的影响
结果如图5所示,对照组、褪黑素组鸭大脑皮质细胞Nrf2无明显核转位现象,镉组鸭大脑皮质细胞发生明显Nrf2核转位(蓝色箭头),镉与褪黑素共处理组鸭Nrf2核转位现象有所减少。

图5 镉与褪黑素对鸭大脑皮质中Nrf2核转位的影响(1 000×)Fig.5 Effect of cadmium and melatonin on Nrf2 nuclear translocation in cerebral cortex of duck(1 000×)
2.6 镉与褪黑素对鸭大脑皮质中Nrf2及HO-1蛋白表达量的影响
结果如图6所示,与对照组相比,镉组鸭大脑皮质Nrf2及HO-1蛋白表达量均极显著升高(P<0.01);与镉组相比,镉与褪黑素共处理组鸭大脑皮质Nrf2及HO-1蛋白表达量均极显著降低(P<0.01);对照组、褪黑素组、镉与褪黑素共处理组之间鸭大脑皮质Nrf2及HO-1蛋白表达量无显著差异(P>0.05)。

图6 镉与褪黑素对鸭大脑皮质中Nrf2和HO-1蛋白表达量的影响Fig.6 Effect of cadmium and melatonin on Nrf2 and HO-1 protein expression in cerebral cortex of duck
3 讨 论
许多研究已经阐明了镉诱导的组织或细胞毒性的机制。其中,由过量的活性氧(ROS)或活性氮导致的抗氧化系统损伤被认为是镉导致神经系统损伤最重要的机制。ROS具有高反应活性,并在其附近攻击各种类型的生物分子,包括蛋白质、DNA和脂质,ROS与脂质的特殊反应通常称为“脂质过氧化”。MDA是公认的氧化应激(即脂质过氧化)标志物,测定 MDA的量常常可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度[9]。T-AOC可间接反映机体清除氧自由基的能力,从而判断机体的综合抗氧化能力。闻双全等[10]研究发现,镉暴露可使大鼠大脑皮质中MDA含量升高,T-AOC水平降低;张萌萌[11]研究发现,鸭采食添加4 mg·kg-1镉的日粮120 d,其脾中MDA含量升高,脾发生明显病理组织学变化。本研究发现,自由采食含2 mg·kg-1CdCl2饲料60 d可使鸭大脑皮质中MDA含量升高,T-AOC水平降低,与上述结果一致,说明镉可导致鸭大脑皮质氧化损伤,降低其抗氧化能力,但本试验鸭大脑皮质HE染色切片并未发现明显病理学损伤(结果未展示),可能与所用镉浓度较低及试验周期较短有关。据报道,Nrf2与氧化应激密切相关,在正常状态下,Nrf2 以 Keap1-Nrf2 异二聚体的形式存在于细胞质中,同时 Keap1 与泛素化连接酶结合,对 Nrf2 的泛素化与降解产生促进作用[12]。当 ROS 刺激机体时,Nrf2与 Keap1解离,并迅速进入细胞核发挥其转录激活因子的功能,启动下游靶基因的转录表达[13-14]。HO-1 是Nrf2的下游靶基因之一,也是一个限速酶,由于它能降低血红素中的一氧化碳、铁元素、胆红素的衍生物,使得它能够参与氧化应激的保护过程[15]。Tang等[16]用CdCl2给SD大鼠染毒8周后取其脑组织进行试验,发现镉暴露可使脑组织Nrf2由细胞浆向细胞核转移,其蛋白表达量显著升高;何刘等[17]发现,用镉给大鼠灌胃30 d后,其睾丸中Nrf2 mRNA水平显著升高。本研究发现,镉暴露可使鸭大脑皮质Nrf2发生核转位,使核Nrf2蛋白表达量升高并上调HO-1蛋白表达量,说明镉暴露可激活Nrf2信号通路,使机体进行应激性的抗氧化反应。
炎症是机体对致炎刺激的一种防御反应,镉虽不是感染性因素,但研究表明,其可导致多组织器官炎症。TNF-α、IL-1β是典型的促炎细胞因子,可诱发慢性炎症。Almeer等[18]研究发现,小鼠腹腔注射CdCl27 d后,大脑皮质中TNF-α、IL-1β含量均升高;Li等[19]研究发现,采食含有CdCl2的日粮可导致鸡肝中TNF-α、IL-1β mRNA水平升高。本试验发现,镉暴露可使鸭大脑皮质中TNF-α、IL-1β含量升高,说明镉可诱导鸭大脑皮质中炎症因子的释放。
褪黑素作为机体的一种内源性神经激素,除了调节人体生物钟外,其在机体的多个系统中有重要作用。很多研究表明,褪黑素对镉暴露所致的多器官毒性具有保护作用,Shagirtha等[20]发现,褪黑素可缓解氧化应激从而减轻镉所致的大鼠神经毒性;Eybl等[21]研究发现,褪黑素预处理可缓解镉暴露所致的大鼠肝氧化损伤;Li等[22]发现,褪黑素对急性镉暴露所致的小鼠睾丸氧化应激和炎症具有保护作用。本研究发现,褪黑素不仅可显著抑制镉暴露所致的大脑皮质组织中MDA含量升高、T-AOC水平降低,而且还可抑制Nrf2核转位及因核转位所致的核Nrf2与HO-1蛋白表达量的升高,说明褪黑素可减轻镉所致的脂质过氧化作用,缓解大脑皮质氧化损伤;此外,褪黑素还缓解了镉导致的鸭大脑皮质中TNF-α和IL-1β含量升高,说明褪黑素减轻了镉诱导的鸭大脑皮质中炎症因子的释放。
4 结 论
综上所述,本研究表明镉暴露可使鸭大脑皮质中MDA、TNF-α、IL-1β含量升高,T-AOC水平降低,而且可使Nrf2核转位并上调核Nrf2与HO-1蛋白表达量,导致大脑皮质发生氧化损伤并诱导炎症因子的释放;褪黑素对镉所致的鸭大脑皮质毒性损伤有一定保护作用。
