基因芯片技术在晋南牛种公牛选育中的应用
2021-11-04王宏浩任小康高会江车雷杰
王宏浩,任小康,张 毅,高会江,车雷杰,王 曦*
(1.山西农业大学动物科学学院,太原 030032; 2.中国农业大学动物科技学院,北京 100193;3.国家肉牛遗传评估中心,北京 100193; 4.运城市国家级晋南牛遗传资源基因保护中心,运城 044000)
晋南牛是我国优秀的地方黄牛品种,为我国黄牛五大地方品种之一[1]。晋南牛体型高大粗壮,肌肉发达,前躯和中躯发育良好,耐热、耐苦、耐劳、耐粗饲,其饲料利用率和屠宰率均表现优异,具有良好的肉用性能,是向专门化肉牛品种方向选育潜力较大的地方黄牛品种之一[2]。但随着外来品种的不断引进及与本地黄牛杂交,致使晋南牛群体数量急剧下降[3]。因此,对晋南牛开展科学的保种十分必要。
基因芯片技术的发展是典型的多学科互作和多种新技术应用的结果,目前已在多个领域内被证实高效简便,特别是在基因表达和基因诊断方面都已表现出很大的效用[4]。2009年,第一款用于牛基因组检测的芯片Bovine 50K SNP诞生,推动芯片技术在基因组学方面的广泛应用[5]。近年来,随着基因分型技术的日益成熟,越来越多的基因芯片被开发并用于肉牛的育种中。为了提高基因芯片对育种值估计的准确性,研究人员结合相关性状的表型数据进行位点分析[6]。Gao等[7]对海福特与安格斯牛的采食效率性状候选基因进行了注释,找出63个与该性状相关的SNPs位点,这些位点可用于后期基因芯片的设计,提高育种值估计准确率。因此,基因芯片技术将改变传统的育种工作模式,使得畜禽遗传育种工作变得高效、简单、快速、精确[8]。
本研究对种公牛全基因组进行基因芯片检测,应用基因芯片数据对晋南牛群体与其它群体之间进行遗传聚类分析,包括Structure分析、PCA分析以及NJ树分析[9-10],同时对晋南牛后备公牛进行遗传评估,以期进行分子水平辅助选育,加快晋南牛向肉用型品种方向发展,不断提高晋南牛的生产性能。
1 材料与方法
1.1 试验材料
分别采集荷斯坦牛、利木赞牛、西门塔尔牛、延边牛、和顺肉牛各10头及25头晋南牛血液2 mL,冰盒中运输,保存于-20 ℃冰箱,用于DNA提取;自晋南牛保种场采集25头晋南牛后备公牛体尺及生长性能数据。
1.2 不同牛品种的基因型检测
用天根血液基因组DNA提取试剂盒提取基因组DNA,用AstraGeneAstraNet核酸分析仪测定DNA浓度和纯度,根据DNA芯片杂交平台的要求,合格的DNA浓度须大于50 ng·μL-1,OD260 nm/OD280 nm指标范围为1.6~2.0,OD260 nm/OD230 nm指标范围为1.8~2.1。为确保DNA的浓度,每一个提取的样本DNA连续测定3次,取平均值,不合格的样本需要浓缩或者重新提取DNA,直至样本的浓度和纯度都满足后续分型试验的要求。
待DNA样品全部合格后,由上海纽勤生物科技有限公司用Illumina Ovine SNP 50K芯片进行分析获得SNP分型数据。
采用Genome Studio软件对数据进行筛选并对SNP等位基因频率进行分析,剔除所有未定位的SNPs位点,用Plink软件进行质量控制。质量控制的标准为:检出率大于0.9,最小等位基因频率大于0.01,哈迪温伯格平衡P值大于0. 000 001。
1.3 不同牛品种间的遗传聚类分析
在聚类分析之前,用Plink软件中的indep-pairwise选项删除连锁紧密的SNPs位点(参数设置为:窗口值为25个SNPs,一个步长为5个SNPs,R2的阈值设置为0.05)。基于Illumina 50K SNP芯片数据,采用聚类法和主成分分析法研究了晋南牛与部分其它中国牛品种的遗传关系。PCA(principle component analysis)即主成分分析,将多因素经转换,变为少数几个起主要作用的因素,这些因素也称主成分,一般取前3个主成分,此时的前3个主成分所解释的变异最多,使用R语言的snpstats包分析。运用STRUCTURE 2.3.4软件构建群体结构,有6个群体用于Structure分析,每两条加粗黑线之间的个体来自同一群体。K=n(n=2、3)将6个 群体划分为n类,同时n也代表了颜色的种类,不同颜色代表了所含血统比例。
1.4 不同牛品种间的NJ分析
基于个体全基因组标记,采用个体聚类的方法构建邻接树(neighbor-joining tree, NJ树)。NJ树的构建使用MEGA 7.0.21进行。
1.5 晋南牛个体间的基因组亲缘关系估计
基于Illumina 50K全基因组标记检测结果,估计25个样本间的基因组亲缘关系。采用Purcell提出的矩量法(the method of moments,MoM)估计等位基因同源相同概率(identity by descent,IBD),进而计算个体基因组亲缘系数。如果是基因组完全相同的个体,亲缘系数接近1,全同胞和亲子关系接近0.5,半同胞及直系祖孙关系约为0.25。
1.6 晋南牛育种值估计
依据测得的原始数据及参数文件,运用Genomestudio软件对基因数据进行分型,得到验证群体初级基因型文件Full Data Table。然后选择胴体性状作为目标性状与西门塔尔牛资源群原始数据比对SNP位点,以这些共有位点进行分析,胴体重作为表型数据,进行BLUP,得到参考群体的个体育种值,同时得到每个位点的效应值数据,计算所用软件为Plink和BayesB。然后,利用参考群体的位点效应值数据及验证群体的基因型文件,对验证群体(晋南牛、西门塔尔牛)分别进行育种值估计,输出结果,计算所用软件为Plink。
2 结 果
2.1 不同牛品种间PCA分析
为研究荷斯坦牛、利木赞牛、西门塔尔牛、延边牛、和顺肉牛及晋南牛品种之间的遗传结构,首先做PCA分析(图1),不同颜色的点代表不同的群体,蓝色代表荷斯坦牛,红色代表延边牛,紫色代表利木赞牛,灰色代表晋南牛,绿色代表西门塔尔牛,粉色代表和顺肉牛。PC1轴可以将6个群体分为两类,即荷斯坦牛为一类,其余5个群体为一类。PC2轴进一步将延边牛、晋南牛分为一类,利木赞牛、西门塔尔牛、和顺肉牛分为一类。
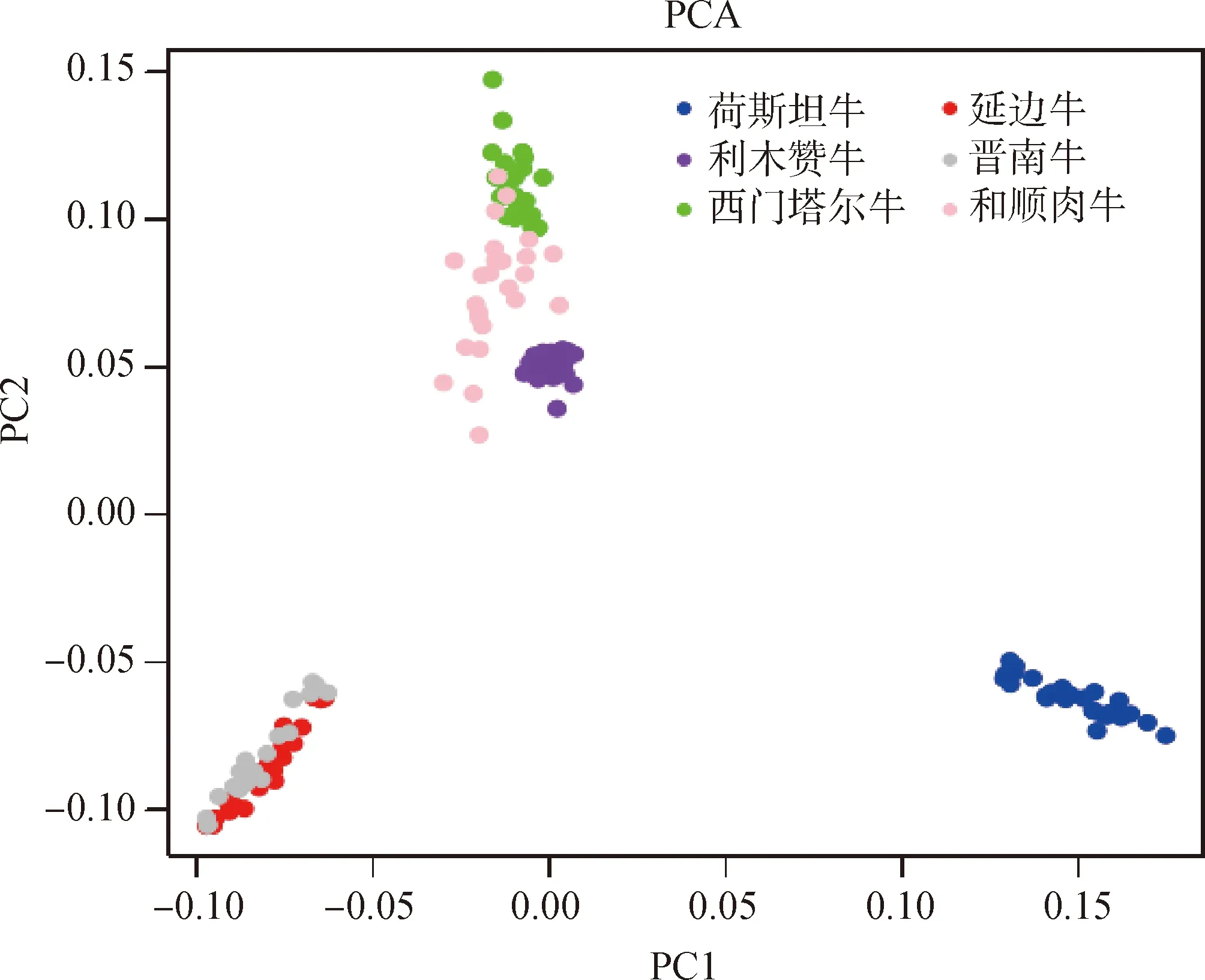
图1 主成分(PC)1、2对试验个体进行聚类的散点图Fig.1 Scatter diagram of principal component (PC) 1 and 2 clustering test individuals
2.2 不同牛品种间Structure分析
每两条加粗黑线之间的个体来自同一群体,在本研究中共有6个群体用于Structure分析,经过计算得出最佳的K值为3。
K=n(n=2、3)将6个群体划分为n类,同时n也代表了颜色的种类,不同颜色代表了所含血统比例。当K=2时,6个群体可以划分为两个亚群,即荷斯坦牛为一亚群,其余5个群体为另一亚群。当K=3时,6个群体可以划分3个亚群,即荷斯坦牛为一亚群,利木赞牛、西门塔尔牛和和顺肉牛为同一亚群,晋南牛、延边牛为同一亚群(图2)。

图2 6个牛品种K=2~3时的Structure结果Fig.2 Population Structure result of 6 cattle breeds with K=2-3
2.3 不同牛品种间NJ分析
NJ图中的同一种颜色代表同一个群体,每个群体应单独成一簇,而西门塔尔牛和和顺肉牛并没有分开,而是在同一簇中,表明两个群体之间的关系非常接近。
经过聚类分析可知,荷斯坦牛与其他牛种间的血统关系相差较远;晋南牛与延边牛亲缘关系较近,但仍旧可以区分为单独种群;而利木赞牛、西门塔尔牛和和顺肉牛中,利木赞牛在PCA分析中可以与其他牛种分出差距,但是西门塔尔牛和和顺肉牛始终无法分离,证明它们之间关系较近(图3)。
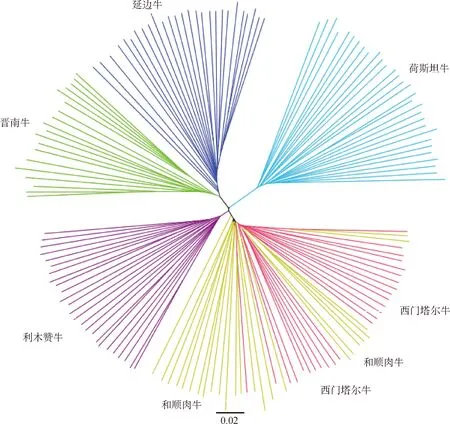
图3 6个牛种的NJ树Fig.3 Neighbor joining(NJ) tree for 6 cattle breeds
2.4 SNP检测晋南牛间亲缘关系
本研究共获得33 200个SNPs标记,对比不同公牛间等位基因的差异,计算其亲缘系数。不同公牛对应关系如图4所示。
在热图(图4)中,白色的方块表示对应的两个个体间根据计算具有亲缘关系,方块越亮说明亲缘关系越接近,从检测结果及图示中可以看出,JN01、JN03、JN05号为同一个家系, JN02、JN06、JN07、JN08、JN09、JN14、JN17、JN18、JN20、JN24、JN25为同一个家系,JN04、JN23、JN15为同一个家系,JN16、JN19为同一个家系,JN21、JN22为同一个家系,其余个体之间近交系数小。
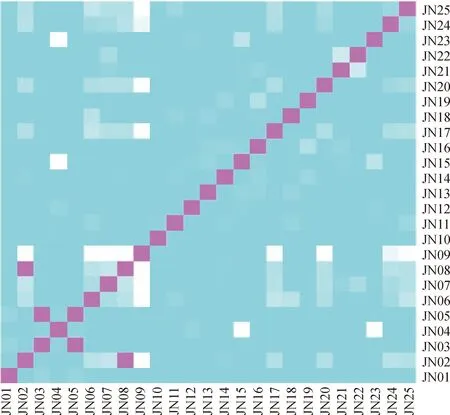
图4 晋南牛个体间亲缘关系热图Fig.4 Heat map of kinship among individuals of Jinnan cattle
因此在选择公牛过程中,尽可能在同一个家系中仅选择一头公牛,这样不仅可以避免近交,而且可以有效的保存晋南牛的全部基因组,有效的提高晋南牛保种的效率。
2.5 晋南牛种公牛遗传评估
利用Genomestudio软件对基因数据进行分型,得到50个个体的初级基因型文件Full Data Table,共54 610个 SNPs位点,该样本群体作为验证群体。对参考群体和验证群体的SNP位点进行查找,找到36 012个共有位点,以这些共有位点为基础进行分析,估计出育种值。
“倍数性状标准差”的顺序排名可以对公牛的胴体重进行评估排名,计算结果如表1所示。
从基因组的角度来看,JN23的胴体重倍数性状标准差最大,从基因组水平可以选择作为肉用种公牛。
倍数性状标准差是一个可以推算育种值的没有单位的数值,其大小可以反映胴体重育种值的大小,因此,其数值的大小可以反映牛的遗传潜力,对公牛进行很好的遗传评估,负值说明其胴体重性状遗传潜力底于平均水平。
2.6 晋南牛遗传疾病检测
根据芯片数据,对牛瓜氨酸血症(citrullinemia,CN)、尿苷酸酶缺乏症(deficiency of uridine monophophate synthase,DUMPS)、红细胞生成性卟啉症(erythropoietic protoporphyria,EPP)、凝血因子缺乏症(factor deficiency)、牛蜘蛛腿综合征(arachnomelia syndrome, AS)、白细胞粘附缺陷病(BLAD)、脊椎畸形综合征(complex vertebral malformation,CVM)、牛头犬症(bulldog,BD)、无毛症(hairless,HL)、并蹄症(mulefoot,MF)、粉齿症(pink tooth,PT)、皮肤缺陷症(imperfect skin,IS)、侏儒症(dwarfism,DF)等疾病的隐性基因没有检出。
2.7 公牛体尺、生长性能测定与分级
对公牛体尺及生长性能进行测量,并根据地方标准《晋南牛》(DB14/T810)24月龄体重等级对群体进行评价,分为特级(24月龄体重≥490 kg)、一级(450 kg ≤24月龄体重<490 kg)、二级(410 kg≤24月龄体重<450 kg)、三级(24月龄体重<410 kg)。
2.8 晋南牛综合评定
根据近交系数、遗传评估与24月龄重进行综合评定(表2),最终选择JN07、JN23、JN05、JN08、JN02、JN13、JN19、JN14为晋南牛种公牛。

表2 种公牛综合评定
3 讨 论
晋南牛作为我国五大良种黄牛之一,具有良好适应性、耐粗饲、抗病力强等特点。然而随着外来牛种的引入,加速了晋南牛被国外专门化肉牛品种的杂交改良。同时,因农业机械化水平的不断提高,晋南牛不再用于使役,以个体农户养殖为主体的养殖模式也逐渐退出历史,纯种晋南牛数量越来越少。2013年山西省农业厅对晋南牛品种进行了调研,结果表明,全省的晋南牛数量不足万头,品种保护已刻不容缓。2013牛7月3日,农业部正式授予运城市黄牛场为国家级畜禽遗传资源保种场,用于晋南牛基因保存及活体保种。
本研究应用50K牛基因组芯片检测了运城市黄牛场25头晋南牛后备公牛与荷斯坦牛、利木赞牛、和顺肉牛、延边牛、西门塔尔牛等各10头,遗传聚类分析发现,晋南牛在遗传聚类中可单独聚为一类,在遗传结构上不同于国内与国外的牛群,其种质资源独特,为晋南牛保种提供了理论支持与依据。王曦等[11]通过微卫星标记法分析了晋南牛、郏县红牛、鲁西黄牛和秦川牛的群体遗传关系,发现晋南牛在选育过程中比较封闭,与其他牛种间的血缘没有过多的交叉,具有典型的地域局限性,因此保留了群体遗传特性上的独立性。雷初朝等[12]通过mtDNA对我国8个黄牛品种进行了研究,发现在系统进化树上晋南牛可独自形成一支。这些研究均应用了现代化基因标记的聚类分析法,为畜禽资源的保种提供了理论支撑。Pham等[13]利用分子标记研究越南地方牛的遗传多样性,对6个类群从遗传结构上进行分类分群,应用于辅助保种,大大提高了效率的同时节约了成本。Utsunomiya等[14]利用AFLP遗传标记研究了西亚与南亚的瘤牛、水牛及已经灭绝的欧洲野牛牛群的遗传结构,指导牛群的保种,实现了宝贵遗传资源的延续。Acosta等[15]对古巴5个牛群的遗传结构进行了微卫星标记分析,结果表明,5个 牛群可以分成两个大群,使保种的目标更加明确有效,对于畜种的全基因组保存起到重要的科学指导作用。Armstrong等[16]利用分子标记对乌拉圭牛与美洲牛群进行了遗传结构比较,发现由于牛群的发展历史、有效群体大小的改变,遗传漂变等可能引起群体的遗传变异,最终使得乌拉圭牛有别于美洲牛,因此证明了对乌拉圭牛进行保种的重要意义。Michailidou等[17]利用基因芯片研究了两个本地西腊羊群体之间的遗传差异性,从而为保种提供了理论依据。Mdladla等[18]利用基因芯片对南非本地羊进行了群体遗传结构与连锁不平衡分析,挖掘群体间的遗传差异,为南非羊的杂交改良与遗传资源的有效利用提供了理论指导。Lwin等[19]利用50K芯片分析了缅甸5个本地牛群体及越南4个牛群体,证明了群体之间的遗传差异性,为不同区域牛的杂交改良提供了有效的依据。
本研究应用基因芯片进行晋南牛后备公牛间近交系数的计算,确定不同的家系,最终在不同家系中选择留种公牛,对晋南牛公牛进行选种及家系的建立起到了重要的辅助选择的作用。刘家鑫等[20]基于Illumina Ovine SNP50K芯片对来自10个绵羊群体共440个个体进行全基因组长纯合片段(runs of homozygosity,ROH)检测,统计ROH在不同绵羊群体中的数目、长度及频率,根据ROH计算基因组近交系数,该研究结果不仅能够反映不同绵羊群体的近交情况,还能鉴定一些与绵羊经济性状相关的基因,为绵羊标记辅助选择提供候选基因,同时也能为改进育种规划和畜禽遗传资源保种提供参考依据。Zhang等[21]利用50K芯片及测序数据研究荷斯坦奶牛,评估个体间的纯合度及近交水平,从而指导人工授精与选种选配。吴林慧等[22]利用Porcine 80K SNP芯片,通过计算亲缘系数、近交系数、连锁不平衡程度与有效群体大小等群体遗传学层面的参数,评估恩施黑猪种群结构关系,亲缘系数的计算发现,咸丰县恩施黑猪个体间平均亲缘系数为0.12,近交系数计算表明,16%的样本近交系数大于0.125,存在明显近交累积,为恩施黑猪保种与选育提供辅助。杨湛澄等[23]利用高密度SNP标记分析中国荷斯坦牛基因组近交,结果共检测到44 676个 ROH片段,其长度主要分布在1~10 Mb之间,不同长度的ROH散布于个体基因组内,短ROH较长ROH更为常见,ROH在染色体上并非均匀分布,ROH频率最高的区域为10号染色体中部。两种基因组近交系数之间相关性很高(91%以上),但基因组近交与系谱近交之间的相关性较低(低于50%)。Kim等[24]利用50K芯片对北美荷斯坦牛的研究发现,ROH在不同群体中的分布也存在一定的差异,这反映了群体的基因组特征。师睿等[25]利用SNP芯片信息评估新疆近交牛基因组纯合度,结果显示,新疆近交牛的遗传背景与哈萨克牛基本一致,近交牛基因组纯合程度明显高于其他群体,且基因纯合率越高的近交牛体型越小,在一定程度上呈现了近交衰退对体型的影响,证明近交可引起品种衰退,应用分子辅助选择可避免近交的发生[26]。
本研究应用中国肉牛遗传评估中心肉牛数据库,结合晋南牛50K芯片检测结果,对晋南牛后备公牛进行胴体重育种值评估,辅助选出育种值高的种公牛,提高了选择的准确性,同时大大节约了时间与成本,可以加快晋南牛的遗传进展。郑伟杰等[27]指出,在传统的奶牛育种中优秀种公牛需要经过后裔测定进行选择,其选择准确性高,但周期长、育种成本高、效率较低。进入21世纪以来,基于基因组高密度标记信息的基因组选择技术成为了动物育种领域的研究热点。利用基因组选择技术,不必通过后裔测定就可实现青年公牛早期准确选择,从而大幅度缩短世代间隔,加快群体遗传进展,并显著降低育种成本。自2008年始,欧美主要发达国家就将基因组选择技术全面应用于奶牛育种中,世界范围内奶牛育种工作进入了基因组选择时代。Rolf等[28]利用Illumina BovineHD基因芯片对3 240头多品种肉牛群体进行基因分型,并对6个肉质性状的基因组估计育种值进行预测,结果表明,预估准确性在0.40~0.78之间。Abo-Ismail等[29]对海福特牛与安格斯牛的采食效率性状候选基因进行注释,发现了63个与该性状关联的SNPs位点,结果表明,这些SNPs位点可解释6个采食效率性状0.05%~0.13%的遗传率,这些位点可用于全基因组选择低密度SNP芯片的设计。Ortega等[30]将筛选出的69个 与荷斯坦母牛繁殖性状相关的位点添加到商业基因芯片中进行基因组预测,结果表明,在基因芯片中添加事先筛选的位点可提高繁殖性状基因估计育种值可靠性的2.76%。我国自2012年开始在全国实施荷斯坦青年公牛基因组遗传评估。张金鑫等[31]利用基因组选择技术进行北京地区大白猪基因组联合遗传评估,并实施基因组选择分子育种,预测了刚出生的小公猪基因组估计育种值,提高了选种准确性。刘冉冉等[32]研究表明,鸡基因组SNP芯片在基因组选择育种、种质资源多样性分析、亲缘关系鉴定、基因组关联研究、基因定位等方面可发挥重要作用。齐欣[33]针对6个肉质性状及3个胴体性状,利用 Illumina BovineHD 对西门塔尔牛进行全基因组关联分析,检测了低密度芯片对脂肪酸含量性状基因组预测的准确性,研究表明,筛选标记低密度芯片准确性明显高于均匀分布低密度芯片,具有开发潜力。刘天飞等[34]利用Illumina鸡60K SNP芯片针对2个生长性状和3个屠体性状,采用基因组最佳线性无偏预测模型(GBLUP)、贝叶斯LASSO模型和贝叶斯Mixture模型等3种基因组育种值估计模型与传统育种值估计模型估计育种值。
在分子生物学发展的今天,动物育种依然离不开传统的表型选择。传统选择方法比较成熟,在畜禽遗传进展的研究中发挥了很大的作用,在现阶段,现代化的分子选育只是一种辅助手段。本研究中应用了传统的体型评分,对公牛表型的传统选择使得对晋南牛的公牛选择更加准确。采用分子辅助选育可以早期高效对一些限性性状进行选择,节约大量的成本。同时,由于人工授精技术的使用,使得公牛精液应用更快更广,因此,提高种公牛选择的准确性可以起到事半功倍的效果。
4 结 论
本研究通过基因芯片检测,对晋南牛和其他牛种进行了遗传聚类分析,证明了晋南牛在分子遗传结构上的独特性,为晋南牛保种提供了理论依据;对晋南牛后备公牛进行了遗传评估、近交家系分析、传统表型选择及遗传疾病检测,最终选出的留种种公牛为JN07、JN23、JN05、JN08、JN02、JN13、JN19、JN14,通过多种选育方法结合,提高了公牛的选择准确性,为晋南牛的群体选育提高奠定了基础。
