改性处理对豌豆蛋白结构和功能特性的影响
2021-11-04夏轩泽钱海峰
夏轩泽, 李 言, 钱海峰, 张 晖, 王 立
(江南大学 食品学院, 江苏 无锡 214122)
碗豆是一种重要的豆科作物,全球年产量约为1 350万t,目前在90多个国家种植[1]。豌豆中的蛋白质由于其高营养价值、低成本、低致敏性和非转基因状态,而被认为是食品行业中一种新兴的植物蛋白资源[2]。豌豆蛋白的氨基酸组成相对较为均衡,该蛋白中赖氨酸含量较谷物蛋白更高,但含硫氨基酸的含量相对较低[3]。豌豆蛋白在加工过程中受热容易变性,从而导致其溶解性变差,且天然豌豆蛋白乳化性和起泡性较差[4],使其在食品工业中的应用受到限制。
目前物理、化学、酶法或协同处理等改性方式是解决蛋白应用受限问题的常见技术手段,其作用机理是通过改变豌豆蛋白的内在结构从而改善其功能特性。Peng等[5]发现,豌豆蛋白经95 ℃热处理30 min,其亚基会通过二硫键连接成聚集体,促使其表面疏水性增加,O/W界面张力降低,从而改善其乳化活性和乳化稳定性。Liu等[6]研究了磷酸化改性对豌豆蛋白理化特性的影响,发现磷酸化豌豆蛋白的α-螺旋和β-折叠含量增加,β-转角和无规卷曲含量减少,溶解度提高171.21%,持油性增加73.31%,乳化活性增加63.07%,乳化稳定性增加69.08%,起泡性增加114.28%。Zhou等[7]发现,豌豆蛋白经木瓜蛋白酶酶促共挤处理后,水解更充分,并且提高了溶解性和DPPH自由基清除能力。目前有研究发现,几种改性方法协同使用对豌豆蛋白功能特性提升的效果较好,且可以减少单一方法改性的缺陷。研究表明,挤压处理作为一种物理方式,可以通过热量、压力和剪切力使蛋白展开、聚集再重新排列[8];磷酸化处理作为一种化学改性,则可以引入带负电的磷酸基团,增强蛋白间的静电排斥力,改变蛋白空间结构。挤压处理、磷酸化处理这两种改性方式单独使用均对蛋白结构影响显著,然而目前有关使用挤压和磷酸化协同处理改性豌豆蛋白的研究鲜有报道。
本实验采用挤压处理、磷酸化处理、挤压协同磷酸化处理三种改性方式对豌豆蛋白进行改性,利用傅里叶变换红外光谱、十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS- PAGE)、蛋白游离巯基及二硫键含量测定等分析手段研究改性处理对蛋白结构的影响,以期改善豌豆蛋白的功能特性,扩大其应用范围。
1 材料与方法
1.1 材料与试剂
豌豆蛋白[碱溶酸沉法提取,蛋白质量分数为(89.80±0.20)%],西安千叶草生物科技有限公司;三聚磷酸钠、氢氧化钠、十二烷基硫酸钠(SDS)、考马斯亮蓝R- 250、溴酚蓝、二硫苏糖醇(DTT)、冰乙酸、盐酸等化学试剂均为分析纯,国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒(增强型),上海碧云天生物技术有限公司。
1.2 仪器与设备
POLYLAB型双螺杆挤出挤压系统(喂料速度为1~50 kg/h,螺杆长径比≥20∶1,直径为19~26 mm),美国赛默飞世尔科技公司;HXLG- 18- 50B普通型真空冷冻干燥机,浙江赛德仪器设备有限公司;F- 7000型荧光光谱仪,日本日立公司;Antaris II型傅里叶变换近红外光谱仪,赛默飞世尔科技(中国)公司;EPS- 300型SDS- PAGE电泳仪,上海天能科技有限公司。
1.3 实验方法
1.3.1豌豆蛋白的改性处理
1.3.1.1 挤压处理
经前期优化实验,将豌豆蛋白挤压改性的工艺条件确定为:调整水分质量分数至35%,经60、80、95、105 ℃升温程序,在喂料速度为10 kg/h,螺杆转速为300 r/min条件下挤出,再将挤出物置于40 ℃恒温烘箱中平衡水分至质量分数为10%以下,冷却至室温,粉碎后过80目筛,储藏备用。
1.3.1.2 磷酸化处理
经前期优化实验,将豌豆蛋白磷酸化改性的工艺条件确定为:豌豆蛋白体积分数3%、三聚磷酸钠体积分数2%、pH值 8.0、反应时间3.5 h、温度30 ℃,4 ℃透析72 h。将磷酸化改性后的豌豆蛋白真空冷冻干燥,粉碎后过80目筛,储藏备用。
1.3.1.3 挤压协同磷酸化处理
将挤压预处理的豌豆蛋白进行磷酸化处理,挤压和磷酸化处理条件分别同1.3.1.1和1.3.1.2。协同处理后样品经过真空冷冻干燥,粉碎后过80目筛,储藏备用。
1.3.2红外光谱分析
用红外光谱仪对样品进行全波段扫描(400~4 000 cm-1),扫描次数32次,分辨率为4 cm-1。取1 600~1 700 cm-1的红外光谱,用Peakfit 4.12软件进行拟合,根据各子峰的面积计算二级结构含量。
1.3.3游离巯基与二硫键的测定
总巯基含量测定参考刘静媛[9]的方法并稍做修改。制备溶液:将1 mmol/L EDTA,10 mmol/L巯基乙醇,8 mol/L尿素溶于0.1 mol/L pH值为8.0的磷酸盐缓冲液(溶液A)。将豌豆蛋白样品溶解于溶液A,振荡混匀30 min,6 000 r/min离心10 min,取5 mL上清液加入0.1 mL Ellman试剂溶液,混合均匀后室温避光放置15 min,在412 nm处测定上清液与空白对照的吸光度值。
游离巯基测定依据Si等[10]的方法并稍作修改。制备溶液:将1.2 g/L EDTA,6.9 g/L甘氨酸,10.4 g/L Tris溶于0.1 mol/L pH值为8.0的磷酸盐缓冲液(记为TGE),将25 g/L SDS溶解于TGE中(记为SDS- TGE)。将豌豆蛋白样品溶解在SDS- TGE中,振荡混匀30 min,6 000 r/min离心10 min,取5 mL上清液加入0.1 mL Ellman试剂溶液,混合均匀后室温避光放置15 min,在412 nm处测定上清液与空白对照的吸光度值。总巯基和游离巯基含量的计算方法见式(1),二硫键含量的计算方法见式(2)。
(1)

(2)
式(1)、(2)中:总硫基含量/游离巯基含量,μmol/g;二硫键含量,μmol/g。73.53为Ellmann试剂的摩尔吸光系数;A412为样品在412 nm下的吸光度;D为样品的稀释倍数;C为样品溶液蛋白质量浓度,mg/mL。
1.3.4SDS-PAGE分析
参考Fang等[11]的方法并稍作改动。分离胶和浓缩胶质量分数分别为12.5%、5.0%,上样量为10 μL,样品质量浓度为2 mg/mL,电泳仪电压设置为80 V,待样品离开浓缩胶后调高电压至120 V,待条带跑至凝胶底端时结束电泳。用质量浓度为1 mg/mL的考马斯亮蓝R- 250染色30 min,然后用脱色液反复漂洗,直到蛋白条带清晰。
1.3.5表面疏水性的测定
采用Yang等[12]的方法并稍作改动。称取一定量豌豆蛋白溶于0.1 mol/L pH值为7.0的磷酸盐缓冲液,将蛋白溶液稀释至0.025~0.200 mg/mL。取4 mL蛋白溶液加入20 μL 8 mmol/L的8-苯胺萘磺-1-酸盐(ANS)溶液,避光10 min后测定样品荧光强度。荧光光谱的激发波长为390 nm,发射波长为470 nm,狭缝宽度为5 nm,电压为700 mV。以相对荧光强度对蛋白质浓度绘图,将其初始阶段的斜率作为蛋白质的表面疏水性指数。
1.3.6溶解度的测定
通过氮溶解指数(NSI)来表示蛋白的溶解度。准确称取100 mg豌豆蛋白,溶于10 mL 0.1 mol/L pH值为7.0的磷酸盐缓冲液,磁力搅拌3 h,室温下8 000 r/min离心20 min,取上清液。采用二喹啉甲酸(BCA)法测定上清液蛋白含量,凯氏定氮法测定总蛋白含量。根据式(3)计算蛋白溶解度。
(3)
1.3.7持水性以及持油性的测定
参考伍圣文等[13]的方法并稍加修改。准确称取0.1 g豌豆蛋白于5 mL离心管中,加入1 mL去离子水或大豆油,涡旋振荡器中振荡混匀30 min,结束后静置30 min,5 000 r/min离心20 min,除去上层液体,准确称量离心管和沉淀的质量。蛋白的持水性及持油性按式(4)计算。
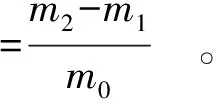
(4)
式(4)中:m0为称取样品的质量,g;m1为样品加离心管的质量,g;m2为离心后离心管加沉淀的质量,g。
1.3.8乳化活性以及乳化稳定性的测定
参考Wang等[14]的方法测定蛋白的乳化活性(EAI)和乳化稳定性(ESI)。采用0.1 mol/L pH值为7.0的磷酸盐缓冲液制备16 mL质量分数为0.1%的豌豆蛋白溶液,加入4 mL大豆油,使用高速剪切机在15 000 r/min下剪切2 min,每隔30 s停顿10 s。随即从距烧杯底部5 mm处吸取50 μL的乳状液,并加入5 mL的质量分数为0.1% SDS溶液,两者漩涡混合后于500 nm处测定吸光值A0,0.1% SDS溶液作空白对照。乳液静置30 min后从距烧杯底部5 mm处重新取样,按A0的测定步骤测得吸光值A30。EAI和ESI的计算方法如式(5)、(6)。
(5)
(6)
式(5)、(6)中:EAI,m2/g;ESI,min;A0为0 min时测定的吸光值;N是稀释倍数;C是乳液形成前蛋白溶液中蛋白质量浓度,g/mL;φ是乳液中油的体积分数,%;A30为30 min时测定的吸光值。
1.4 统计分析
每组实验做3次平行,采用SPSS 26.0统计软件对数据进行显著性分析(P<0.05),利用Origin 2018软件绘图。
2 结果与分析
2.1 不同改性处理对豌豆蛋白结构变化的影响
2.1.1对二级结构含量的影响
表1为不同改性处理的豌豆蛋白二级结构含量变化情况。从表1可以看出,改性后的豌豆蛋白β-折叠含量显著提高(P<0.05),经挤压处理、磷酸化处理、挤压协同磷酸化处理后分别提高了10.15%、11.49%、15.06%;β-转角含量则显著降低(P<0.05),分别降低了5.74%、6.88%、9.85%。这是因为挤压处理的高温高压作用,造成蛋白质热聚集,使其二级结构趋向于从β-转角转变形成β-折叠,这与Zhou等[15]阐述的结果一致;磷酸化处理由于在豌豆蛋白部分氨基酸侧链接了磷酸根,使得二级结构发生变化,蛋白由球状结构转变成片层状结构[16]。
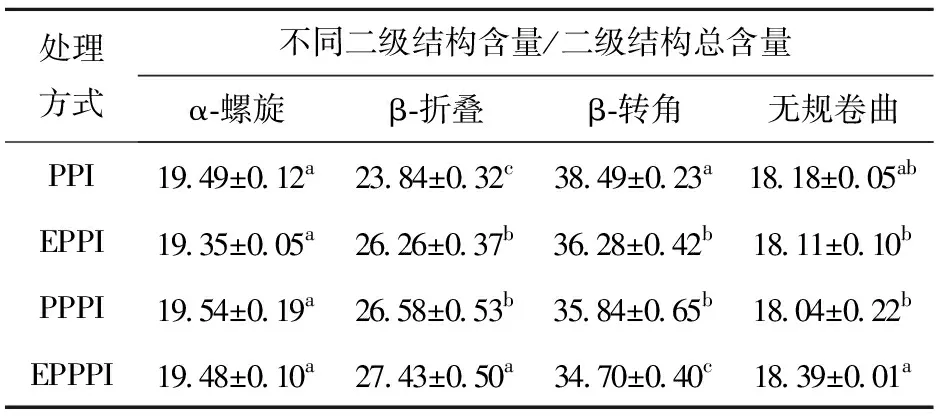
表1 不同改性处理的豌豆蛋白二级结构的含量Tab.1 Content of secondary structure of pea protein with different modification methods %
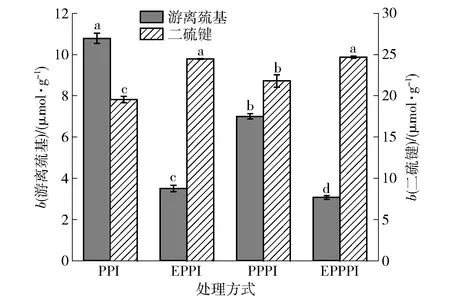
不同字母表示组间差异显著(P<0.05)。图1 不同改性处理豌豆蛋白的游离巯基和二硫键含量变化Fig.1 Change of free sulfhydryl and disulfide bond content of pea protein with different modification methods
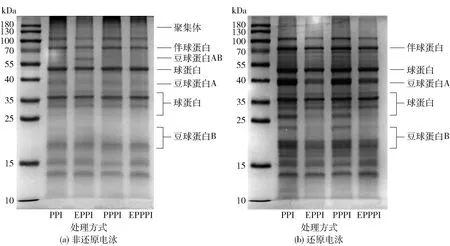
图2 不同改性处理豌豆蛋白的SDS- PAGE分析Fig.2 SDS- PAGE analysis of pea protein with different modification methods
2.1.2对游离巯基与二硫键含量的影响
图1为不同改性处理对豌豆蛋白游离巯基和二硫键含量影响的分析结果。与PPI相比,EPPI、PPPI、EPPPI的游离巯基含量均显著降低(P<0.05),而二硫键含量显著增加(P<0.05)。游离巯基含量的下降主要是由于二硫键的形成和蛋白分子聚集包埋巯基。改性豌豆蛋白二硫键含量与游离巯基的含量变化趋势相反,这表明挤压处理和磷酸化处理均可使豌豆蛋白分子之间通过游离巯基形成二硫键,蛋白交联形成可溶性或不可溶性蛋白聚集体,这与Zhang等[17]、于丽娜等[18]的报道类似。
2.1.3对亚基组成的影响
图2为不同改性处理豌豆蛋白的SDS- PAGE分析结果。非还原电泳主要反映豌豆蛋白中各种蛋白的组成,还原电泳主要反映豌豆蛋白中各种亚基的组成,此时大部分聚集体解聚,11s蛋白(豆球蛋白AB)二硫键被破坏,转变成豆球蛋白A和豆球蛋白B两个亚基[19]。图3为非还原电泳条件下,不同改性处理豌豆蛋白的豆球蛋白A、豆球蛋白B的相对表达。
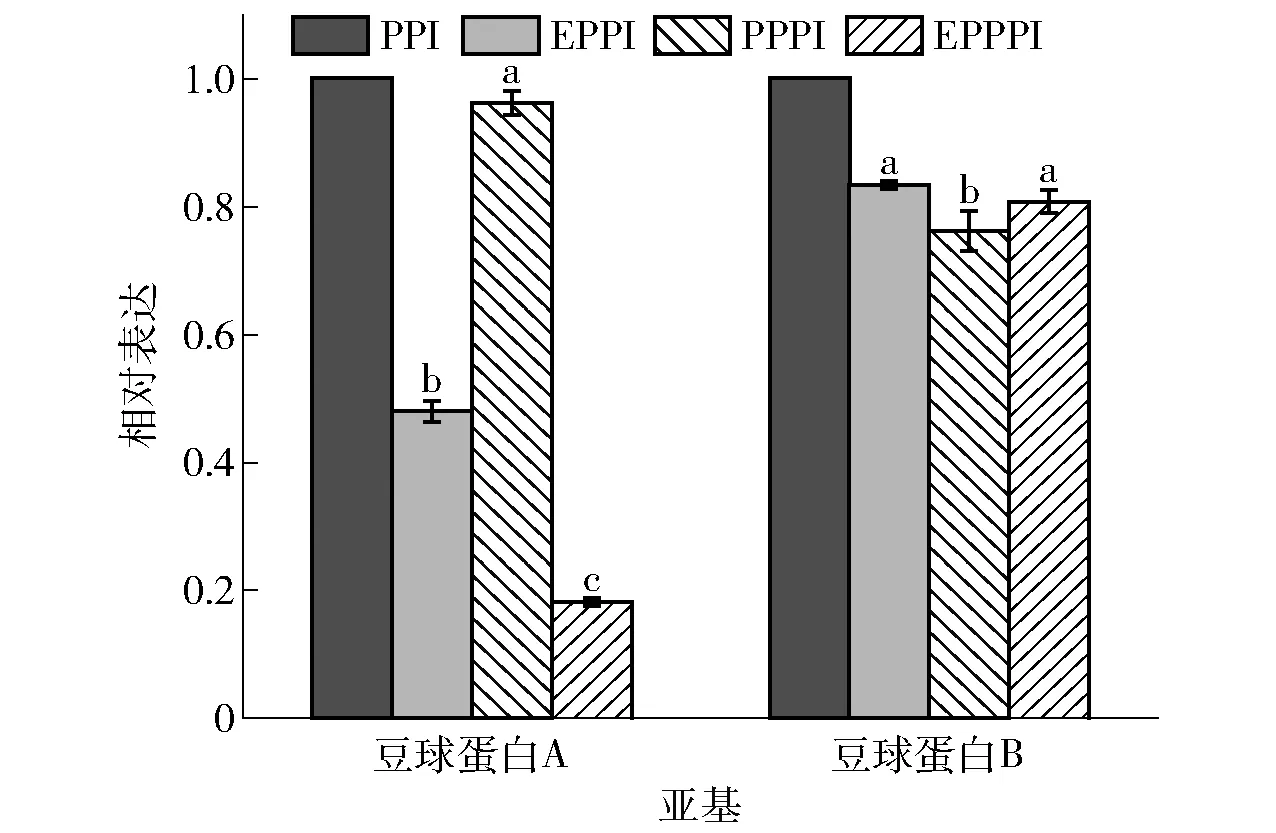
不同字母表示组间差异显著(P<0.05)。图3 非还原电泳条件下不同改性处理豌豆蛋白的 豆球蛋白A、豆球蛋白B的相对表达Fig.3 Relative protein expressions of legumin A and legumin B of pea protein with different modification methods under non-reducing electrophoresis conditions
由图2、图3可知,在非还原电泳条件下,豆球蛋白A的含量按改性处理方式排序为PPI>PPPI>EPPI>EPPPI,豆球蛋白B的含量按改性处理方式排序为PPI>EPPI>EPPPI>PPPI。改性处理后,豆球蛋白A和豆球蛋白B含量减少,根据测定的二硫键含量变化结果,改性处理后豆球蛋白A和豆球蛋白B亚基可能通过二硫键与其他亚基交联;EPPI的豆球蛋白AB含量大于PPI,表明挤压处理促进豆球蛋白A和豆球蛋白B亚基通过二硫键形成豆球蛋白AB,这与2.1.2中挤压处理后二硫键含量增加结果对应。图2(b)中,在还原电泳条件下,分离胶顶端仍有部分颜色较浅的条带,这说明仍有部分聚集体未解聚,即构成聚集体的不只有二硫键和疏水键。豆球蛋白A的含量按改性处理方式排序为PPI>PPPI>EPPPI>EPPI,豆球蛋白B的含量按改性处理方式排序为PPI>PPPI>EPPPI>EPPI。未改性豌豆蛋白的豆球蛋白A和豆球蛋白B含量仍高于改性豌豆蛋白,说明改性处理后部分豆球蛋白A、豆球蛋白B不止通过二硫键形成聚集体,仍有部分化学键未被破坏。EPPI、EPPPI的豆球蛋白A和豆球蛋白B含量明显低于PPI、PPPI,表明挤压处理对豆球蛋白的影响较磷酸化处理明显;EPPI与EPPPI的条带差别较小,表明磷酸化处理对经挤压预处理的豌豆蛋白亚基影响较小。
2.2 不同改性处理对豌豆蛋白功能特性的影响
2.2.1对表面疏水性的影响
不同改性处理对豌豆蛋白表面疏水性影响的分析结果见图4。表面疏水性与蛋白质分子的展开和聚集状态有关,其变化可以侧面反映蛋白质的三级结构。从图4可以看出,与未改性豌豆蛋白相比,改性豌豆蛋白的表面疏水性显著增大(P<0.05),其中挤压处理组提高了49.78%,磷酸化处理组提高了23.93%,挤压协同磷酸化处理组提高了101.95%。这是因为挤压处理促进二硫键形成,更易形成不溶性聚集体,表面疏水性增强;磷酸化处理由于引入带负电的磷酸根,静电排斥力增强,引起疏水基团暴露,蛋白分子间疏水相互作用增强。豌豆蛋白经挤压预处理后可以显著加强磷酸化处理对豌豆蛋白结构的影响,在两种改性方式共同作用下,导致原本深埋在蛋白质内部的疏水性基团暴露,增加蛋白表面疏水性。
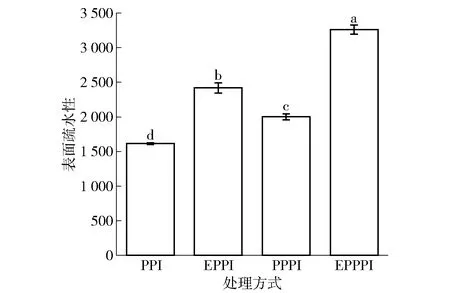
不同字母表示组间差异显著(P<0.05)。图4 不同改性处理豌豆蛋白的表面疏水性Fig.4 Surface hydrophobicity of pea protein with different modification methods
2.2.2对溶解性的影响
不同改性处理的豌豆蛋白的溶解性变化情况见表2。由表2可知,不同改性处理的豌豆蛋白溶解性差异显著(P<0.05),其中磷酸化处理、挤压协同磷酸化处理的豌豆蛋白溶解性可分别提升17.19%、10.38%,而挤压处理降低了其溶解性,这与Liu等[6]、Banach等[20]的研究结果一致。PPPI、EPPPI溶解性高于PPI的原因可能是磷酸化后接上了极性的磷酸根基团,蛋白的水合作用改善,电负性增加,蛋白分子之间的静电排斥力提高。EPPI可能是由于挤压处理,受到高温高压、高剪切力作用,疏水基团暴露,疏水相互作用增强,形成不溶性聚集体,从而导致其溶解性显著降低。
2.2.3对持水性、持油性及乳化性的影响
持水性和持油性决定蛋白质的水/油保持力和不同上标字母表示组间差异显著(P<0.05)。
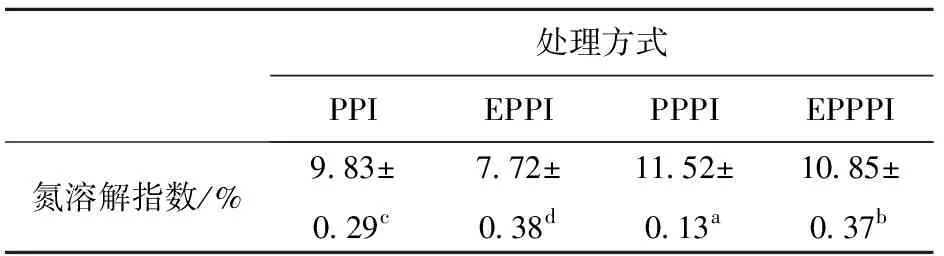
表2 不同改性处理豌豆蛋白的溶解性Tab.2 Solubility analysis of pea protein with different modification methods
蛋白质- 水/油相互作用,并影响食品的质地和质量[21]。图5为不同改性处理对豌豆蛋白持水性、持油性的变化情况。由图5可知,磷酸化处理可以显著改善豌豆蛋白的持水性,而挤压处理显著降低豌豆蛋白的持水性,这可能是改性处理影响其溶解性,从而影响持水性;挤压处理、磷酸化处理以及挤压协同磷酸化处理均可以显著提高豌豆蛋白的持油性,这可能是由于改性处理增强了豌豆蛋白的表面疏水性。
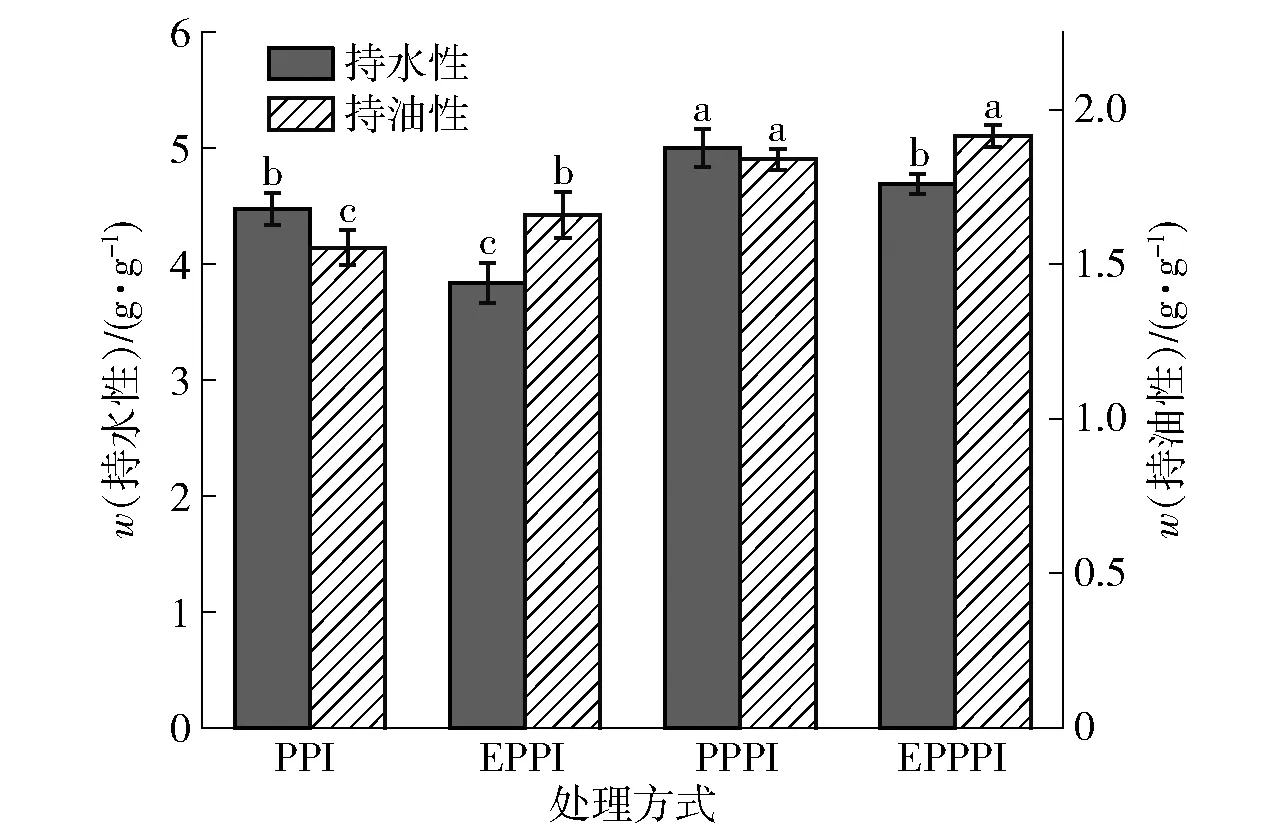
不同字母表示组间差异显著(P<0.05)。图5 不同改性处理豌豆蛋白的持水性及持油性变化Fig.5 Change of water holding capacity and oil holding capacity of pea protein with different modification methods
不同改性处理豌豆蛋白的乳化活性和乳化稳定性变化情况见图6。由图6可知,与未改性组相比,3种改性处理均显著(P<0.05)提高了豌豆蛋白的乳化活性、乳化稳定性。挤压处理由于高温高压、高剪切作用,蛋白展开、聚集、再重新排列,蛋白结构变化显著,亲水性基团分布位点改变,亲油性疏水基团暴露,表面疏水性增强,从而改善乳化能力;磷酸化处理改善了豌豆蛋白的乳化活性、乳化稳定性的原因是引入亲水性磷酸基团,蛋白分子的溶解性和分散性改善,且带负电的磷酸根使得乳液液滴之间存在静电排斥力,乳液液滴间的絮凝和聚集的现象明显改善;挤压协同磷酸化处理既增强了豌豆蛋白的表面疏水性,又改善了其溶解性,增加了静电排斥力,改善了其亲水性和亲油性,利于形成油水界面膜,从而改善了豌豆蛋白的乳化活性和乳化稳定性。
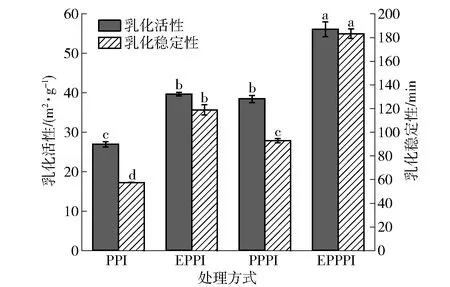
不同字母表示组间差异显著(P<0.05)。图6 不同改性处理豌豆蛋白的乳化活性及乳化稳定性Fig.6 Emulsifying activity and emulsifying stability of pea protein with different modification methods
3 结 论
挤压处理、磷酸化处理、挤压协同磷酸化处理均有效改变了豌豆蛋白的结构特性和功能特性,综合对比,挤压协同磷酸化处理对豌豆蛋白理化性质影响更为明显。对3种改性豌豆蛋白通过红外光谱、SDS- PAGE等蛋白质结构分析发现,豌豆蛋白二级结构改变,β-折叠含量增加,β-转角含量减少;游离巯基含量减少,二硫键含量增加;亚基组成改变,豆球蛋白A和豆球蛋白B含量减少;表面疏水性增加。对3种改性豌豆蛋白的功能特性分析结果表明,磷酸化处理、挤压协同磷酸化处理能够改善豌豆蛋白的溶解性,而挤压处理降低了其溶解性;3种改性处理后的豌豆蛋白持油性、乳化活性及乳化稳定性改善,但在这些功能特性上,单一的挤压处理、磷酸化处理改善效果不如挤压协同磷酸化处理。本研究表明,挤压协同磷酸化处理能够改善豌豆蛋白的加工特性,提高豌豆蛋白产品的附加价值,进而扩大豌豆蛋白在食品工业中的应用范围。
