NIS基因转染对肝细胞癌NIS蛋白表达及摄碘功能的影响
2021-11-04范义湘易紫薇胡煜麟张宏嘉林美珍陈洁芳肖汉
范义湘,易紫薇,胡煜麟,张宏嘉,林美珍,陈洁芳,肖汉
1.南方医科大学第五附属医院核医学科,广东广州510900;2.广东省第二人民医院核医学科,广东广州510317
前言
肝细胞癌(HCC)是我国高发肿瘤,目前根治性切除、肝动脉栓塞化疗等可以取得较好的近期疗效,但复发率高、远期疗效不理想,尤其对于肝癌转移瘤的治疗更为困难[1]。钠碘转运体(Sodium/Iodine Symporter, NIS)是甲状腺滤泡细胞调节碘摄入的膜蛋白通道,既往报道采用转基因技术,使低分化或未分化甲状腺癌等肿瘤具备摄碘功能,为肿瘤的核素靶向治疗提供新思路[2]。本研究采用转染外源性NIS 基因,上调HCC 细胞NIS 蛋白表达,使HCC 细胞具备摄碘功能,为HCC提供新的治疗方法。
1 材料和方法
1.1 试剂与仪器
总RNA 提取试剂Trizol reagent 和脂质体lipofectamine 2000、DMEM 培养基、胎牛血清均购自Invitrogen 公司。RT-PCR 试剂盒、限制性内切酶EcoRI等购自Takara公司。质粒提取试剂盒、DNA凝胶纯化试剂盒等购自Omega 公司。Triton X-100 购自武汉伊莱瑞特生物科技股份有限公司。Na125I为成都中核高通同位素公司生产,放射化学纯度99.7%,无载体,pH 8.0。NIS 扩增片段上游引物序列为:5'-CTCCCTGCTAAACGACTCCAG-3',下游引物序列为:5'-AACAGACGATCCCTCATTGGTG-3',购自Invitrogen公司。人肝癌细胞株HepG2购自武汉益普生物科技有限公司。核酸蛋白分析仪为美国Beckman 公司DU-530 型,基因扩增仪为美国Perkin Elmer 公司PE-460 型,放射性γ 计数器为上海核福光电有限公司SN-682 型,流式细胞仪为美国BD FACSCanto II 型,荧光倒置显微镜为德国Leica DMi8型。
1.2 人肝癌细胞株HepG2培养
参照文献[3],选择人肝癌细胞株HepG2 作为研究对象。以DMEM 为培养液,培养液均含质量分数10%的胎牛血清及100 U/mL青霉素、100 μg/mL链霉素,置37 ℃、体积分数5% CO2孵箱培养。倒置显微镜观察细胞生长情况,细胞为贴壁生长。定期采用含0.25%胰酶EDTA 溶液消化传代。待细胞生长至对数生长期进行实验。
1.3 PCR扩增人NIS(hNIS)基因片段测序克隆
参照既往研究方法[4],采用Trizol 法提取人8505C 细胞总的RNA,并设计NIS 基因的1 对引物。以逆转录合成的DNA 为模板进行PCR 扩增。扩增产物经琼脂糖凝胶电泳后,回收目的片段并用T4DNA 连接酶将其直接与克隆载体pUCmT 连接,连接产物转化感受态大肠杆菌XL Blue。将含有正确hNIS 序列的重组质粒pUCmThNIS 及真核载体pcDNA3经HindⅢ和XbaI双酶切、连接、转化,得到重组质粒pcDNA3/hNIS。
1.4 体外NIS转染
在6 孔培养板中接种处于对数生长期的肝癌细胞HepG2,每孔细胞数约为5×105。以上述相同方法培养并观察细胞生长情况,待生长密度达到90%以上时,采用电转染法进行转染。转染后继续培养24 h。对照组细胞不转染NIS基因。
1.5 Western-Blot法测定NIS基因表达
实验组和对照组细胞,去培养上清液,用PBS液洗涤细胞2次,加入预冷的细胞裂解液150 μL,以细胞刮将细胞刮取,收集到细胞离心管,冰浴20 min后于4 ℃、12 000 g离心15 min,收集上清液。琼脂糖凝胶电泳分离,EB染色后照相。Kodak Digital Science ID软件系统扫描分析,测定光密度值并计算NIS/GAPDH光密度比值[5]。其结果为3次重复实验结果。
1.6 细胞摄碘率测定
按以往研究方法[6],于转染后24 h,将实验组和对照组细胞接种于24 孔细胞培养板,每孔约1×105,37 ℃、5% CO2培养箱培养24 h,培养至细胞约80%融合时吸掉培养液,Hanks平衡盐溶液(HBBS)洗涤1次,以微量加样器(0~50 μL)加入含Na125I 13.7 kBq(0.37 μCi)的培养液,37 ℃温育摇床振荡24 h。收集细胞置入测量管,用放射性γ 计数器测量每分钟放射性计数(T),之后离心去上清液,细胞沉淀用HBBS洗涤2 次,离心去上清液,测定结合于细胞的每分钟放射性计数(B)。对照组和NIS 转染组细胞摄碘率以B/T%表示,每组细胞设置3个重复样品。
1.7 DAPI染色检测HepG2细胞凋亡
取上述培养后消化的HepG2 细胞,制成细胞悬液,接种于24 孔细胞培养板,每孔约1×105,加入含Na125I 13.7 kBq(0.37 μCi)的培养液,37 ℃温育摇床振荡24 h。收集细胞置入测量管,置于6 孔培养板,每孔约1×106,培养72 h 后以PBS 液洗涤细胞2 次,以4%多聚甲醛在4 ℃固定细胞30 min,固定过的细胞再以PBS 洗涤2 次,然后以含0.1% Triton X-100 的0.1%柠檬酸钠溶液于4 ℃孵育细胞5 min,加入DAPI于4 ℃暗箱孵育10 min,360 nm紫外线激活,荧光显微镜观察细胞染色。计数每个高倍镜(×400)下荧光染色细胞数及细胞总数,以前者除以后者为凋亡率。
1.8 统计学分析
采用SPSS13.0 统计软件,计量资料以均数±标准差表示,采用t检验比较实验组与对照组之间的差异性,检验水准α=0.05。
2 结果
2.1 转染后HepG2细胞NIS表达测定
实验组NIS 蛋白电泳条带粗浓、宽厚,对照组条带细小、稀疏(图1),NIS/GAPDH 光密度比值在实验组平均值为0.49±0.12,对照组为0.18±0.11。经比较,实验组HepG2 细胞NIS 表达强度显著高于对照组(t=2.693,P<0.05),说明经NIS 基因转染后实验组HepG2细胞已表达NIS蛋白。
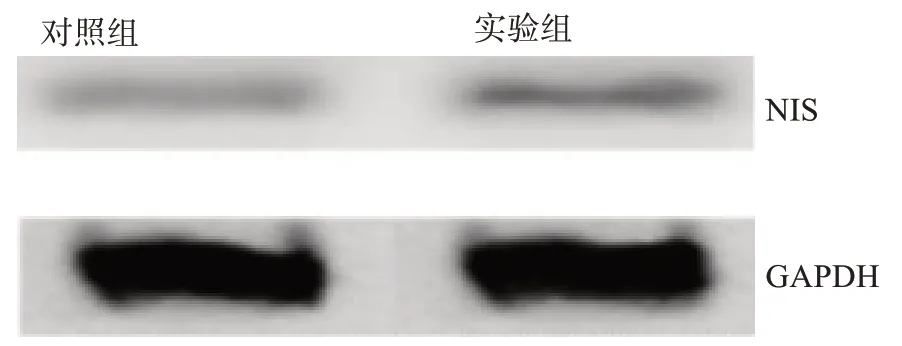
图1 HepG2细胞NIS蛋白表达的Western-Blot检测结果Fig.1 NIS protein expression in HepG2 cells was detected by Western-Blot assay
2.2 HepG2细胞摄碘率比较
培养板每孔细胞加入的Na125I经γ计数器测量,其放射性总计数T(Total,T)为89 720 CPM(counts/min)。实验组HepG2 细胞所摄取的Na125I 放射性计数B(Binding, B)平均为(16 528±5 200)CMP,经计算其摄碘率B/T%平均为(18.4±5.8)%。对照组HepG2细胞所摄取的Na125I放射性计数B平均为(1 820±1 610)CPM,经计算摄碘率B/T%为(1.9±1.8)%。两者比较具有显著性差异(t=36.842,P<0.05),即经NIS基因转染后,实验组HepG2细胞摄碘率显著提高。
2.3 细胞凋亡测定
HepG2细胞经DAPI染色后镜下呈蓝白色荧光。凋亡细胞呈核浓缩,染色加深,或者核染色质呈新月形聚集于核膜一侧。有些细胞表现为核碎裂呈大小不等的圆形小体,被细胞膜包绕,形成凋亡小体。实验组具有凋亡特征的染色细胞数多于对照组(图2)。细胞经稀释并调整细胞浓度后,显微镜下每个高倍视野内(×400)细胞数约70个,实验组含有核凋亡特征的细胞数为10~14个,实验组凋亡率平均为(19.2±5.3)%,对照组高倍视野下凋亡细胞数为2~5个,凋亡率为(5.8±3.1)%,显著低于实验组(t=3.086,P<0.05)。
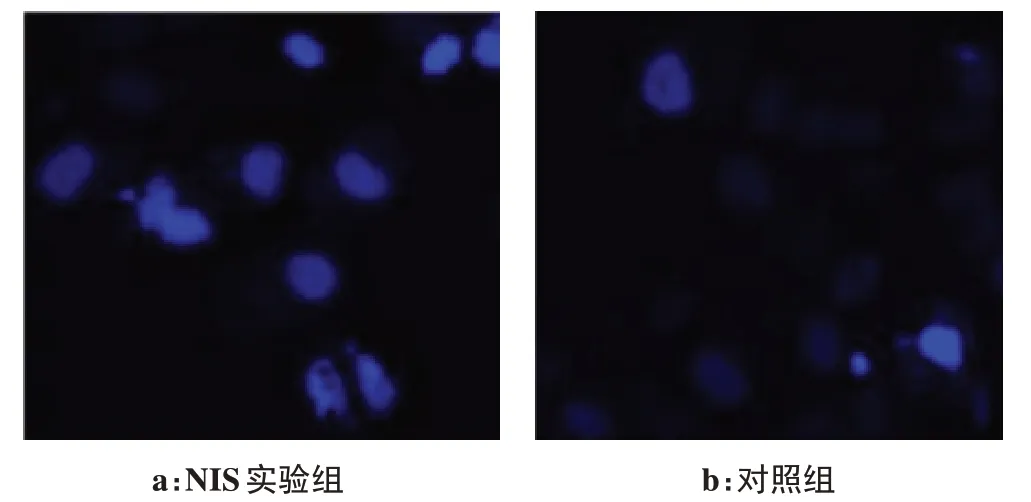
图2 NIS表达对HepG2细胞摄碘-125后细胞凋亡的影响(×400)Fig.2 Effects of NIS protein expression on apoptosis of HepG2 cell after iodine-125 uptake(×400)
3 讨论
HCC是世界5大最常见肿瘤之一,占中国癌症发病率第2 位和病死率的第1 位,在亚洲的一些地区,HCC是癌症死亡最常见的原因[1,7]。
NIS是一种介导碘转运的糖化膜蛋白,即所谓的“碘泵”,主要位于甲状腺细胞基底膜,其功能主要是借助钠/钾交换产生的钠离子浓度梯度,逆浓度转运血液内活性碘进入细胞,从而可使细胞内碘含量为血浆的20~200倍[8]。它实现了甲状腺组织摄取碘并进行甲状腺激素的生物合成,实现了甲状腺功能亢进和分化型甲状腺癌的显像诊断和放射性碘治疗。因此,NIS是细胞浓聚碘并进行放射性碘治疗的基础[9]。1996年有学者首先从FPTL-5细胞的cDNA文库克隆出鼠NIS基因[10],随后另有学者采用针对鼠NIS cDNA序列的引物,经逆转录-聚合酶链反应法扩增出hNIS的细胞cNDA片段,并从人甲状腺细胞cNDA文库中克隆出hNIS。hNIS基因位于19号染色体,整个编码区由15个外显子和14个内含子构成,其开放阅读框架为1 929个核苷酸,编码643个氨基酸残基[10-11]。随着NIS结果和功能的阐明,采用提取hNIS mRNA,以此为起始原料经逆转录产生cDNA,再以cDNA为模板进行PCR扩增,将得到的NIS基因克隆到含有巨细胞病毒启动子,再将扩增的质粒DNA转染肿瘤细胞,诱导细胞NIS基因表达,这对于不表达NIS的HCC等恶性肿瘤,为实施放射性治疗提供了实验基础和新思路[12]。随着基因转染方法的应用,使不表达NIS的肿瘤具备摄碘功能,如失分化甲状腺癌、未分化甲状腺癌、乳腺癌、胶质瘤、肺癌等,具备摄碘功能而实施放射性内照射治疗[12-15]。有研究发现用hNIS基因转染无摄碘功能的鼠甲状腺癌细胞,其摄碘能力提高了60倍,从而为难治性肿瘤的放射性碘治疗开辟了新思路[16]。本研究将NIS基因稳定转染至原发性肝癌细胞HepG2细胞,经Western-Blot方法检测出转染的细胞具备NIS蛋白表达,而未转染细胞内没有NIS表达。因为转染后细胞具备了NIS蛋白通道,从而具有摄碘功能,其平均摄碘能力达18.4%,为未转染组的9.6倍,与目前类似研究结果接近[15]。因此,我们认为HCC细胞表达NIS基因和蛋白,并具备摄碘能力,是基因转染的结果。放射线可引起肿瘤细胞凋亡[3,16]。本研究转染组细胞因为摄取125I引起细胞改变,靶向为细胞呈核浓缩,染色加深,或者核染色质呈新月形聚集于核膜一侧,有些细胞甚至出现核碎裂,形成凋亡小体[17-18]。而未转染NIS的对照组具有凋亡特征的染色细胞数较少。
综上所述,本研究通过转染NIS 基因,使HCC 细胞具备摄碘功能,放射性碘引起细胞凋亡,抑制肿瘤细胞增殖,为下一步体内实验奠定了理论基础。
