昼夜节律紊乱对非酒精性脂肪性肝病及相关肝细胞癌的影响
2021-11-04朱金霞刘光伟杨培伟
朱金霞, 刘光伟, 杨培伟
1 河南中医药大学 第一临床医学院, 郑州 450000;2 河南中医药大学第一附属医院 脾胃肝胆科, 郑州 450000
非酒精性脂肪性肝病(NAFLD)组织学以弥漫大泡性肝细胞脂肪变性及脂肪聚集为特征,包括单纯性非酒精性脂肪肝、非酒精性脂肪性肝炎(NASH)、肝纤维化、肝硬化及相关肝细胞癌(HCC)[1]。NAFLD现已成为HCC主要原因之一,且发病率以每年约10%的速度增长[2]。与经典的肝炎-肝硬化-肝癌三部曲所不同的是,约40%的NAFLD不经过肝硬化直接发展为HCC,其发病机制主要与代谢、遗传、肠道菌群、胰岛素抵抗(IR)、免疫、内分泌等途径有关[3]。当前,人们受生活工作影响,熬夜、夜班较为普遍,昼夜节律不同步加之外部环境刺激增加了NAFLD相关HCC(NAFLD-HCC)发病率,而同步昼夜节律可延缓NAFLD-HCC进程。本文探讨昼夜节律紊乱对脂质代谢、糖代谢及肠道菌群的影响,以期为NAFLD-HCC临床诊治提供帮助。
1 昼夜节律
昼夜节律是指机体各项生理指标的昼夜变化,是人体适应地球自转形成的生理特征。稳定性和可塑性是昼夜节律的2个相辅相成的特征,体现出环境对人的影响。中枢神经系统经过长期的光照塑造控制各外周器官的昼夜节律,使人体内部节律与外部光照节律一致,称为可塑性;稳定性指短期内机体各器官在基因层面形成一套不依赖外部光照的内源性翻译转录调控机制,保证机体维持稳定的昼夜节律[4]。长期熬夜、夜间轮班,迫使机体适应新的环境光照,机体内部各器官出现暂时性昼夜节律不一致的情况,即昼夜节律紊乱。
分子生物学水平上,多个相互影响的生物钟基因及其蛋白产物组成的转录-翻译-负反馈回路形成近似24 h为周期的震荡,再由输出系统调节效应器形成昼夜节律[5]。哺乳动物的昼夜节律呈现出富有系统层次的特点,由中枢、外周2个生物钟系统组成。下丘脑视交叉上核(suprachiasmatic nucleus,SCN)充当主起搏器发出神经节律信号,外周器官如肝、肾、胃、肠等接收其信号,协同SCN维持机体正常生理功能。哺乳动物的昼夜节律由多个自治反馈环控制(图1):(1)其中一条核心反馈环是由正调控基因[脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1基因(brain and muscle ARNT-like protein 1,BMAL1)、昼夜节律运动输出周期故障基因(circadian locomoter activity kaput,CLOCK)]和负调控基因[周期基因(period,PER)、隐花色素基因(cryptochrome,CRY)]组成。昼夜节律自黎明开始,BMAL1和CLOCK形成复合物后,与启动因子E-box DNA序列结合,启动CRY、PER基因转录。昼夜节律白天结束点,CRY、PER蛋白水平升高至一定程度后在细胞质内被翻译,结合酪蛋白激酶1δ(CK1ε/δ)形成PER:CRY异二聚体运输至细胞核内抑制CLOCK-BMAL1活性。胞核内未形成PER:CRY的异二聚体PER和CRY则各自被腺苷酸活化蛋白激酶和CK1ε/δ磷酸化降解,此部分通过解除对CLOCK-BMAL1复合物的抑制而开始新一轮的转录[5],从而形成一条完整的昼夜节律反馈环路。(2)除上述核心反馈环外,维甲酸相关孤儿受体α/β(retinoid acid receptor-related orphan receptor,RORα/β)与REV-ERBα/β(孤儿核受体家族成员)构成另一环路,CLOCK-BMAL1结合RORα/β激活正向转录,反之REV-ERBα/β竞争结合到同一位点RRE抑制转录[6],形成第2条自主反馈环路。(3)烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)由烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,NAMPT)生成,且NAD(SIRT1的底物)调节去乙酰化酶1(sirtuin1,SIRT1),NAD的限速酶是NAMPT。CLOCK-BMAL1复合物结合E-box基因序列后上调NAMPT的表达,并在细胞核外的NAMPT生成NAD,达到上调SIRT1的目的,SIRT1入胞核后抑制CLOCK-BMAL1的表达[7],简称SIRT1环路,形成第3条自主反馈环路。(4)DEC1/DEC2(分化型胚胎软骨发育基因)的表达亦发挥节律基因的作用,DEC1/DEC2与BMAL1结合或与BMAL1-CLOCK竞争性结合E-box元件而抑制其自身转录[8],形成第4条自主反馈环路。除以上环路外,由于E-box元件是关键的DNA反应原件,分布在下丘脑、肝脏等重要器官的各种节律基因的转录均被E-box调控,这些基因在控制昼夜节律的生理过程中发挥重要作用。
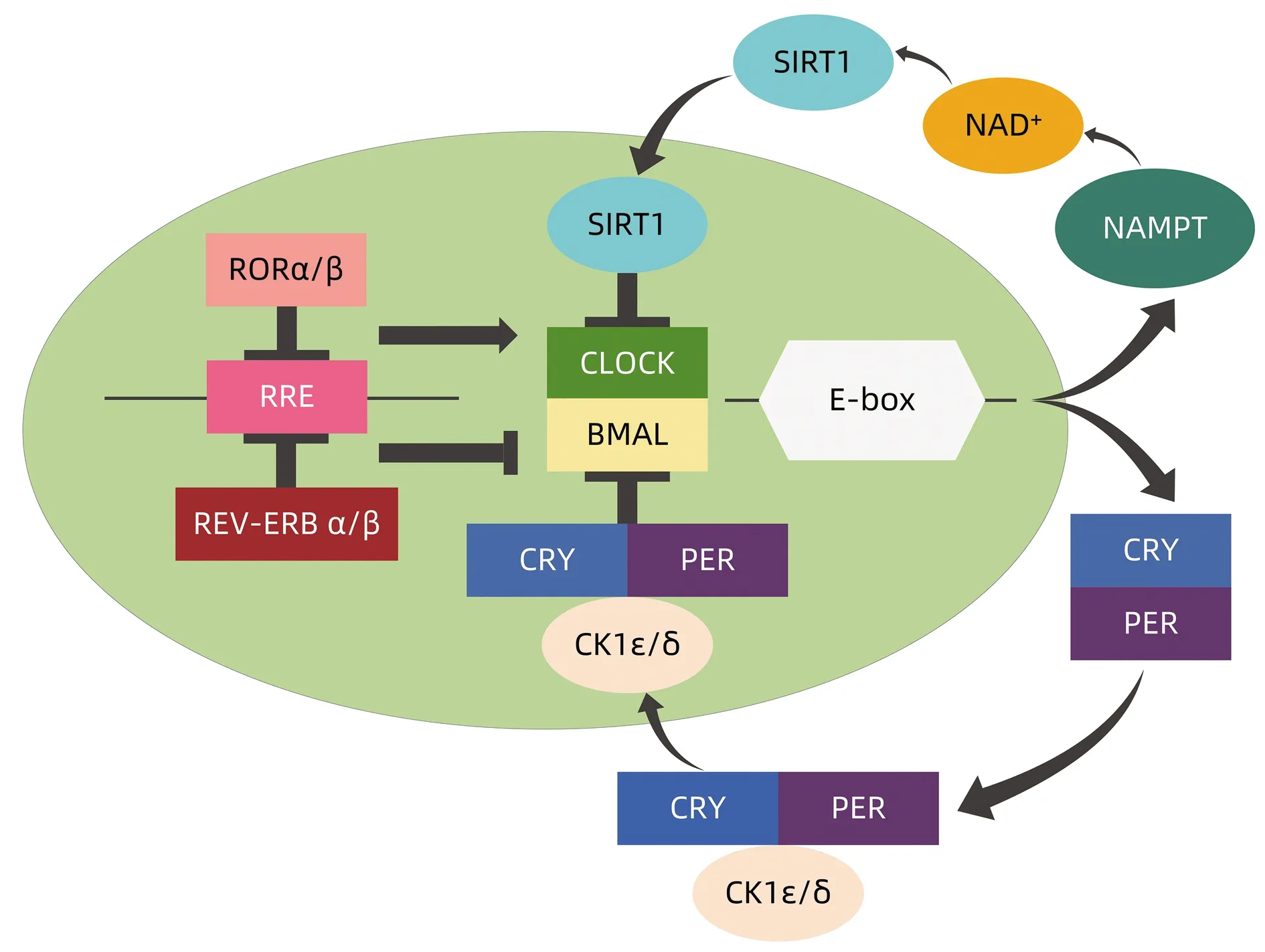
图1 昼夜节律反馈环路
2 昼夜节律影响NAFLD-HCC脂质代谢
2.1 脂质代谢与NAFLD-HCC NAFLD-HCC脂质代谢受损的主要原因是多种原因导致肝细胞中甘油三酯(TG)异常累积,其中IR是最重要的影响因素。IR中胰岛素在抑制脂肪细胞分解中的作用减弱,导致脂肪组织脂解,并增加肝脏对游离脂肪酸的吸收。同时,肝脏对TG的利用受到抑制,从而引起脂质在肝脏中沉积[9]。新生脂肪的形成源于肝脏中脂肪的积累。此外,线粒体功能障碍可能损害脂肪酸β氧化并导致脂质蓄积,通常发生在NAFLD之前。随着脂肪酸β氧化或TG转运受损,肝脏有效清除脂质的能力下降,可能最终导致NAFLD-HCC的进一步发展。
脂质代谢紊乱在NAFLD-HCC起始和进展中发挥关键作用。脂质代谢影响细胞的增殖和分化,可被各种肿瘤抑制基因调节;胆固醇合成酶角鲨烯单加氧酶(SQLE)通过调节胆固醇酯和活性氧促进NAFLD-HCC发生[10]。脂质脂肪酶(lipoprotein lipase,LPL)介导的肝脂质沉积导致小鼠移植肿瘤生长并自发形成肝癌,抑癌基因——锌指同源盒2(ZHX2)通过逆转LPL转录阻止细胞生长和NAFLD-HCC进程[11]。反之,肝脏特异性缺乏抑癌基因——蛋白酪氨酸磷酸酶基因(PTEN)会促进肝脂肪细胞特异性基因及与β氧化有关的基因的表达及脂肪形成,进而导致NASH和HCC的发生[12]。
2.2 昼夜节律参与脂质代谢
昼夜节律基因通过控制动物和人类的脂质节律和血糖维持肝脏稳态。研究[13]显示,159种脂质中有27种在肝脏中震荡,并在主光期的时间门控下达到最高点,提示脂质代谢在肝脏中的积聚受时间控制。脂质的昼夜节律主要由SCN的下丘脑时钟和肝脏、胰腺、肌肉和白色脂肪组织的外周时钟控制。生物钟基因如CLOCK-BMAL1、REV-ERBα/β、RORα/β、PER/CRY等是肝脂质代谢的关键调节因子。
2.2.1 CLOCK-BMAL1 CLOCK转录因子是下丘脑视交叉上核起搏器神经元内分子昼夜节律时钟的关键组成部分,主要通过直接调节脂质代谢基因或影响线粒体活动调控脂质代谢。CLOCK突变小鼠特征是肝脂肪变性、肥胖、高TG血症和高血糖症,全天显示脂质吸收增加。发现血浆TG不显示昼夜节律,一天中水平都较高。以及其他脂质代谢调控基因的表达异常,如脂肪酸结合蛋白1(FABP1)、酰基辅酶A合成酶4(ACSL4)、羟甲基戊二酸单酰辅酶A还原酶(HMG-CoA还原酶)和LDL受体[14]。在动物实验[15]中,CLOCK突变和BMAL1敲除小鼠表现出对高脂饮食喂养的敏感性增加、嗜食和超重,提示肝生物钟基因疗法能够改善昼夜节律紊乱小鼠对高脂饮食介导的脂代谢损伤。果蝇CLOCK突变导致脂质代谢(二酰基甘油和酰基肉碱)减少、饥饿感增加,可能与线粒体活动受损有关[16]。BMAL1在调节脂肪储存,利用和脂肪细胞分化中发挥重要作用。BMAL1敲除导致小鼠肥胖,食物摄入的昼夜节律发生变化,可能与脂肪细胞TG中不饱和脂肪酸数量的减少有关[17]。
2.2.2 REV-ERB、RORα REV-ERB作为核心节律基因可直接通过昼夜节律的方式抑制生脂基因。另一方面,REV-ERB可与肝细胞核因子共同作用调节脂质代谢,下丘脑REV-ERB核受体可控制饮食诱发的肥胖小鼠的昼夜食物摄入量和瘦素(一种生脂基因)敏感性,REV-ERB与肝细胞核因子6协同作用可调节成年小鼠肝脂质代谢[18]。BALB/c小鼠长期服用REV-ERB激动剂SR9011/SR9009时,可见脂肪含量明显减少,体质量减轻,血脂改善[19]。此外,REV-ERBα可改变表观遗传,进而调节肝脂质代谢,随后募集组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3),并诱导染色质重塑和组蛋白修饰。在动物[20]实验中,REV-ERBα/HDAC3敲除小鼠表现出严重的肝脂肪变性,与新生脂肪形成增加和胰岛素敏感性更高有关;低REV-ERBα水平会降低HDAC3在活性/进食期间与肝脏基因结合的能力,从而使脂质脂肪生成;相反,在静息/禁食期间,升高的REV-ERBα水平会增强HDAC3向肝脏代谢基因的募集,从而阻碍脂质的生成。REV-ERBα基因敲除小鼠的肝脏中极低密度脂蛋白水平升高,载脂蛋白C3基因表达升高[21]。综上可见,肝REV-ERB敲除小鼠可表现出明显的肝脂肪变性。
RORα可通过各种抗炎途径影响NAFLD-HCC的代谢损伤。RORα及其配体可诱导超氧化物歧化酶2(SOD2)、谷胱甘肽过氧化酶1(GPx1,一种氧化应激反应因子)的表达,减少肝氧化应激和炎症反应,并减轻小鼠的NASH[22]。研究[23]表明,RORα可增强肝巨噬细胞中的M2极化,通过分泌抗炎和免疫调节性细胞因子IL-10保护肝细胞免受损伤。同时还发现RORα的髓样特异性敲除可增强肝脏对高脂饮食诱导的NASH的敏感性。此外,RORα活化剂通过诱导Krüppel 样因子(KLF)4增强肝巨噬细胞的M2极化并延缓NASH的进展。
2.2.3 PER/CRY PER基因主要通过抑制过氧化物酶体增殖剂激活受体(PPAR)γ的活性或调节脂肪前体细胞KLF15控制脂质代谢:(1)PER2是白色脂肪组织中正常脂质代谢所必需的。PER2可通过充当其天然调节剂,控制PPARγ的促脂肪形成活性,进而控制脂质代谢[24]。(2)PER3可与Klf15发生串扰,从而调节内源性抗原呈递细胞中的脂肪形成[25]。CRY敲除可增加饮食诱导的肥胖易感性,CRY1/2敲除小鼠相较于野生型小鼠,在同样的高脂饮食下更易且更快发生肥胖,且白色脂肪组织中与脂质摄取和脂肪生成相关基因[FAS、乙酰辅酶A羧化酶基因(ACC1)、ACSL4、二酰基甘油酰基转移酶基因(DGAT)1、2等]的表达上调[26]。
Arble等[27]研究显示,12 h光照期喂食高脂食物的大鼠相较于12 h黑暗期喂食组,体质量增加2.5倍;而正常明暗周期下喂食的大鼠体质量增加相对减少,其代谢和激素的日常节律更可控[28]。与不进食的大鼠相比,有时间限制的喂食(在活动阶段进食10 h)可恢复代谢节律并保护CLOCK突变的大鼠不肥胖[29],该研究有力证实了昼夜节律对脂质代谢的广泛影响。反之,肥胖患者中BMAL1、CRY1、CRY2和PER2基因的表达白天显著增加,夜晚下调,表明昼夜节律的基因表达及其下游途径也受到脂质代谢紊乱的影响[30]。昼夜节律基因调节脂质代谢过程中的转运蛋白及有关限速酶的表达,以及脂质代谢反过来影响节律基因的表达,均影响NAFLD-HCC的进展。
3 昼夜节律与糖代谢
尽管直接的葡萄糖信号传导是人体适应葡萄糖可利用性快速变化的主要过程,但生物钟似乎可为规律性复发事件(例如夜间饥饿后的食物摄取)提供节律性基线调整。许多糖代谢相关过程,例如胰岛素和胰高血糖素的分泌以及葡萄糖的产生和摄取,均呈现出强烈的昼夜节律性。由于机体各组织均受到中央起搏器和外周生物钟的影响,昼夜节律对糖代谢的影响包括全身基因敲除和局部组织基因敲除。中央起搏器SCN病变打乱了血糖、胰岛素和胰高血糖素的昼夜节律变化[31]。生物钟基因的组织特异性敲除在外周震荡器中有同样重要的作用,根据组织的不同,效果也不同。肠道中的外周时钟可调节葡萄糖的吸收,肌肉、脂肪组织和肝脏中的外周时钟可调节局部的胰岛素敏感性,而胰腺的外周时钟可调节胰岛素的分泌[32]。昼夜节律基因中,与糖代谢相关研究最多的基因是BMAL1。研究[33]表明,BMAL1全身敲除可导致葡萄糖刺激的ATP产生严重缺陷,导致胰岛素分泌减少,并证实了抑制解偶联蛋白2(UCP2)可以改善BMAL1缺失所致的葡萄糖刺激的胰岛素分泌(GSIS)的减少。胰腺胰岛具有自我维持的昼夜节律基因和转录因子BMAL1和CLOCK的蛋白质震荡。昼夜节律突变小鼠中与生长、葡萄糖代谢和胰岛素信号传导有关的胰岛基因的震荡阶段被延迟,BMAL1和CLOCK突变均显示葡萄糖耐量受损,胰岛素的分泌减少[34]。除胰腺自身的昼夜节律外,骨骼肌、肝脏外周组织特异性缺失BMAL1小鼠的葡萄糖代谢和全身葡萄糖稳态也受到损害。肌肉特异性BMAL1敲除小鼠实验[35]证实,肌肉生物钟的生理作用是为肌肉细胞从休息/禁食阶段到活动/进食阶段的过渡做准备,为能量供应和需求的周期性波动建立基础。而肌肉特异性BMAL1敲除和随之而来的肌肉时钟紊乱将导致代谢水平降低,其特征是肌肉胰岛素抵抗和葡萄糖代谢紊乱。由此可见,肌肉BMAL1缺失与胰岛素敏感性降低和葡萄糖氧化有关。肝脏BMAL1敲除小鼠在胰岛素正常产生和血脂异常(高循环游离脂肪酸和高肝TG水平)的情况下,禁食期间表现出低血糖症,并清除了更多的葡萄糖[36]。小鼠肝脏中,BMAL1表达被KLF的三锌指家族成员转录抑制。KLF10可感知细胞内葡萄糖水平,其功能主要是通过脂肪生成、糖酵解和糖异生调节肝脏代谢。KLF10在野生型小鼠肝脏中显示出强大的昼夜节律表达模式,BMAL1敲除小鼠中并无此模式,发现BMAL1调节KLF10在小鼠中的昼夜节律表达,BMAL1缺失导致糖脂代谢紊乱[37]。与上述研究不同的是,有研究[17]发现脂肪组织中选择性缺乏BMAL1的小鼠体质量增加,但局部胰岛素敏感性正常。
4 昼夜节律与肠道菌群
研究[38]发现,肠道菌群的组成、相对丰度及功能均呈昼夜震荡,其周期与人的中央生物钟相同(24 h),进食节律可调节宿主生物钟组成或时差诱导所致的肠道菌群昼夜波动及功能异常。昼夜节律主要通过宿主的进食节律、饮食结构影响肠道菌群:(1)有节律的进食导致肠道菌群发生震荡,宏观基因组波动的原因可能是某类菌群有节奏地占据生态位,而生态位可对饥饿或进食做出回应。进食节律受损引起的PER1/2缺失导致肠道菌群发生昼夜波动,粪菌移植给无菌小鼠会导致葡萄糖不耐受和肥胖的发生[38]。Zarrinpar等[39]研究显示,饮食引起的肥胖小鼠肠道菌群的节律性波动可通过限时喂养恢复,进食节律为肠道菌群的节律提供动力,如黑暗期首先进食的是夜间龋齿动物;相对而言,PER1/2双敲除小鼠昼夜进食节律明显减弱,可见肠道菌群的节律减弱是进食时间改变导致的。(2)饮食结构:在小鼠“人工昼夜”中,低脂或高脂饮食的无菌小鼠表现出明显的中枢和肝脏昼夜节律基因表达受损,高脂饮食导致微生物的alpha多样性(反映菌群的多样性)改变,Shannon指数显著降低(指数高则菌群多样性高),表明高脂饮食下昼夜节律的菌群丰度被抑制,且节律震荡减弱[40]。(3)此外宿主生物钟调节因子亦影响菌群在肠道内的定植。肠道菌群在明暗循环中表现出节律性,生物钟调节因子(褪黑激素)通过重新编程肠道菌群而改善宿主脂质代谢。肠道菌群中的29种菌种的组成和丰度与肝脏中的节律基因表达相关,具体而言与CLOCK、CRY1、PER2等基因表达呈正相关,而与PER1和CRY2表达呈负相关,表明肠道菌群与生物钟基因和血清脂质水平相关[41]。反之,宿主的昼夜节律和脂质代谢也受到肠道菌群的影响,肠道菌群通过影响循环信号、肠内神经元和迷走神经传入信号,向大脑传递饥饿和饱足信号,参与食物摄入和喂养节律的昼夜调节,从而影响脂质代谢[38]。肠道菌群通过HDAC3控制脂质吸收的同时编程小鼠昼夜代谢节律[42]。
综上所述,昼夜节律和肠道菌群影响脂质代谢相关疾病的进展,提示临床中因肠道菌群失衡所致的NAFLD相关疾病可从规范节律性饮食角度考虑。
5 昼夜节律与NAFLD-HCC
昼夜节律基因在调节细胞周期、免疫检查点确定、基因组稳定性和DNA修复中对NAFLD-HCC病程进展起关键作用。在CLOCK突变、CRY1/2双基因敲除小鼠实验[43]中发现,从G2到M过渡的细胞周期进程的Wee1因子的昼夜节律表达被破坏。生物钟基因NPAS2(神经元PAS结构域蛋白2)可在HCC中过表达,并通过在体外和体内促进细胞增殖和抑制线粒体相关的内在凋亡来诱导细胞存活。转录上调CDC25A磷酸酶(细胞周期调节因子)可刺激NPAS2表达。此外,BMAL1/NPAS2异源二聚体可与CDC25A启动子区域中的E-box元件结合,并参与HCC中NPAS2介导的肿瘤细胞存活[44]。在动物实验[45]中,PER/CRY基因敲除小鼠可形成少量但体积较大的NAFLD诱导的HCC,50周龄时被首次发现;BMAL1敲除小鼠形成的瘤体数量增加,但在70周龄时发现的HCC体积较小;慢性时差会增加PER/CRY基因敲除小鼠的HCC数量和大小;两种性别BMAL1突变小鼠HCC发生风险均升高,且雄性较雌性更高。近年来,肿瘤免疫逃逸理论盛行,而昼夜节律是优化免疫反应的关键因素:即免疫细胞的内在节律性调节与外部环境之间的相互作用可优化免疫反应。研究[46]发现,昼夜节律的核心负调节因子(PER1/2/3、CRY1/2)在许多肿瘤中表达均下调,该现象与T淋巴细胞衰竭以及免疫抑制分子(程序性死亡配体1和细胞毒性T淋巴细胞相关蛋白4)的整体上调显著相关。
6 从昼夜节律出发对NAFLD-HCC的临床指导
昼夜节律通过各种途径影响NAFLD-HCC的进展,据此,为达到影响最小化,需要采取合理而有效的干预方式:(1)优化轮班工作时间并减少社会性时差,保证睡眠时间和质量;(2)限制进食时间,减少夜宵等夜间食物摄取;(3)注意营养调节,改变膳食比例,均衡饮食;(4)合理开展有氧运动。现实中应通过各种措施督导患者,减缓NAFLD-HCC病情的进展。
7 小结
通过梳理近年关于昼夜节律系统影响NAFLD-HCC的研究进展,可以提升对昼夜节律基因在调节脂质代谢、糖代谢及肠道菌群中对NAFLD-HCC影响的认识。虽然目前已证实昼夜节律紊乱与NAFLD-HCC发病率增加有关,但其机制在疾病发展中所占比重仍很难评估。因此,需要进一步研究昼夜节律参与代谢、致病过程中的分子途径,不仅要为治疗提供靶点,更重要的是防病于未然,更好地改善公众健康。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:朱金霞负责设计课题,分析资料,撰写论文;杨培伟负责数据收集,修改论文;刘光伟负责拟定写作思路,指导文章写作及最终定稿。
