三磷酸次黄嘌呤核苷基因多态性对利巴韦林联合直接抗病毒药物治疗丙型肝炎致溶血性贫血的预测价值
2021-11-04徐金凤仇丽霞于海滨刘义荣柳雅立
徐金凤, 仇丽霞, 于海滨, 刘义荣, 张 晶, 柳雅立, 林 伟
1 河北中石油中心医院 感染科, 河北 廊坊 065000;2 首都医科大学附属北京佑安医院 丙肝与中毒性肝病科, 北京 100071
近几年,慢性丙型肝炎的抗病毒治疗已经从干扰素+利巴韦林(RBV)时代跃进到全口服直接抗病毒药物(DAA)时代。在某些特殊丙型肝炎人群,全口服抗病毒方案仍然需要加用RBV以提高疗效或缩短疗程,例如失代偿期肝硬化、基因3型、全口服药物治疗失败,以及预期治疗效果不佳的患者[1]。RBV在成功清除HCV治疗中发挥重要作用。然而应用RBV的部分患者可引起溶血性贫血,从而被迫减量或停用,导致疗效降低或疗程延长及费用增加。已经明确,在以干扰素联合RBV为基础的丙型肝炎治疗中三磷酸次黄嘌呤肌苷(inosine triphosphate pyrophosphatase,ITPA)rs1127354位点基因多态性与贫血发生密切相关,CC基因型较非CC基因型(CA/AA)更易发生贫血[2]。RBV引起贫血的机制目前不是完全清楚,可能的机制是RBV被摄入红细胞并被活化为RBV三磷酸盐,由于红细胞缺乏脱磷酸化的酶,从而不能水解三磷酸盐,导致RBV三磷酸盐在红细胞内浓度不断累积,损害抗氧化剂的防御作用,造成可逆性溶血性贫血。但是由于DAA应用时间较短,尚无更多经验,基于DAA治疗的高昂花费,在治疗前明确DAA+RBV治疗中贫血发生的危险因素有助于提高疗效和节约经费,制订更加安全有效的治疗方案。
1 资料与方法
1.1 研究对象 选取2018年1月—2019年7月于河北中石油中心医院门诊及住院就诊的慢性丙型肝炎(CHC)及丙型肝炎肝硬化且应用DAA联合RBV方案抗病毒治疗的患者,其诊断及治疗适应证根据《丙型肝炎防治指南(2015年更新版)》[3]。入选标准:HCV感染超过6个月,或有6个月以上的流行病学史,或发病日期不明;抗HCV及HCV RNA 阳性;代偿期或失代偿期肝硬化;采用DAA+RBV方案治疗,至少12周。排除标准:未遵嘱服药及更换治疗方案患者;随访缺失患者。
1.2 治疗方案 采用RBV联合DAA抗病毒治疗,DAA治疗方案:索磷布韦/维帕他韦(含索磷布韦400 mg、维帕他韦100 mg)1片,1次/d,口服(早晨);或索磷布韦/雷迪帕韦(含索磷布韦400 mg、雷迪帕韦90 mg)1片,1次/d,口服(早晨),疗程均为12周。RBV治疗方案:体质量<75 kg,RBV 1000 mg/d(早晨服用5粒,傍晚服用5粒);体质量≥75 kg,RBV 1200 mg/d(早晨服用6粒,傍晚服用6粒)。所有患者均于抗病毒开始前及治疗2、4、8、12周清晨抽取空腹静脉血进行检测。在治疗过程中,当Hb水平<100 g/L时,RBV减量至600 mg;当Hb<85 g/L时停用RBV治疗。
1.3 主要材料及仪器 应用西安天隆科技有限公司荧光检测仪RT-Cycler TM 436/TL998A(V2.0.711软件系统)检测ITPA rs1127354位点基因型,检测方法按说明书进行;HCV RNA检测试剂盒(罗氏分子系统,美国);血球为日本SYSMEX(希森美康)XN系列;应用TL998A基因扩增荧光检测仪检测HCV基因型,检测方法按说明书进行。
1.4 伦理学审查 本研究通过河北中石油中心医院医学伦理委员会审批,批号:KYLL-2019-11,患者及家属均签署知情同意书。
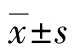
2 结果
2.1 一般资料 共入选符合标准病例55例,其中未能完成抗病毒治疗及未按要求随访者6例,从本研究中剔除,本组共纳入49例患者,一般资料详见表1。CHC患者22例(44.9%),肝硬化27例(55.1%),其中代偿期肝硬化17例(34.7%),失代偿期肝硬化10例(20.4%)。
本组均应用DAA+RBV方案抗病毒治疗,其中索磷布韦/维帕他韦38例(77.6%),索磷布韦/雷迪帕韦11例(224%),1例患者因肝细胞癌未完成DAA疗程,于治疗12周退出研究,RBV减量患者抗病毒治疗不变仍为12周,停药患者延长抗病毒治疗至24周。总体12周持续病毒学应答(SVR12)率为95.9%(表1),其中1例失代偿期肝硬化患者因并发肝细胞癌未完成抗病毒治疗,未实现SVR12;1例代偿期肝硬化患者于治疗8周开始HCV RNA持续未检测到,治疗12周停药,停药后12周再次检测到HCV RNA。
因贫血RBV减量者3例(其中AA/AC组2例,CC组1例),停药3例(其中AA/AC组1例,CC组2例),以上RBV停药、减量病例均为肝硬化患者,停药/减量共6例患者最终均达到SVR。
2.2 RBV停药、减量患者的Hb情况 在治疗过程中2例Hb<100 g/L且≥85 g/L给予RBV减量至600 mg/d,Hb没有回升且<85 g/L时RBV停用,1例因明显的头晕、心悸于治疗4周停用RBV,停用RBV后抗病毒治疗疗程延长至24周(表2)。
在治疗过程中3例出现Hb<100 g/L且≥ 85 g/L,给予RBV减量至600 mg/d,Hb保持≥85 g/L,RBV继续应用600 mg/d至疗程结束(表3)。

表1 DAA+RBV治疗的丙型肝炎患者基线临床资料

表2 3例RBV停药患者的ITPA基因型及Hb变化情况
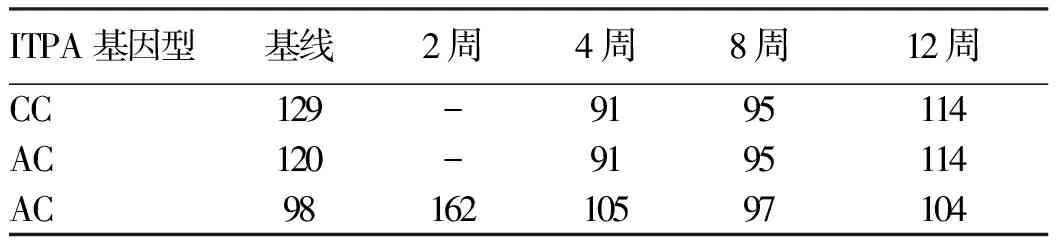
表3 3例RBV减量药患者的ITPA基因型及Hb变化情况
2.3 ITPA(rs1127354)基因型与Hb下降的关系 ITPA基因rs1127354位点主要等位基因是C等位基因,次要等位基因为A等位基因,将AA与AC合并与CC基因型进行比较,2、4、8、12周分别有1、4、8、7例患者未进行随访(图1)。比较AA/AC型与CC型两组患者Hb较基线下降最大值的关系,结果显示两组差异无明显统计学意义(Z=-0.18,P=0.87)。
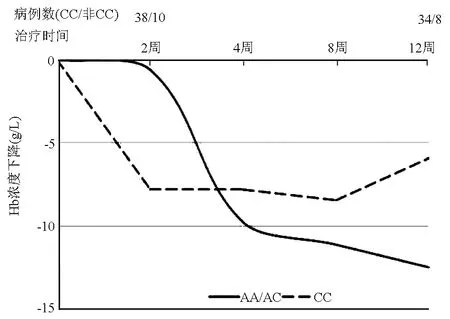
图1 DAA+RBV治疗过程中CC组与非CC组Hb下降情况比较
3 讨论
丙型肝炎是由HCV引起的肝脏急、慢性炎症。丙型肝炎呈全球性流行,不同性别、年龄、种族、民族人群均对HCV易感。目前,全球有超过1.85亿HCV慢性感染者,感染者可能在20~30年内发展为肝硬化和肝细胞癌,每年有超过35万人死于HCV相关疾病[1]。有效的抗病毒治疗可改善肝组织学,清除或减轻HCV相关肝损伤,逆转肝纤维化,阻止进展为肝硬化、失代偿期肝硬化、肝衰竭或肝细胞癌,提高患者的长期生存率与生活质量,预防HCV传播。丙型肝炎抗病毒治疗的目标是清除HCV,实现SVR,获得治愈,清除或减轻HCV相关肝损伤,阻止其进展,改善患者的长期生存率,提高患者的生活质量[2]。
近10年来,丙型肝炎的治疗依赖于干扰素联合RBV,近2年DAA的出现提高了SVR率,然而在非常难治型患者(失代偿期肝硬化及DAA经两次经治复发者)、基因3型或某些代偿期肝硬化患者的DAA方案中仍然需要加用RBV以缩短疗程或提高疗效[3-4]。RBV在丙型肝炎抗病毒治疗中不可或缺,但是由于其副作用限制了其临床应用,特别是诱发溶血性贫血的副作用。10%~14%的患者因严重贫血需要减少RBV的剂量和/或缩短疗程,从而影响抗病毒治疗效果。
在干扰素联合RBV抗HCV治疗过程中,主要的血液系统副反应为RBV引起的溶血性贫血和干扰素诱导的骨髓毒性[5-6],需要在早期调整RBV的剂量,影响病毒学应答。2010年,美国Fellay等[7]在全基因组关联研究中发现, 在干扰素联合RBV抗HCV治疗中,RBV诱发贫血与否及严重程度与患者ITPA基因功能性单核苷酸多态性有关。近几年多项研究[8-11]表明,ITPA基因rs1127354位点基因多态性与治疗中的溶血性贫血的发生相关。可见,在丙型肝炎PR方案抗病毒治疗过程中,ITPA基因rs1127354位点基因多态性可用来预测丙型肝炎患者PR治疗后引起的溶血性贫血。
DAA刚刚于我国上市不久,DAA+RBV治疗的患者出现贫血的风险尚不明确,有研究表明,即使是部分肝硬化患者在治疗前已经存在贫血,接受索拉非尼+RBV治疗后的ITPA基因AA/AC患者较少需要RBV剂量减低。Murakawa等[12]入选90例CHC基因2型的患者进行索拉非尼+RBV抗病毒治疗,发现具有ITPA基因rs1127354位点AA/AC基因型的患者在整个治疗期间贫血程度比CC基因型轻,AA/AC基因型患者较CC基因型患者需要RBV剂量减少的患者百分比显著降低[38.5%(25/65)vs 8%(2/25),P=0.004 5]。Suzuki等[13]在基于61例CHC基因1型的患者的三联疗法治疗(telaprevir+干扰素+RBV)中研究发现,ITPA基因rs1127354位点基因多态性影响抗病毒治疗期间的Hb水平。Morio等[14]在对212例基因1型CHC患者的研究中发现,在接受DAA加聚乙二醇干扰素/RBV三联疗法治疗时,Hb水平的降低更快且更大,并且ITPA基因型CC患者中RBV剂量减少的患者的累积比例显著高于AA/AC患者(84.7% vs 100%,P=0.018)。而Urabe等[15]的研究表明RBV相关溶血同时与ITPA基因型及肾小球过滤共同相关,肾小球滤过率≥75 ml·min-1·1.73 m-2病例组较肾小球滤过率<75 ml·min-1·1.73 m-2的病例组抗病毒治疗12周过程中更容易出现Hb水平显著下降(P<0.05)。
本研究结果提示,在RBV联合DAA治疗过程中,因为贫血停药和减量RBV的患者仍然存在。但是由于在CC型和非CC型均存在,并且80%以上的患者是CC型,因此在应用RBV前进行ITPA基线检测未能增加治疗过程中的安全性,仍需要进行Hb的监测。因此,不建议进行常规的ITPA基因多态性检测。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张晶、柳雅立负责课题设计,拟定写作思路,修改论文;徐金凤、仇丽霞、刘义荣参与收集数据,资料分析,撰写文章;于海滨、林伟负责资料分析,修改论文并最后定稿。
