Krüppel样因子4在肝细胞癌发生发展中的作用机制
2021-11-04苏维玮付艳华王经伟
孙 菲, 苏维玮, 付艳华, 王经伟
山东大学齐鲁医院(青岛) 肝病科, 山东 青岛 266035
肝细胞癌(HCC)发病率高、预后差,是全球范围内常见的消化系统恶性肿瘤。早期肝癌以手术切除为主,中晚期肝癌主要治疗方式包括局部消融、经肝动脉栓塞化疗、免疫及靶向治疗等,但总体治疗效果欠佳,我国肝癌患者5年存活率仅12.1%[1]。因此进一步研究原发性肝癌发病机制及寻找新的治疗靶点显得十分重要。Krüppel样因子(Krüppel-like factors,KLFs)为锌指蛋白类转录因子,目前,已鉴定包含17个人类KLFs成员。KLF4是KLFs家族重要成员之一,属于C2H2型锌指蛋白,参与调控细胞周期、炎症反应以及细胞增殖、凋亡,并与肿瘤的发生发展密切相关,在诱导干细胞分化、胚胎发育及调控上皮-间质转化(epithelial-mesenchymal transition,EMT)等过程中发挥重要作用。目前,KLF4已被证实在HCC中表达下降,进一步研究证实上调KLF4可以抑制肝癌细胞增殖、侵袭[2]。相关研究[3-5]证明,KLF4在肝癌中参与调节Notch通路、Wnt/β-catenin等多个信号通路,与肝癌发生发展密切相关,但其中的具体调控机制仍未完全明确,本文将从KLF4的结构、功能以及在肝癌中发挥的作用进行综述。
1 KLF4的结构特点与功能
人KLF4基因位于染色体9q31,编码的KLF4蛋白含470个氨基酸残基,分子量约55 kDa。小鼠的KLF4基因定位于染色体4B3,编码含483个氨基酸残基的多肽,与人类KLF4氨基酸序列相比,同源性为91%。KLF4蛋白含有2个核定位信号,分别位于锌指结构的N-端及前方,二者都能单独将KLF4蛋白转移至细胞核内。KLF4蛋白具备3个主要功能结构域[6]:羧基端DNA结合域、氨基端转录调节域、锌指结构核定位序列。KLF4羧基端序列高度保守,包含3个连续的Cys2-His2锌指结构,发挥特异性结合DNA的作用;氨基端转录调节域序列高度变异,其中转录激活结构域富含脯氨酸和丝氨酸,位于91~117位氨基酸残基处;转录抑制结构域富含脯氨酸,位于第181~371氨基酸残基处。同时具备激活域和抑制域使得KLF4对下游靶基因具有活化和抑制双重调控作用[7]。
KLF4介导的基因转录通过磷酸化、乙酰化、甲基化和泛素化等多种方式进行翻译后修饰。这些修饰通过改变KLF4的蛋白质结构稳定性、DNA结合能力和转录活性来调控其功能[8]。KLF4第225及229位赖氨酸残基受p300/CBP复合物调节,发生乙酰化修饰后突变为精氨酸,KLF4活性受到抑制[9],进而削弱其反式激活靶基因的能力。而抑制组蛋白乙酰化和精氨酸甲基化能够协同作用激活KLF4表达。研究[10]表明,磷酸化ERK1和ERK2可抑制KLF4活性,同时可将F-box蛋白βTrCP1或βTrCP2聚集到KLF4的N端结构域,进而导致KLF4的泛素化和降解,同时促进胚胎干细胞分化。Yang等[11]发现,宫颈癌细胞中KLF4启动子CpG岛高甲基化状态诱导KLF4失活,抑制其肿瘤抑制因子功能。由此可见,KLF4介导的基因转录受多种方式调节修饰。
KLF4高表达于胃肠道上皮细胞,在角膜、血管内皮、睾丸组织、胸腺细胞和T淋巴细胞也有不同程度的表达。研究[12]表明,KLF4参与调控细胞分化、炎症反应、胚胎发育等生命过程,并与肿瘤的发生、发展及预后密切相关。KLF4同时具备转录激活域和转录抑制域,因此KLF4在不同肿瘤发展过程中可作为癌基因或抑癌基因发挥不同功效,可作为肿瘤治疗的分子靶点。KLF4作为抑癌基因还是癌基因发挥作用,受细胞分化差异、细胞核基因表达状态以及细胞染色质环境等因素调节,具体机制尚待进一步探究。研究表明, KLF4在胃癌[13]、食管癌[14]、结肠癌[15]、胰腺癌[16]等多种肿瘤中发挥抑癌作用。相反,KLF4在皮肤鳞癌、喉癌等肿瘤中发挥促癌作用。Lin等[17]研究发现KLF4在HCC中呈现低表达, 增加KLF4表达可以逆转EMT过程并促进肝癌细胞凋亡,肝癌患者中低表达KLF4者预后相对更差,更易发生肝内转移及肝外转移。
2 KLF4与肝癌细胞增殖
KLF4不仅是正常细胞增殖的重要调控因子,也能够调控各种肿瘤细胞的生长增殖。相关研究表明肝癌组织和细胞中KLF4表达明显下调或缺失,KLF4对肝癌细胞增殖和侵袭转移发挥抑制作用[18-19],提示肝癌中KLF4是一个抑癌基因。KLF4对于抑制肝癌细胞增殖与阻滞细胞周期有关。KLF4通过作用于p21CIP1/WAF1基因启动子中富含GC的特异性顺式作用元件,反式激活p21CIP1/WAF1等细胞周期负性调控因子,抑制细胞周期蛋白cyclinB1及cyclinD1的表达,将细胞周期阻滞于G1/S期或者G2/M期,进而抑制肿瘤增殖[20]。KLF4还可以上调细胞周期抑制蛋白CDKN1A的表达,KLF4通过结合特异性SP1样顺式元件来激活CDKN1A启动子,同时聚集p53到CDKN1A启动子区域,进而激活CDKN1A基因的转录。CDKN1A在多种肿瘤中可抑制细胞生长增殖,通过抑制G1期向S期进展负性调控细胞周期。CDKN1A还可激活p21CIP1/WAF1并促进其转录表达,而p21CIP1/WAF1激活是p53、APC及TGFβ等肿瘤抑制信号通路激活的核心环节。研究[21]表明KLF4可以上调P-cadherin的表达,而P-cadherin在肝癌中通过调节GSK-3β抑制肿瘤生长增殖。Li等[22]研究发现,在肝癌细胞中,KLF4甲基化修饰后表达沉默,导致其下游靶基因维生素D3受体与维生素D3作用减弱,抑制后者抗增殖效应,促进肝癌细胞增殖及侵袭。而上调KLF4表达能明显抑制裸鼠移植瘤的生长和转移,提示KLF4可作为肝癌基因治疗的新靶点。相关研究[23]发现肝癌中KLF4上调CD9和CD81的表达,后者通过负向调节MAPK/JNK信号通路来抑制细胞增殖,发挥肿瘤抑制作用。以上研究表明,KLF4在肝癌中发挥负性调控细胞周期、抑制细胞增殖的作用。
3 KLF4与肝癌细胞EMT及转移侵袭
EMT涉及各种实体肿瘤发生侵袭前丢失上皮细胞特性和获得间充质细胞特性,是癌变的中心步骤。获得间充质特性将这些细胞从原发性肿瘤中释放出来,使它们侵入邻近的组织,进入循环并转移至远处的器官。多种转录因子参与调控EMT激活和发展,如Snail-1/2、Zeb-1/2、Twist、TGFβ1等,KLF4也是其中之一,可直接抑制EMT关键基因的表达。在HCC中,KLF4通过调控ERK、PI3K/AKT、Wnt/β-catenin等信号通路发挥作用,抑制EMT[24]。KLFs家族成员KLF11通过与Smad7启动子结合而抑制其表达,进而促进肝癌细胞EMT。而KLF4通过与KLF11启动子结合,抑制其诱导的肝癌EMT过程[25]。同时,KLF4还可以通过与Smad7启动子结合而上调其表达,通过这条途径,抑制TGFβ信号传导,因此,在HCC细胞中KLF4表达的缺失可能有助于致癌性TGFβ信号的激活和随后的肿瘤进展[26]。结肠癌中KLF4通过抑制TGFβ1/Smad信号传导,抑制结肠癌细胞EMT进展,降低其侵袭力[27]。Lin等[17]研究发现,在HCC中,上调KLF4表达可以抑制其间充质特性,使细胞形态向上皮细胞转化,进而抑制肝癌细胞的转移和侵袭,反之敲除KLF4则使细胞获得间质特性并促进细胞增殖和迁移。其机制可能是通过KLF4 特异性结合slug启动子并抑制其活性,而上调slug表达可一定程度逆转KLF4介导的细胞上皮样表型。Liu等[28]研究表明,在前列腺癌中,KLF4可以抑制slug转录表达,KLF4缺失促进slug依赖的EMT发生,进而促进肿瘤的转移。以上研究表明,KLF4对肿瘤EMT过程发挥抑制作用,进而降低肿瘤的迁移、侵袭能力,抑制肿瘤进一步恶性进展。
研究[29]表明,KLF4表达缺失的肿瘤细胞更具侵袭性,肺癌细胞中上调KLF4表达可以增加CDH1的表达,并抑制SNAI2、TWIST1和Vimentin的表达,进而抑制细胞的迁移和入侵。在顺铂耐药鼻咽癌细胞中,KLF4通过抑制NOTCH1表达进而抑制细胞迁移侵袭[30]。在HCC中,KLF4通过与miRNA相互作用,抑制SNAI1、SNAI2和ZEB1表达,进而抑制肝癌细胞迁移侵袭[31]。He等[32]研究发现,在HCC中,肿瘤坏死因子受体相关因子7(TRAF7)作为一种E3-泛素连接酶,通过将KLF4泛素化和降解进而促进HCC的迁移和侵袭。研究[33]表明肝癌中KLF4的转录活性被DDX17负性调节,后者在肝癌中促进肿瘤增殖转移。KLF4还可以上调金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinases,TIMP)-1、TIMP-2表达,后者参与调节细胞外基质降解,进而降低肝癌细胞侵袭力[34]。Yang等[35]及Rajasekaran等[36]研究发现,单酰甘油酯酶(monoacylglycerol lipase,MGLL)在肝癌中低表达,是肝癌中KLF4作用的靶基因之一。MGLL低表达的患者5年生存率降低,MGLL过表达抑制HCC细胞迁移侵袭,KLF4与MGLL启动子结合并上调HCC细胞中MGLL的表达。与周围的非肿瘤组织相比,HCC中KLF4的表达降低,并且与肿瘤数量、分化等级、淋巴结转移和远处转移呈负相关,低KLF4表达可能意味着HCC患者的预后较差[37]。
4 KLF4与肝癌凋亡
KLF4基因不仅影响细胞增殖、分化,而且与细胞凋亡密切相关。KLF4在黑色素瘤通过减少肿瘤细胞凋亡促进细胞的生长,发挥促癌作用[38]。研究[39-40]表明KLF4激活可以导致p53上调和抑制Bcl-xL的表达, 通过凋亡诱导细胞死亡。KLF4可以调节p53启动子的转录,而p53可以调节KLF4的表达,KLF4和p53之间的反馈回路可以促进细胞凋亡。凋亡过程的另一个重要调节剂是caspase家族,在Bax作用下,细胞线粒体渗透性增加,导致caspase3和caspase7激活,进而促进细胞凋亡。激活Bax转录是KLF4诱导细胞凋亡途径之一[41]。BIK通过与Bcl-2及Bcl-xL公共BH3结构域直接作用,抑制其抗细胞凋亡功能,并以Bax依赖的方式引起细胞凋亡,Zhang等[42]证明KLF4是顺铂诱导细胞凋亡的重要调节剂,他们发现KLF4上调了前列腺癌细胞中BIK的表达,并促进顺铂诱导的BIK的表达。在不同肿瘤中,KLF4可以反过来发挥抑制细胞凋亡的功能。KLF4在高达70%的人类乳腺癌中过表达,而KLF4的核定位与侵袭性表型相关,乳腺癌中KLF4通过直接作用于p53启动子中的PE21元件来抑制p53的表达,在此背景下,KLF4抑制DNA损伤诱导的细胞凋亡。以上KLF4在HCC中的作用见图1。
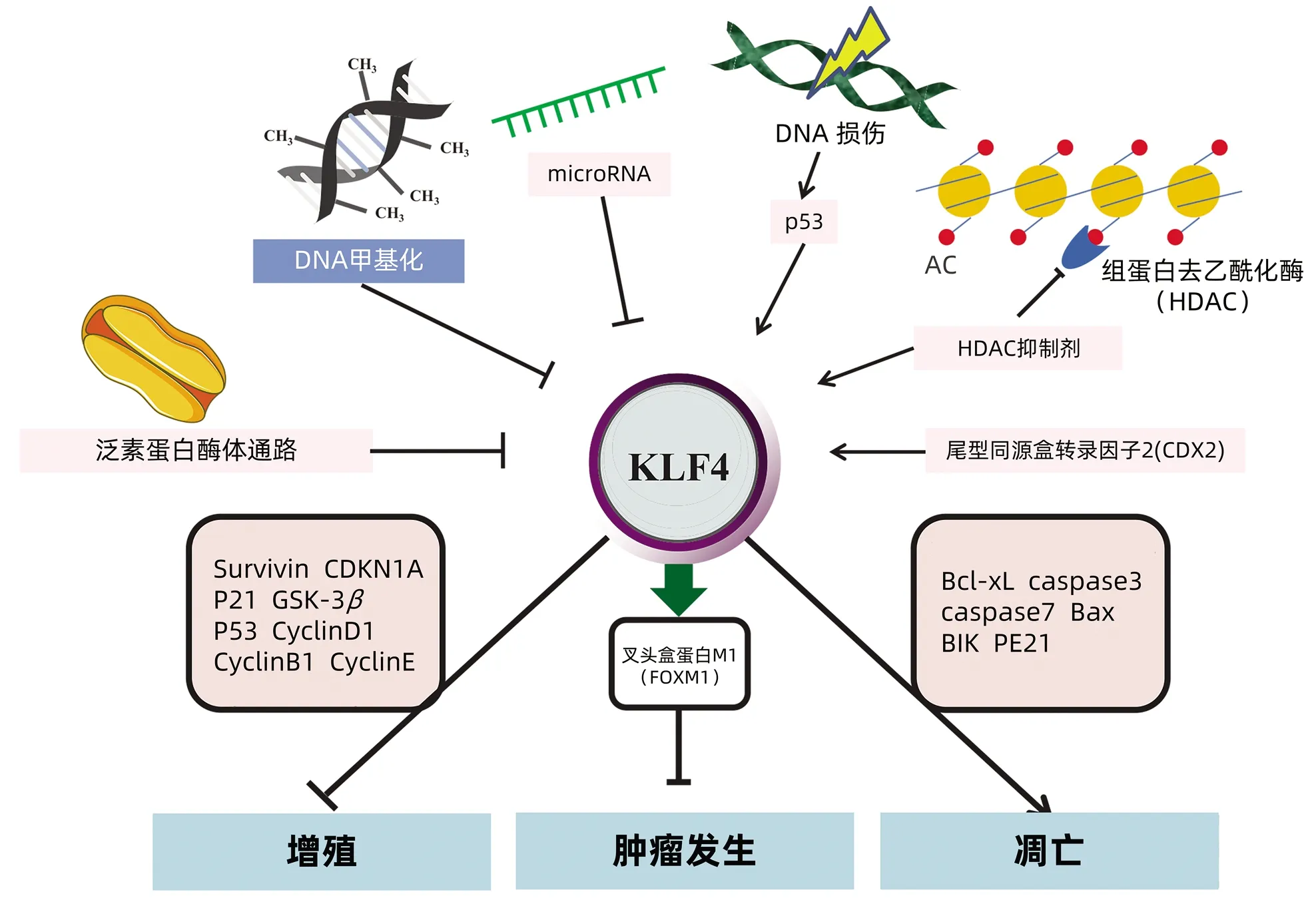
注:KLF4的表达受到DNA甲基化、microRNA、DNA损伤等因素调节。KLF4调控的下游靶基因介导了KLF4在肝癌细胞中的抑制作用。
5 小结
目前,临床上治疗肝癌的方案较多,但多数患者治疗效果欠佳、预后较差。了解KLF4在肝癌中的作用有助于人们进一步明确肝癌发生发展机制,并为肝癌治疗提供新的思路。KLF4作为锌指转录因子家族中重要成员,在调控细胞增殖、分化、凋亡等环节发挥重要的作用,与肿瘤发生发展密切相关,KLF4在多数乳腺癌、前列腺癌和黑色素瘤中发挥促癌作用;而在胃癌、膀胱癌、结肠癌、肺癌等肿瘤中发挥抑癌作用。KLF4在HCC中低表达,增加KLF4表达可以抑制肝癌细胞增殖和转移侵袭,关于KLF4在肝癌中具体作用机制尚需进一步研究,KLF4不仅可能成为肝癌有价值的预后生物标志物,也可能成为肝癌的治疗靶点[43],为肝癌的分子靶向治疗和预后监测提供新思路。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:孙菲负责课题设计,资料分析,撰写论文;苏维玮、付艳华参与收集数据,修改论文;王经伟负责拟定写作思路,指导撰写文章并最后定稿。
