马兜铃酸Ⅰ致小鼠急性肝毒性的转录组学分析
2021-11-04朱哿瑞刘成海陶艳艳
朱哿瑞, 王 静, 黄 恺, 彭 渊, 刘成海,, 陶艳艳
1 上海中医药大学附属曙光医院 肝病研究所, 上海 201203;2 上海市中医临床重点实验室, 上海 201203
马兜铃酸(aristolochic acids,AA)是一种硝基菲类化合物,广泛分布在马兜铃属和细辛属植物中[1],已知的AA类化合物主要有4种,分别为AA Ⅰ、Ⅱ、Ⅲ、Ⅳ,其中AA Ⅰ为主要毒性成分且毒性最强,AA Ⅱ次之,二者均是引起肾毒性和基因毒性的主要原因[2-3]。AA具有免疫激活、抗炎、肾毒性、致癌性和致突变性等作用[4],新近研究[5]表明,AA与肝癌密切相关。但AA与肝癌的关系仍有争议,因此对于AAⅠ导致肝损伤的研究还是十分必要的。
转录组学主要从RNA水平研究基因的整体表达情况,是功能基因组学重要的组成部分[6]。随着高通量测序技术的发展,转录组测序技术(RNA-Seq)凭借测序成本低、精度高、覆盖范围广等优点[7],已成为转录组分析的重要方法,为研究基因表达模式、疾病的生物标志物探测等提供了新的手段。本研究采用IIIumina HiSeq X Ten高通量测序平台,对AAⅠ致小鼠肝损伤进行高通量测序,建立相应的转录组数据库,继而进行差异表达分析以及GO、KEGG富集分析,并以实时荧光定量PCR(qRT-PCR)验证本转录表达的可靠性,以进一步明确AAⅠ致肝毒性的分子机制。
1 材料与方法
1.1 动物 C57BL/6雄性小鼠15只,体质量23~25 g,SPF级,购自上海南方模式生物科技股份有限公司,动物生产许可证号:SCXK(沪)2017-0010;动物使用许可证号:SYXK(沪)2019-0003。按照SPF级动物饲养要求进行饲养。
1.2 试验药物 AAⅠ (批号:3503),购自上海诗丹德标准技术服务有限公司,纯度>98.5 %;羧甲基纤维素钠(批号:F20051103),购自国药集团化学试剂有限公司。
1.3 试剂 ALT试剂盒(批号:20130110)、AST试剂盒(批号:20130411),购自南京建成生物工程研究所;Trizol Reagent (批号:F919KB3054)、总RNA提取试剂盒(批号:B518811),购自上海生工生物工程股份有限公司;反转录试剂盒(批号:AJ92014A)、扩增试剂盒(批号:AJF0343A),购自日本TAKARA公司。
1.4 实验方法
1.4.1 动物分组及模型建立 小鼠适应性喂养1周后,随机分为正常组(n=6)和处理组(n=9)。处理组小鼠以AA Ⅰ 20 mg/kg剂量连续腹腔注射,1次/d,连续5 d,正常组小鼠注射相同容积的0.5%羧甲基纤维素钠混悬液。
1.4.2 药物配置 100 mg羧甲基纤维素钠溶解于20 mL双蒸水中配置成0.5%的混悬液。40 mg AAⅠ加入20 mL 0.5%羧甲基纤维素钠混悬液中制备成2 mg/mL贮存液,超声震荡至完全溶解,4 ℃保存备用。
1.4.3 样本采集 小鼠以3%戊巴比妥钠麻醉、固定,打开腹腔、下腔静脉取血,用于测定血清ALT、AST。肝右叶切割0.5 cm×0.5 cm×0.3 cm大小固定于4%甲醛固定液中,用于HE染色;另取100 mg肝组织存于Trizol中用于提取RNA。
1.4.4 指标测定 按试剂盒说明书测定血清中ALT、AST水平。
1.4.5 肝组织HE染色 肝组织经4%中性甲醛缓冲液固定,自动脱水机脱水,石蜡包埋,4 μm切片,苏木精-伊红染色(HE染色),光学显微镜(Olympus 1×70,Japan)观察并拍照。
1.4.6 肝组织转录组测序 提取肝组织总RNA,采用Agilent 2100 Bioanalyzer (Agilent Technologies, Santa Clara)进行质量检测;Qubit 2.0 RNA检测试剂盒测定RNA浓度,包括mRNA分离/片段化、双链DNA合成、末端修复、末端dA-Tailing、桥头连接、连接产物纯化和片段大小分选及文库扩增等;利用Qubit 2.0 DNA检测试剂盒精确定量回收的DNA,按1∶1比例定量混合,使用IIIumina HiSeq X Ten 测序仪进行测序,产生150 bp的双端数据。建库测序由上海欧易生物医学科技有限公司完成。
1.4.7 基因质量控制 使用Trimmomatic (Version 0.36)软件进行质控并去除接头,在此基础上过滤掉低质量碱基以及N碱基,最终得到高质量的cleanreads。利用hisat2 (Version 2.2.1.0)软件将Clean Reads与小鼠参考基因组(从NCBI中下载参考基因组,基因组版本为GRCm38.p6)进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。各样本的有效数据量分布在 5.99~6.83 G,Q30 碱基分布在 93.97%~95.01%,平均GC含量为47.90 %。通过将reads比对到参考基因组上,得到各个样本的基因组比对情况,比对率为92.6%~98.23%。
1.4.8 差异表达基因筛选 导出各样本测序结果,通过R语言软件的“Affy”“limma”包对数据分析差异表达基因,将筛选条件设为P.Value<0.05、adj.P.Value<0.05、logFC>2,获取上调和下调的差异基因。Pheatmap包绘制热图和火山图。
1.4.9 差异表达基因的GO和KEGG富集分析 得到差异表达基因后,采用R语言的“clusterProfiler”“org.Mm.eg.db”“enrichplot”“colorspace”“stringi”“ggplot2”包对差异表达基因进行GO和KEGG富集分析。设置筛选条件为P.Value Cutoff <0.05和Q.Value Cutoff<0.05,并计算生物学过程(biological process, BP)、分子功能(molecular function, MF)、细胞组分(cellular component, CC)功能上的基因富集数,最后将排名前20的GO生物过程和KEGG通路,绘制成气泡图。
1.4.10 差异表达基因的qRT-PCR验证 基于转录组差异基因结果,选择变化最显著基因进行qRT-PCR验证。使用NCBI在线引物设计软件Primer-Blast设计引物,由上海生工生物工程有限公司合成(基因名称、引物序列见表1)。Trizol提取肝组织总RNA,采用试剂盒进行逆转录,按照SYBR Premix Ex Taq Ⅱ荧光染料法实时定量试剂盒说明进行cDNA扩增,每个样品重复3次。以β-actin为内参,采用2-△△CT法进行分析定量。

表1 基因引物序列
1.5 伦理学审查 所有操作均由上海南方模式生物科技股份有限公司实验动物管理和使用委员会(IACUC)审批通过,批号:IACUC号2018-0026。
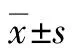
2 结果
2.1 小鼠体质量变化 正常组小鼠体质量逐渐增加,AAⅠ染毒过程中,处理组小鼠体质量逐步下降,造模至第4天,体质量下降明显(图1)。

图1 两组小鼠体质量变化
2.2 小鼠肝功能以及肝组织学的比较 与正常组相比,处理组小鼠血清ALT、AST水平分别升高7倍和4倍(表2),差异均有统计学意义(P值均<0.01)。HE染色可见,正常组肝组织小叶结构完整,肝细胞排列整齐、无坏死;处理组肝小叶结构紊乱、肝细胞胞浆疏松、小叶内可见点状坏死(图2)。表明20 mg/kg AA Ⅰ 给药5 d可造成明显肝损伤。

表2 两组小鼠血清ALT、AST水平的比较

图2 正常组与处理组小鼠肝组织切片(HE染色,×100)
2.3 差异表达基因的筛选结果 通过R语言中的Affy包去除原始数据中系统误差,得到标准化的基因表达数据。通过R语言中的Limma包对肝损伤组织和正常组织标准化之后的数据进行差异表达分析,最终1352个基因达到筛选标准(P<0.05且|logFC|>2),其中有703个上调基因,649个下调基因。利用R语言中的pheatmap包绘制差异显著的前20个上调基因和前20下调基因的热图,直观的显示出差异表达基因(附录1)。
热图(附录1a)显示出多个基因在两组中的表达水平。与正常组相比,处理组主要有以下基因发生差异性表达:Srd5a1、Lipc、Aqp8、Hba-a1、Slco1a1、Pklr、keg1、Nudt7等。其中,下调基因最明显前6位分别为Srd5a1、Lipc、Aqp8、Hba-a1、Slco1a1、Pklr。火山图(附录1b)用于展示基因表达差异的分布,其中横轴为FC的对数,越偏离中心FC越大;纵轴为差异显著性P值的负对数,值越大表明差异越显著。
2.4 差异表达基因的GO功能富集分析 为进一步了解差异表达基因的功能,陈述其在分子水平上的作用,针对差异表达基因进行GO注释(附录2)。Gene Ratio表明差异基因中与该Term相关的基因数与差异基因总数的比值,圆圈大小代表基因的多少,qvalue为对P值进行统计学检验的q值,qvalue值越小说明富集程度越明显。结果表明,小分子分解代谢(small moleculle catabolic process)、中性粒细胞参与的免疫应答(neutrophil activation involved inimmune respond)、分泌颗粒细胞质囊泡腔(secretory granule lumen)、细胞质囊泡腔(cytoplasmic vesicle lumen)、细胞外结构组织(extracellular structure organization)、细胞外基质组织(extracellular matrix organization)等相关的GO分类呈显著富集。
2.5 差异表达基因的KEGG富集分析 对正常组和处理组变化最明显的40个差异基因进行KEGG富集分析(附录3),其中富集因子(enrichment Score, ES)代表基因的富集程度,X轴为富集分数,气泡越大的条目包含的差异蛋白编码基因数目越多,气泡颜色由紫-蓝-绿-黄-红变化,其富集P值越小,显著程度越大。
结果表明,化学致癌(Chemical carcinogenesis)、视黄醇代谢(Retinol metabolism)、花生四烯酸代谢(Arachidonic acid metabolism)、类固醇激素合成(Steroid hormone biosynthesis)、癌症中的转录失调(Transcriptional misregulation in cancers)、蛋白质消化和吸收(Protein digestion and absorption)、炎症介质对TRP通道的调节(Inflammatory mediator regulation of TRP channels)、药物代谢(Drug metabolism)、补体和凝血级联(Complement and coagulation cascades)、谷胱甘肽代谢(Glutathione metabolism)、PPAR信号通路(PPAR signaling pathway)等在KEGG通路中显著富集。
2.6 差异表达基因的qRT-PCR验证 在表达的差异基因中挑选5个差异基因,以β-actin为内参,采用qRT-PCR验证RNA-seq的可靠性(图3)。结果发现,与正常组相比,处理组Srd5a1、Lipc、Aqp8、Hba-a1、Slco1a1、Pklr 6个基因表达水平显著减少(P值均<0.05)。
3 讨论
自从20世纪90年代确认AA具有肾毒性以来[8],已有部分药材被禁用;但由于部分含AA药物的不可替代性,仍然应用于临床。研究证实AA可导致肿瘤的发生。AA和马兜铃药材已被世界卫生组织国际癌症研究机构、美国食品药品监督管理局等列为Ⅰ类致癌物[9-10]。近年来关于AA与肝癌的研究[11]屡见不鲜,然而,AA的肾脏毒性已被学界广泛认可,但是AA引起的肝损伤,尤其是AA能诱发肝癌的说法有着很大的争议,其具体机制还需进一步探讨。
AAⅠ灌胃5 d,小鼠血清ALT、AST分别升高7倍和4倍,且肝组织病理结果显示肝小叶结构紊乱、肝细胞胞浆疏松、小叶内可见点状坏死,这提示AAⅠ可引起小鼠急性肝损伤。进一步提取肝组织RNA进行高通量转录组测序,发现正常组与处理组的差异基因数目为1352个;其中,表达上调的基因有703个,下调的基因有649个。差异基因中下调最明显前6位分别为Srd5a1、Lipc、Aqp8、Hba-a1、Slco1a1、Pklr。再采用qRT-PCR检测,与正常组相比,处理组Srd5a1、Lipc、Aqp8、Hba-a1、Slco1a1、Pklr的基因表达均明显降低,与转录组测序结果一致。
Srd5a(5-α-Reductase)是类固醇5α-还原酶,能将睾酮还原为双氢睾酮,从而调节激素水平和肿瘤的发生与发展。SRD5A具有3种亚型分别为Srd5a1、Srd5a2和Srd5a3[12]。Srd5a1广泛分布于人体,如皮肤、肝脏、肾脏、免疫组织和神经组织等,它与多种系统疾病有关。Srd5a1的异常会造成局部或全身雄激素水平紊乱。近年来有研究报道,Srd5a1在前列腺癌[12]、乳腺癌[13]、非小细胞肺癌[14]和肝癌[15]中均表达升高。肝脂肪酶(LIPC,又称HL),由肝实质细胞合成,可以水解脂蛋白中的甘油三酯和磷脂,从而促进它们的清除和代谢[16]。LIPC基因位于15号染色体长臂 (15q21),全长35 kb, 由9个外显子和8个内含子构成, 编码由449个氨基酸组成的蛋白质[17]。LIPC的多态性及基因突变可导致血脂异常。Homanics等[18]发现,小鼠的LIPC缺乏会产生轻度血脂异常,包括总胆固醇、磷脂和高密度脂蛋白胆固醇的增加。水通道蛋白-8(AQP8)是哺乳动物水通道蛋白家族的成员之一,能促进水和某些小溶质在生物膜上的运动[19],其在消化系统中广泛表达,包括小肠、结肠、胰腺和肝脏等[20]。AQP8在肝细胞中具有广泛的生理功能,其表达缺乏易引起肝功能紊乱。Jablonski等[21]研究证实肝细胞癌的发生与AQP8表达降低和质膜水渗透性降低有关。Slco1a1,又名OATP1,是属于溶质载体超家族(solute carrier, SLC)的一种跨膜蛋白[22],OATP1的表达在肝炎、肝硬化中表达下调[23-24]。PKLR是丙酮酸激酶(pyruvate kinase, PK)的基因编码。PK是催化糖酵解的关键酶,用于催化磷酸烯醇式丙酮酸生成丙酮酸,同时使ADP磷酸化而生成ATP[23]。PK有4种亚型。其中的PKM2已经被证实在肝癌细胞中显著增加,在糖酵解的调控中起关键作用[25]。有研究[26-27]报道,PKLR主要通过增加内源性抗氧化剂谷胱甘肽来促进肿瘤核心的细胞存活,负调节PKM2的糖酵解活性,并介导结肠癌在肝脏定植。上述基因在AAⅠ引起的急性肝损伤中鲜有报道。
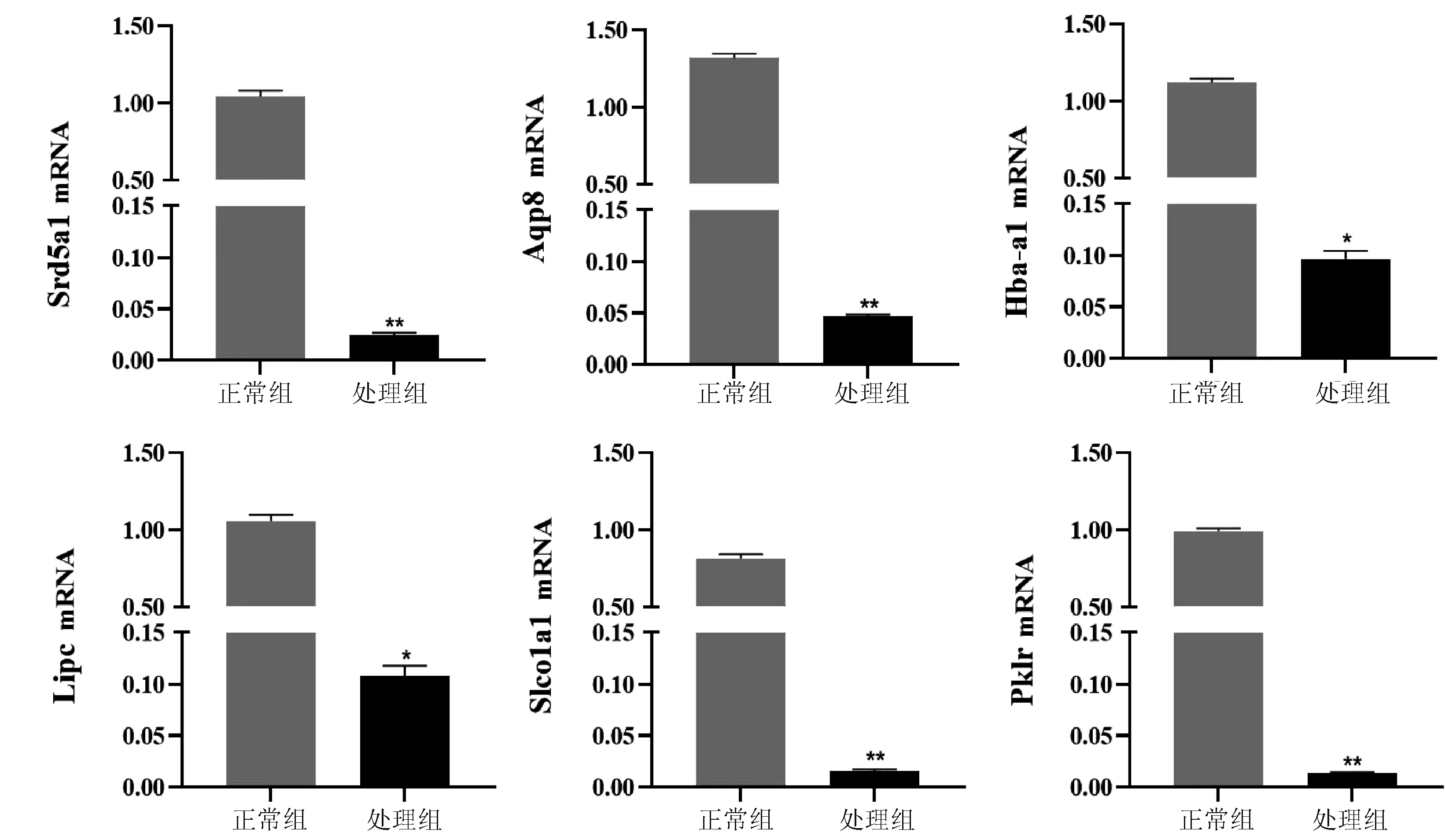
注:与正常组比较,*P<0.05,**P<0.01。图3 正常组与处理组差异表达基因qRT-PCR分析
差异基因中,上调最为明显的为LCN2、MT1和MT2。LCN2是一个25 kDa的小分子、分泌性蛋白[28]。在LPS和ConA诱导的肝损伤模型中明显升高[29]。在胆管炎症或肝脏炎症时,血液和肝脏中LCN2水平明显升高[30],同时也与肝衰竭和全身炎症反应相关,是慢加急性肝衰竭及预后的生物标志物[31]。MT1及MT2是金属硫蛋白(MTs)的亚型,在细胞、组织均有表达,以肝、肾最为丰富[32]。研究[33]报道MT对急性化学性肝损伤有一定的保护作用。在由镉、四氯化碳或对乙酰氨基酚引起的急性肝毒性中,可通过清除氧自由基对肝脏起到保护作用。
本研究通过高通量测序技术,从基因转录水平初步揭示了AAⅠ致急性肝毒性机制。并采用qPCR验证了下调最明显的6个基因,提示转录组学的可靠性。本研究中转录组学揭示的AAⅠ肝毒性的基因及相关信号通路有待进一步深入研究。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:朱哿瑞负责资料分析,撰写论文;王静、黄恺、彭渊负责修改论文;刘成海指导课题设计、修改论文;陶艳艳负责拟定课题设计和写作思路,指导撰写文章并最后定稿。

附录1~3见二维码
