抗结核药物导致肝损伤的临床特征及危险因素分析
2021-11-04黄德良叶晓光
黄德良, 戴 炜, 陈 军, 叶晓光
1 广州医科大学附属第二医院 感染科, 广州 510000; 2 国家传染病临床研究中心,南方科技大学第二附属医院(深圳市第三人民医院)肝病医学中心 肝病四科, 广东 深圳 518100
结核病是影响全球健康的重大传染病之一。据世界卫生组织[1]报告,2019年全球结核病例约为1000万,中国占8.4%,居30个高负担国家第三位,新发和复发病例728 265例 。除了结核病本身的危害外,抗结核药物治疗带来的副作用也严重影响患者健康,甚至危害生命,其中以抗结核药物引起药物性肝损伤最为常见[2]。药物性肝损伤在服用利福平、异烟肼、吡嗪酰胺、丙硫异烟肼等药物治疗的人群中较为常见,多种抗结核药物联合治疗其发生风险更高[2-6]。部分患者仅表现为肝功能一过性异常,而少数患者可能出现严重肝损伤,如肝衰竭等,甚至死亡[7]。据此,本文对抗结核治疗期间采用标准抗结核方案治疗发生肝损伤的患者进行临床特征分析,同时对肝损伤严重程度进行风险因素评估,为临床诊疗提供参考。
1 资料与方法
1.1 研究对象 纳入 2017年1月—2018年12月在深圳市第三人民医院确诊为抗结核药物导致肝损伤的住院患者。所有患者通过影像学和/或结核细菌学检查诊断为结核病,并按6个月标准疗程方案(2HRZE/4HR),以四联抗结核药物启动抗结核治疗。患者发生肝损伤后,根据相关指南进行调整或暂停使用抗结核药物治疗。排除标准:诊断为结核病但未使用抗结核药物;原发性肝癌;妊娠或哺乳期妇女;诊断为酒精性肝病、自身免疫性肝病、遗传代谢性肝病;巨细胞病毒、EB病毒感染,合并甲、丙、丁、戊型肝炎病毒感染。
1.2 相关诊断标准 慢性HBV感染: HBsAg阳性或乙型肝炎病史>6个月。药物性肝损伤诊断标准:符合以下任一条件:(1)ALT≥5倍正常值上限(ULN),(2)ALT≥3×ULN且TBil>2×ULN,(3)ALP≥2×ULN;且因果关系分析评估(RUCAM评分系统)得分>3分者。肝功能指标异常:未达到药物性肝损伤但有肝功能实验室检测指标异常者。肝衰竭:TBil>5×ULN, PTA≤40%或INR≥1.5。
1.3 资料收集 收集全部患者的人口学、临床症状、肝功能、肾功能、INR、治疗方案、转归等临床资料。
1.4 伦理学审查 本研究经深圳市第三人民医院伦理委员会批准,科研伦理申报号:2020-0195。
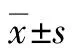
2 结果
2.1 一般资料 共纳入129例患者,其中肝功能指标异常组51例(39.53%),药物性肝损伤组78例(60.47%),发生肝衰竭13例 (10.08%)。两组患者性别、年龄差异均无统计学意义(P值均>0.05)。合并慢性HBV感染组内,HBeAg阳性患者占比在肝功能异常组和药物性肝损伤组间差异无统计学意义(P>0.05),在肝衰竭和无肝衰竭患者间差异有统计学意义(70% vs 25%,χ2=5.106,P=0.024)。
所有研究对象首次发生肝损伤时的主要临床症状为纳差(15.5%)、乏力(12.4%)、皮肤巩膜黄染(4.65%)、恶心(7.75%)、呕吐(1.55%)、发热(1.55%),16.3%的患者为无症状肝损伤。药物性肝损伤患者出现纳差、乏力、尿黄、皮肤黄染等症状较为明显。所有患者中,8周内发现肝损伤104例(80.6%),12周内发现肝损伤115例(89.1%)。药物性肝损伤组首次发现肝损伤中位时间比肝功能指标异常组迟(30 d vs 12 d,P<0.001)(表1),肝衰竭者首次发现肝损伤中位时间比无肝衰竭者迟(90 d vs 19.5 d,Z=-4.267,P<0.001)。
2.2 实验室指标情况 与肝功能指标异常组相比,药物性肝损伤首次发现肝损伤时、发现肝损伤停用抗结核药物时、肝功能指标异常高峰时的INR、ALT、AST、TBil、DBil、ALP、GGT指标明显异常,差异均有统计学意义(P值均<0.05)。而首次发现肝损伤时、发现肝损伤停用抗结核药物时、肝功能指标异常高峰值时的Alb水平差异无统计学意义(P值均>0.05)(表2)。

表1 患者基本特征
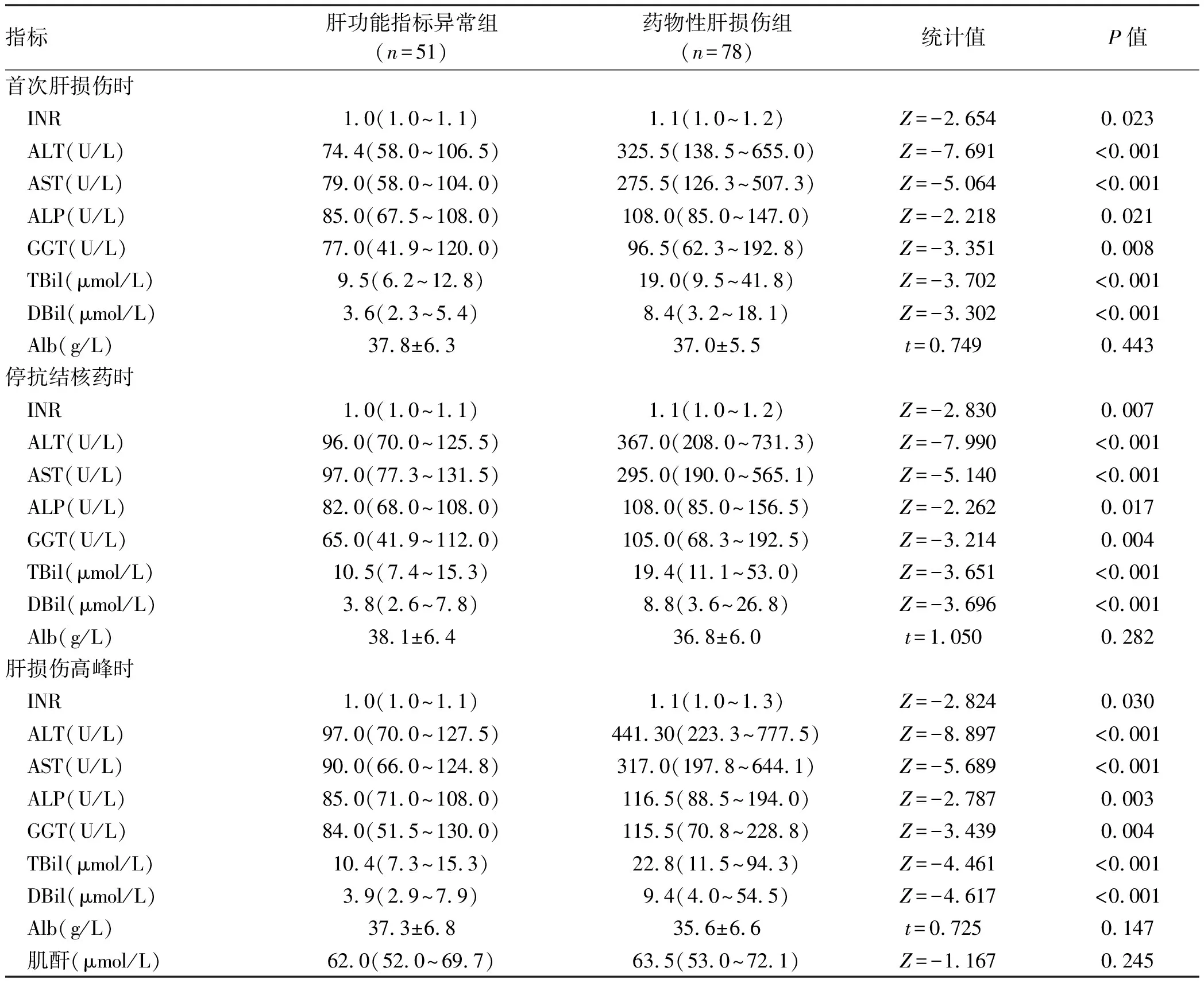
表2 肝损伤程度分组实验室检查结果比较
2.3 并发症情况 所有患者中,合并腹水13例、肝性脑病6例、自发性腹膜炎5例。无消化道出血并发症发生。合并慢性HBV感染者仅3例在抗结核治疗前启动抗病毒治疗,15例为发生药物性肝损伤后启动抗病毒治疗,均采用一线药物恩替卡韦或替诺福韦抗病毒治疗。10例接受人工肝血浆置换治疗,8例为合并慢性HBV感染者。药物性肝损伤组8例发生死亡, 2例因呼吸衰竭死亡,6例因肝衰竭死亡,其中4例为合并HBV感染者。合并慢性HBV感染组内治疗及与预后资料见表3。
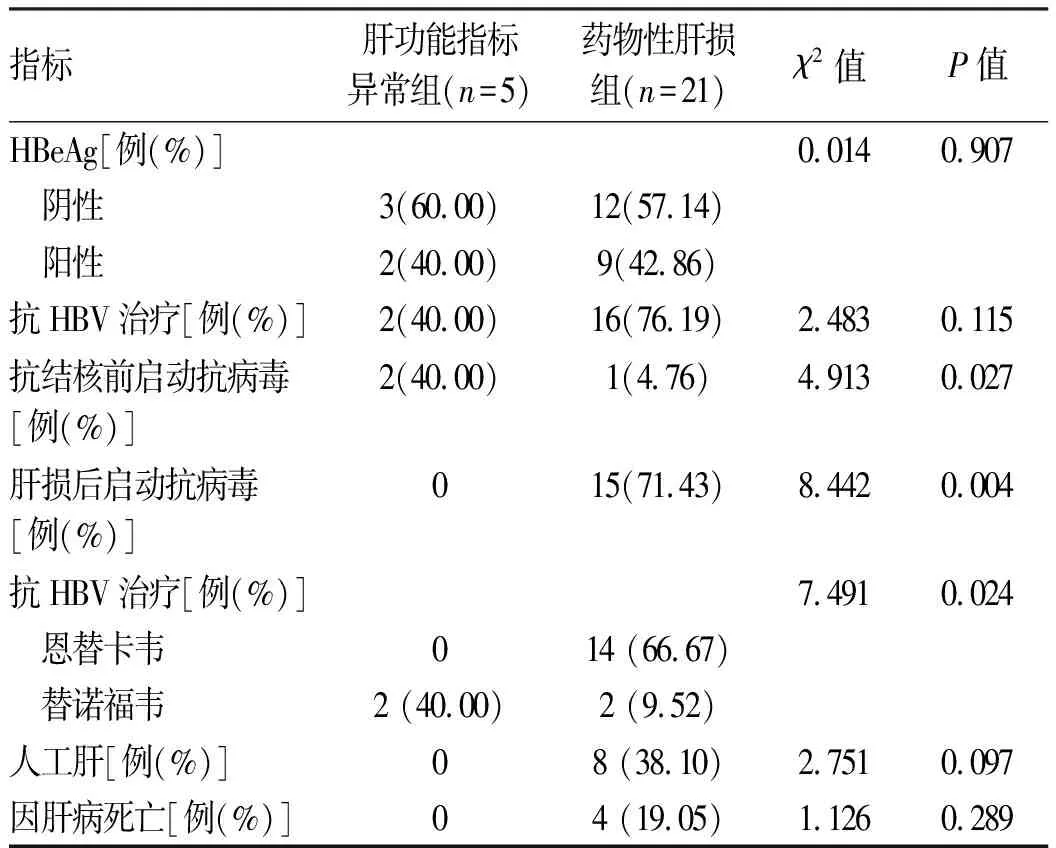
表3 合并慢性HBV感染者治疗及预后
2.4 药物性肝损伤、肝衰竭危险因素logistic回归分析
药物性肝损伤单因素分析显示:合并HBV感染、首次肝损伤时间>8周、无症状肝损伤是发生药物性肝损伤的危险因素(P值均<0.05)。多因素logistic回归分析显示首次肝损伤时间>8周、无症状肝损伤是发生药物性肝损伤的独立危险因素(P值均<0.05)。抗结核药物性肝衰竭单因素和多因素logistic回归分析结果一致,合并慢性HBV感染、首次肝损伤时间>8周是发生肝衰竭的风险因素,而Alb≥35 g/L则为保护因素(P值均<0.05)(表4)。
3 讨论
本研究发现结核病患者服用抗结核药物发生肝损伤者,严重型肝损伤发生率高,所有肝损伤患者中60.47%发生药物性肝损伤,10.08%发生肝衰竭。据数据[8-10]分析,我国结核病患者使用抗结核药物导致药物性肝损伤发生率为9.5%~10.6%,其中重度肝损伤发生率约为35.4%。由于当前国内外不同共识或指南对抗结核药物性肝损伤诊断标准不统一[3,11-13],造成不同研究相关发病率也有所不同。鉴于部分发生轻度肝功能指标异常者在停用或者调整相关抗结核药物后,肝功能指标可恢复至正常,为减少不必要的停药,我国2017年药物性肝损伤诊断指南[12]和国际严重不良反应协会2011年标准[13]进一步严格定义了药物性肝损伤诊断标准。2019年全球结核病数据[1]显示,全球44%结核病集中在东南亚,其中中国占8.4%,名列前三,仅在印度(26%)、印度尼西亚(8.5%)之后,是结核高负担国家之一。我国潜伏性结核感染人群基数大,活动性结核感染者数量多。活动性结核的治疗和预防性治疗的人群均需抗结核治疗,而抗结核治疗时间长、需多种药物联合、药物剂量大,治疗过程中会发生各种不良反应,抗结核药物导致肝损伤则是最常见不良反应之一[14]。目前随着我国结核筛查力度加大,需要抗结核治疗人群增加,意味着发生药物性肝损伤的人群也会随之增加,这对患者身体健康及国家都造成一定负担[15],早期发现,及早诊疗,可减少药物性肝损伤、肝衰竭等严重肝损伤的发生。
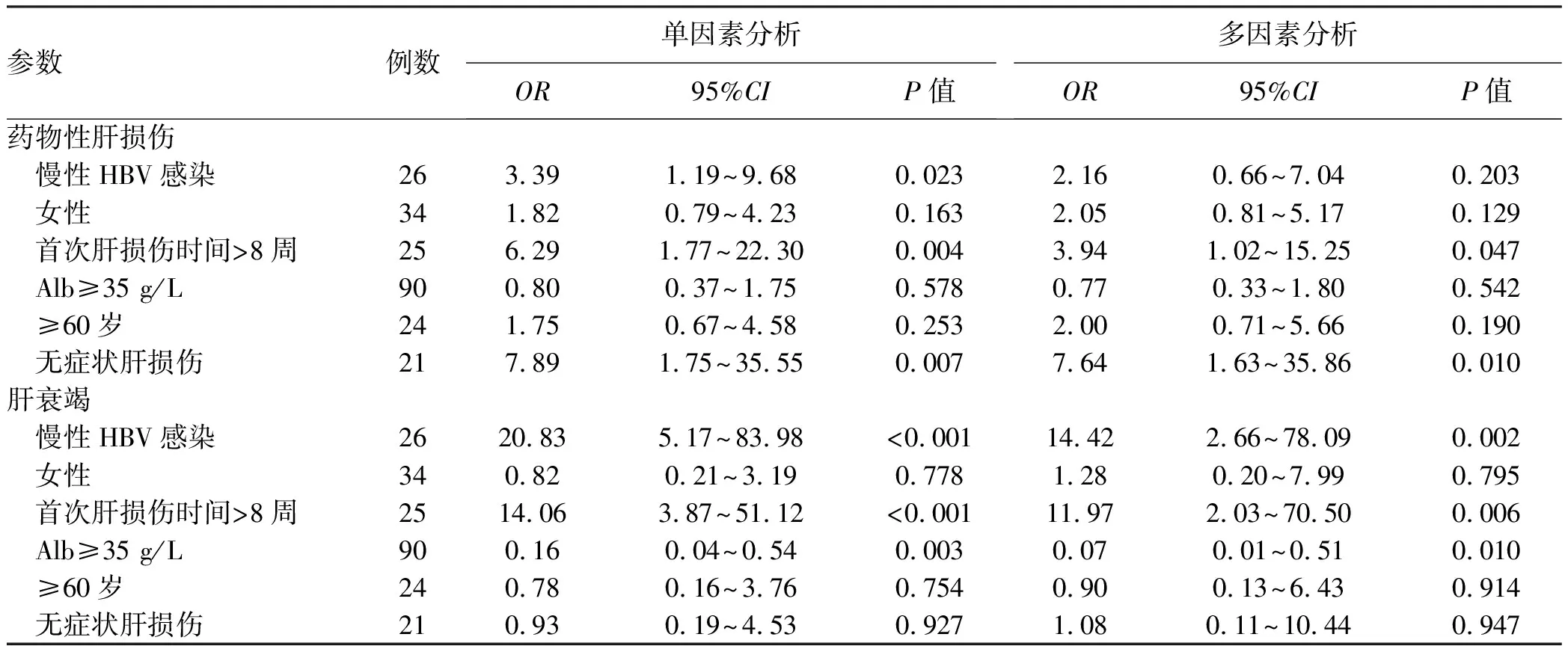
表4 药物性肝损伤、肝衰竭风险因素分析
抗结核药物导致肝损伤的相关危险因素越来越受到临床的关注,既往研究[3]提示老年患者、女性、合并基础肝病、营养不良、等位基因携带者等因素可能为抗结核药物性肝损伤的风险因素。本研究进行不同严重程度肝损伤多因素logistic回归分析发现,首次肝损伤时间>8周、无症状肝损伤是发生药物性肝损伤的独立风险因素,合并慢性HBV感染、首次肝损伤时间>8周是发生肝衰竭的独立风险因素,而Alb≥35 g/L是发生肝衰竭的保护因素。既往研究表明60岁以上、女性[16]患者发生抗结核药物性肝损伤风险大。但本研究经单因素及多因素风险分析未得到相关结果,和部分研究[12-13,15-18]结果一致,考虑和研究人群、地理位置有关。
本研究发现合并慢性HBV感染发生抗结核药物性肝损伤的风险是无慢性HBV感染者的2.16倍,发生肝衰竭风险是无慢性HBV感染结核患者的14.42倍。既往研究提示合并慢性肝病基础可能是抗结核药物性肝损伤的高危因素之一。而个别研究认为HBV感染可能不是增加药物性肝损伤的独立危险风险[17-19],合并HCV感染及同时合并HBV+HCV感染才是肝损伤发生风险因素[18]。但最近研究[20-22]揭示合并HBV感染的结核病患者的抗结核药物性肝损伤发生率较无合并HBV感染者高。Wang等[21]进行的一项荟萃分析,纳入15项研究,结果提示合并HBV感染者的药物性肝损伤发生率比单纯结核病者高(17.62% vs 11.31%),合并HBV感染者发生药物性肝损伤风险为无HBV感染者的2.18倍;Zheng等[23]进行一项荟萃分析,纳入16项研究,共3960例患者,发现合并HBV感染者发生药物性肝损伤的危险性是无HBV感染者的2.66倍, HBeAg阳性者发生药物性肝损伤的风险为3.42倍, HBeAg阴性者发生药物性肝损伤风险为2.30倍。同样在一项严格定义药物性肝损伤标准(ALT>5×ULN)和四种一线抗结核药物联合治疗的前瞻性、病例对照研究[21]中发现,合并HBV感染者发生药物性肝损伤风险明显升高(OR=3.41,95%CI:1.77~6.59)。接受标准联合抗结核药物治疗人群,HBV感染是增加药物性肝损伤发生的风险因素。Zhu等[24]的研究发现合并HBV感染者接受抗结核治疗出现轻到中度肝损伤(3×ULN
本研究结果显示首次肝损伤时间>8周者发生药物性肝损伤、肝衰竭的风险分别是≤8周者的3.94倍 (P<0.05)、11.97倍 (P<0.01)。既往研究[26-29]表明绝大部分患者肝损伤时间主要发生在8周左右,其中新加坡[28]、中国台湾[29]研究提示在8周内发生肝损伤分别占80%、60%。本研究结果同既往研究一致。Lee等[30]的一项研究,纳入1031例抗结核药物治疗患者,108例发生药物性肝损伤,25.9%在7 d内发生,67.6%在30 d内发作,>7 d组肝损伤程度较≤7 d组严重,肝功能恢复需要的时间长,但差异均无统计学意义(P值均>0.05)。患者发生肝损伤基本在8周内,考虑同标准抗结核方案(2HRZE/4HR)治疗的前8周主要为多种抗结核药物联合、含有明显肝毒性的吡嗪酰胺有关。8周后出现肝损伤者程度较为严重,主要和患者不规律随访未在肝损伤早期或者病情轻时发现肝损伤有关,继续服用抗结核药物,肝损伤暴露时间长、药物累计剂量大,肝功能进一步恶化。另晚期肝损伤的发生和免疫作用也可能有关。
抗结核药物导致肝损伤临床症状不典型,部分症状同结核病本身症状重叠,如发热、乏力、纳差等,导致临床未能及早做出判断。部分患者发生肝损伤时无任何临床症状,仅在进行肝功能筛查时发现,而其中部分患者就诊时已经是严重肝损伤、甚至已发生肝衰竭。本研究发现近1/5患者发生肝损伤时无任何症状,进行多因素分析发现无症状肝损伤者发生药物性肝损伤风险是有症状肝损伤者的7.64倍(P<0.01)。Patterson等[31]进行的一项伦敦多中心研究,共纳入1247例患者,经肝功能筛查,103例发生药物性肝损伤,发现43例在2周内诊断为药物性肝损伤,危险因素分析发现早期肝功能筛查(2周内)可以预测并减低药物性肝损伤的发生。因此,无症状肝损伤者发生严重肝损伤风险高,可通过规范随访,早期筛查、发现和预测肝损伤发生,降低严重肝损伤的发生风险。
既往研究表明,营养不良、Alb低下也是药物性肝损伤的风险因素。本研究发现Alb≥35 g/L是肝衰竭发生的保护因素,肝衰竭发生风险降低93%(P<0.01)。由于结核患者消耗增加、营养摄入不足,部分患者存在营养不良、低蛋白血症,因而在患者抗结核治疗前后,进行营养状态及Alb评估,加强营养、纠正低蛋白血症有助于降低严重肝损伤的发生。
本研究发现抗结核药物导致肝损伤患者在发生肝衰竭后死亡率高,即使停抗结核药物、积极护肝、人工肝血浆置换治疗,也难于挽救生命。合并HBV感染者一旦出现药物性肝损伤、肝衰竭其死亡风险更尤为显著,在肝损伤后再启动抗病毒治疗,似乎未能明显降低死亡风险。本研究中在抗结核前启动并规范服用抗HBV治疗的2例患者仅发生肝功能异常后肝功能快速恢复,未发生死亡,这意味着预防性抗病毒治疗,可能有助减少严重肝损伤发生和降低死亡风险。本文为回顾性研究,未能获取到HBV DNA在肝损伤前后对比,有待前瞻性研究进一步完善。因为本研究HBV感染者的HBV DNA数据的缺乏,不能排除肝损伤加重、预后差与HBV感染激活相关,提示合并HBV感染抗结核治疗更需慎重,严密监测肝功能、HBV DNA同时,预防性抗HBV治疗可能降低肝损伤及肝衰竭的发生率。
综上,抗结核药物可导致药物性肝损伤、肝衰竭等严重肝损伤的发生,首次肝损伤时间>8周、无症状肝损伤者、合并慢性HBV感染是发生严重肝损伤的独立危险因素,Alb水平≥35 g/L可降低肝衰竭的发生风险。抗结核治疗患者需全程、动态、规律、密切检测肝功能,早期发现和预测可降低严重程度肝损伤的发生率,进而降低死亡风险。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:叶晓光、陈军对研究的思路、设计有关键贡献;黄德良、戴炜参与了研究数据的获取分析解释过程;陈军、叶晓光参与起草,修改文章关键内容。
