便携式电子支气管镜在灵长类动物模型疾病检查中的应用
2021-11-04韩建保宋天章刘丰亮李明华郑永唐
韩建保,宋天章,刘丰亮,杨 翔,刘 超,靳 林,李明华,郑永唐,*
(1. 中国科学院昆明动物研究所,国家昆明高等级生物安全灵长类动物实验中心,中国科学院生物安全大科学研究中心,云南 昆明 650107; 2. 中国科学院昆明动物研究所,中国科学院动物模型与人类疾病机理重点实验室,云南 昆明 650223; 3. 中国科学院昆明灵长类研究中心,云南 昆明 650107)
便携式电子支气管镜是1种用于临床检查的医疗设备,具有便携、操作简单、性价比高等特点,在临床上主要用于疾病特别是呼吸系统和消化系统疾病的诊断和治疗,技术成熟,规范明确,是高信息量的诊断、治疗及科研辅助工具,并发症发生率很低。主要经口或鼻置入检查对象下呼吸道,用于对气管、支气管、肺叶病变的观察,细胞和细菌学检查、活检采样等。该产品最早在19世纪60年代开始应用于临床,为硬支气管镜,直至20世纪70年代前后出现软支气管镜,随后被广泛应用于临床诊断及治疗[1]。支气管镜检查技术是1项非常成熟的临床检查技术,在人医临床上应用十分广泛;在非人灵长类动物模型构建和研究中同样可以发挥更大的作用,但实际应用案例还比较少,究其原因主要是受其操作技术的限制。为进一步推广支气管镜在非人灵长类动物模型构建中的应用,笔者结合应用的实际操作经验,对支气管镜的选型、操作、消毒等进行探讨总结。
1 便携式电子支气管镜的选型
支气管镜分为硬支气管镜和软支气管镜(纤维支气管镜和电子支气管镜),实际应用中首选便携式电子支气管镜,具有便于携带、消毒和分体的优点。主要技术指标应满足以下参数:软镜前端弯曲度上下≥90°;视野角度≥120°;成像系统与非光学元件可分体,分辨率>100万像素;具有活检和冲洗操作通道(外径<2 mm的无操作通道),且操作通道<1.2 mm;长度≥550 mm,管径≤4.5 mm。由于非人灵长类的气管直径为7~15 mm,其中猕猴气管直径9~15 mm(4~6岁的青春期猕猴气管直径7~9 mm),恒河猴的食管在起始位置有一段扁平管,横径8~10 mm,因此支气管镜插入软管的外径尺寸≤5.2 mm尤其关键[2]。此外,由于非人灵长类动物模型中常用的实验动物多为恒河猴、食蟹猴、平顶猴,其鼻腔内上鼻甲与硬腭之间的宽度约4 mm,下鼻甲与鼻中隔的宽度约3.5 mm,不建议使用>4.5 mm带活检通道的电子支气管镜(易对鼻道造成物理创伤)。建议直接选用外径≤3 mm的电子支气管镜,可以实现检查、拍照、摄像、吸引、细胞刷及活检等功能。操作以平直进入鼻腔后向下方和鼻中隔方向行镜,若顺着鼻腔方向易被上鼻甲阻挡[3]。
2 便携式电子支气管镜在呼吸系统中的应用操作
便携式电子支气管镜主要用于呼吸系统关键部位的检查、诊断、治疗、给药和接种等。通过将便携式电子支气管镜与电子胃镜的对比发现,电子支气管镜同样可以将以上应用扩展至上消化道系统,用于食管和胃。
2.1 气管插管先用“舒泰50”对实验动物进行麻醉,仰卧位固定于操作台上,枕部及肩胛部垫高5~10 cm,按照头、颈、胸一线的体位保定(见图1A)。取出并消毒喉镜(具有照明功能),助手向下保定实验动物面部,操作者左手持喉镜,插入实验动物口腔内,深度至暴露会厌软骨和气管口,使用喉镜前端合并会厌软骨和舌向下颌方向按压,充分暴露气管口。右手持便携式电子支气管镜前端,当动物呼气时两片甲状软骨会微微张开,这时将电子支气管镜软管插入气管内(见图1B)。然后边通过显示屏查看镜头位置边缓慢将便携式电子支气管镜软管插入至预定位置(见图1C、图1D)。插管注意事项:插管前必须先吸痰,保证口腔内无痰液和唾液;插管过程中至少需2~3名人员,任务必须明确,操作过程各司其职;插管和行管过程中保定人员必须时刻观察动物状态;软管进入气管后喉镜始终保持原有状态或使用软管保护器替代喉镜;吸痰器必须常备,如果口腔有痰液或唾液必须及时吸取;插管和行管过程中动物会有不适,严重的会咳嗽,这时必须保持冷静,切忌惊慌放开保定动物或外抽软管,易导致事故发生。操作过程中如有特殊气道,第1次插管失败后务必及时寻求帮助,或更换技术和经验更加丰富的人员进行操作,且同1只实验动物反复操作次数应不超过3次,必要时可暂缓,待方法确定后再行插管[4]。
2.2 肺部病变观察软管进入气管后应缓慢行管,观察气管壁病变、痰液、异物等,并进行拍照和录像操作。当软管前行至气管第1分叉时,左边为左肺的左主支气管(管径约11 mm),右边为右肺的右主支气管(仰卧位,管径约11 mm)。沿左主支气管继续前行,前方有3条支气管,从左下到右上分别为左肺下叶支气管(管径约7 mm)、左肺中叶支气管(管径约6 mm)、左肺上叶支气管(管径约6 mm),分别连通上、中、下3个肺叶。沿右主支气进入后,从左上至右下有4条支气管,分别为右肺上叶支气管(管径约6 mm)、右肺中叶支气管(管径约5.5 mm)、右肺下叶(管径约7 mm)、奇叶支气管(管径约5 mm)。在气管和主支气管一般不会有黏液出现,进入肺叶后支气管壁易出现黏液,行管过程中需谨慎,务必缓慢行进。
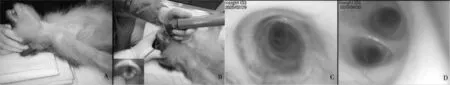
A:插管时的体位; B:暴露会厌软骨和气管入口; C:进入气管时的图像; D:左右支气管分叉图1 气管插管
2.3 细胞刷取样当软管进入气管达到既定位置后,固定软管,打开活检通道盖,将无菌一次性支气管镜细胞刷沿活检通道缓慢插入电子支气管镜软管内,通过显示屏观察镜头视野内是否出现细胞刷。当视野内出现细胞刷后,通过细胞刷控制手柄将细胞刷头从套管内推出,缓慢调整支气管镜软管头部使细胞刷贴近气管壁,反复刷取气管壁2~3次(动作要轻缓,避免对气管造成创伤),然后反方向调整支气管镜软管使细胞刷另一面接触气管壁,反复刷取气管壁2~3次,最后将细胞刷收入套管,缓慢从活检通道内抽出,在最后抽出时刻动作要轻缓,避免细胞刷头抽出瞬间震颤摆动。将细胞刷在1 mL细胞培养液中反复涮洗3~5次后剪断待用。由于非人灵长类动物的气管环后部有1个缺口,无软骨,只有1层膜性壁,因此在刷取气管时要避开气管下部,避免意外导致气管穿孔造成气胸。时刻关注动物麻醉状态,若有清醒迹象要及时补注麻醉剂。
2.4 活检取样支气管镜活检可以通过活检钳和吸引活检针进行。当支气管镜达到既定位置后,固定软管,打开活检通道盖,将无菌一次性活检钳(或吸引活检针)沿活检通道缓慢插入电子支气管镜软管内,通过显示屏观察镜头视野内是否出现活检钳(或吸引活检针)。当视野内出现活检钳(或吸引活检针)后,通过上下弯转软管头部,将活检钳(或吸引活检针)行进至指定位置钳取(或穿刺吸取)样本,缓慢沿活检通道抽出活检钳(或吸引活检针),松开活检钳将钳取的组织放入培养基(或-80 ℃保存)待用[5,6]。在进行肺部活检钳(或吸引活检针)操作时,需特别注意避免在肺中叶进行取材,操作不当易损伤胸膜导致气胸。时刻关注动物麻醉状态,有清醒迹象及时补注麻醉剂。在操作过程中动物发生异常动作应立即停止操作,待动物状态平息后再进行操作。取材结束后应密切关注实验动物状态,以便及时应对意外情况[7]。
2.5 肺泡灌洗肺泡灌洗术是在支气管镜辅助基础上开展的1项技术,是通过支气管镜的活检通道将37 ℃无菌生理盐水注入肺内通过负压吸引装置将其吸出,收集肺泡表面有效液体,检查灌洗液中的细胞成分、可溶性物质、细菌和病毒等的1种方法。具体操作:当支气管镜软管达到准备灌洗的肺叶位置,使用无菌注射器将37 ℃无菌生理盐水沿活检通道注入,通过显示屏观察液体缓慢注入既定肺叶,每次注入5 mL,间隔5 min,总量20~40 mL,负压吸引器保持0.03~0.06 MPa负压,回收率≥30%。回收结束以后,关闭负压吸引器,缓慢抽出支气管镜。注意事项:执行肺泡灌洗前,需明确肺泡灌洗应在支气管细胞刷或支气管活检之前进行,避免因为出血造成灌洗回收液被污染;整个灌洗操作过程支气管镜必须正确使用并保持合适位置,以防灌洗液溢出及被大气道分泌物污染;在灌洗过程中尽可能降低动物咳嗽反射,否则容易导致支气管壁黏膜损伤,造成灌洗液混血,同时影响回收量;灌洗的生理盐水需无菌并加温至37 ℃,过冷或过热会引起支气管痉挛和刺激性咳嗽;负压吸引应保持在0.03~0.06 MPa,负压过大易导致支气管陷闭、远端气道萎陷和损伤,并影响回收量。避免同时或连续左右肺灌洗,易导致呼吸窘迫甚至死亡,一侧肺灌洗后,另一侧肺灌洗的时间要视动物状态确定。注意:肺灌洗具有严重的副作用,灌洗过程中会严重影响肺内气体交换,造成气压伤、胸腔积液肺水肿、肺炎、支气管痉挛等[8]。
3 便携式电子支气管镜在上消化系统中的应用
食管口位于咽的下口,食管全长140~180 mm。电子支气管镜(外径≤4.5 mm)经口进入食管,在食管的起始位置有一段呈扁平管,长约50 mm,向下继续变圆,会看到1个向上凸起的闭合口,即为贲门口。贲门口有黏膜形成的放射状黏膜嵴和沟,穿过贲门口即进入胃。由于胃内非常空旷,进入后视野变黑,这时可以根据需要继续行镜,弯转软管头部观察胃内组织结构情况(见图2)。由于幽门口至贲门口的胃小弯直线距离有60~100 mm,幽门口至胃大弯远端的直线距离有130~150 mm,通过电子支气管镜在胃内寻找幽门口难度非常大,不建议操作。为保证检查时清楚地观察上消化道各组织部位的情况及完整的胃内结构,建议在上午进行上消化道各项操作,并且在前1天晚上20:00以后禁食禁饮,保证食管和胃内干净。支气管镜插入后尽量使实验动物头部保持侧位,避免因不适产生的唾液等进入气管引起咳嗽、窒息等事故。
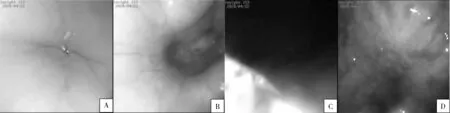
A:扁平管; B:贲门口; C:胃内; D:胃壁图2 食管插管
4 便携式电子支气管镜的消毒清洗
便携式电子支气管镜为分体结构,所有实验操作结束后关闭主机电源,拆分主机与软管,主机用75%酒精喷雾消毒,10 min后再行75%酒精擦拭消毒。软管部位按照《软式内镜清洗消毒技术规范》(WS 507—2016)执行清洗消毒[9],避免在使用过程中造成肺部感染,或在建模过程中造成交叉污染。注意事项:实验操作结束后使用75%酒精预消毒,然后使用纯净水冲洗管腔内及外壁;在做支气管镜密闭性检测时压力上限控制在0.07 MPa,避免损坏镜头和照明[10]。
5 小结与讨论
5.1随着近年来支气管镜在临床上的广泛应用,以及支气管镜技术的革新,管径越来越细,显示屏数字化,图像清晰度提高,锂电池应用,出现了性价比更高的便携式电子支气管镜,可操作性更强,应用范围更广[11]。在动物模型构建中的应用也逐渐普遍,可以用于实验动物呼吸系统及口腔、食管、胃的病变观察、活检样本采集、给药、治疗、感染等实验操作,同时可以针对每个肺叶靶向给药、取样、接种等操作。在便携式电子支气管镜的应用技术中,针对非人灵长类动物的肺部灌洗操作灌入量和回收量比例差异比较大,对于灌洗液内容物及灌洗区域缺少统一操作规范。在胃内操作如何穿过胃腔进入十二指肠进行检查取样还是1个技术瓶颈,有待于进一步研究突破。便携式电子支气管镜在实际操作前,必须不断反复多次进行模拟操作练习和实操练习,熟练掌握其核心检查程序以及注意事项,充分了解操作目的、禁忌和风险,方可保证使用效果和实验动物的安全[12]。鉴于便携式电子支气管镜插管技术要求比较高,建议有关机构能够组织此类技术培训,以促进该类技术的推广,更好地服务于实验动物科研事业[13,14]。
5.2便携式电子支气管镜在非人灵长类动物呼吸系统疾病感染建模和研究中可以发挥很大的作用,如流感模型、中东呼吸综合征模型、重症急性呼吸综合征模型、新型冠状病毒肺炎模型等,可以在感染接种时定位、定量、定时,在感染后采样中实现定时、定位、多次,实现在人类临床上无法实现的操作,更好地服务于科研,更好地研究疾病感染、发病机制、治疗等,更好地评价药物和疫苗的有效性、毒性、作用机理等。相信随着支气管镜的更新换代和操作技术的不断完善和推广,将来能够发挥更大的科研辅助价值。
