芬太尼透皮贴剂临床合理用药指南
2021-11-04湖北省抗癌协会癌症康复与姑息治疗专业委员会
湖北省抗癌协会癌症康复与姑息治疗专业委员会
芬太尼透皮贴剂1990年在美国上市,于1999年在我国批准上市,具有释药速率稳定,作用时间长达72 h,使用方便等特点,已成为目前临床应用最为广泛的癌症镇痛药物之一。2018年WHO成人和青少年癌痛的药物和放射治疗管理指南中提出芬太尼透皮贴剂是癌性疼痛常用的强阿片类镇痛药[1],并于2019年纳入WHO基本药物清单[2]。
伴随着癌症人群发病率的不断升高,癌痛治疗需求的增加,以及阿片类药物长期、大量的应用,芬太尼透皮贴剂的合理使用(适应证、正确使用、不良反应处理)问题日益突出。全球接受芬太尼治疗的患者中有50%处方适应证掌握不当,北美和欧洲部分国家甚至出现芬太尼滥用状况,而在我国却存在癌痛患者使用阿片类药物严重不足的现状。
目前,国内外临床诊疗指南、专家共识或指导原则多从疾病治疗角度阐述芬太尼透皮贴剂的应用,涉及芬太尼透皮贴剂的合理使用、药学监护与管理等内容较为缺乏。为此,指南制订工作组针对芬太尼透皮贴剂临床使用适应证、用药方案、给药途径、给药方式、给药频率和时间、特殊人群用药、药物相互作用、配制与保存及安全性等药学监护重点查阅大量权威文献,结合多专科医师、药师、护士和药物经济学家的经验,参考患者的意愿,为临床医师、药师和护士提供一个全面的芬太尼透皮贴剂临床合理应用建议,以期在临床工作中为促进临床合理用药,减轻患者精神和经济负担,保障医疗质量和提高医疗安全水平发挥积极作用。
1 中国临床肿瘤学会诊疗指南证据类别与推荐等级
本指南基于循证医学证据,根据中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)诊疗指南证据类别对证据质量和推荐等级进行分级。证据等级分为:1A,1B,2A,2B、3。推荐等级分为:Ⅰ级推荐、Ⅱ级推荐、Ⅲ级推荐。证据类别高、可及性好的方案,作为Ⅰ级推荐;证据类别较高、专家共识度稍低,或可及性较差的方案,作为Ⅱ级推荐; 临床实用,但证据类別不高的,作为Ⅲ级推荐。见表1、表2。本指南共识度是在指南定稿后,以专家投票形式进行统计分析得出。
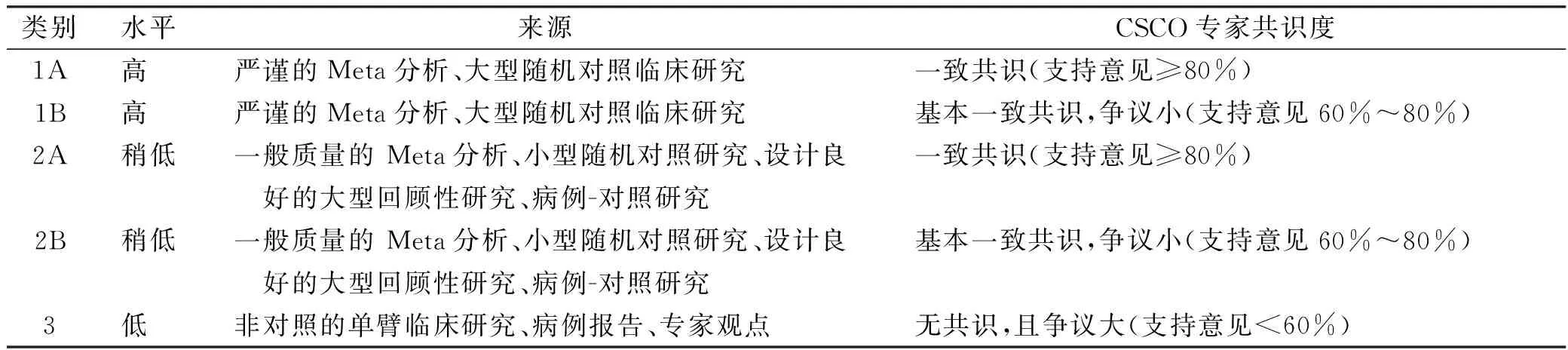
表1 CSCO诊疗指南证据类别
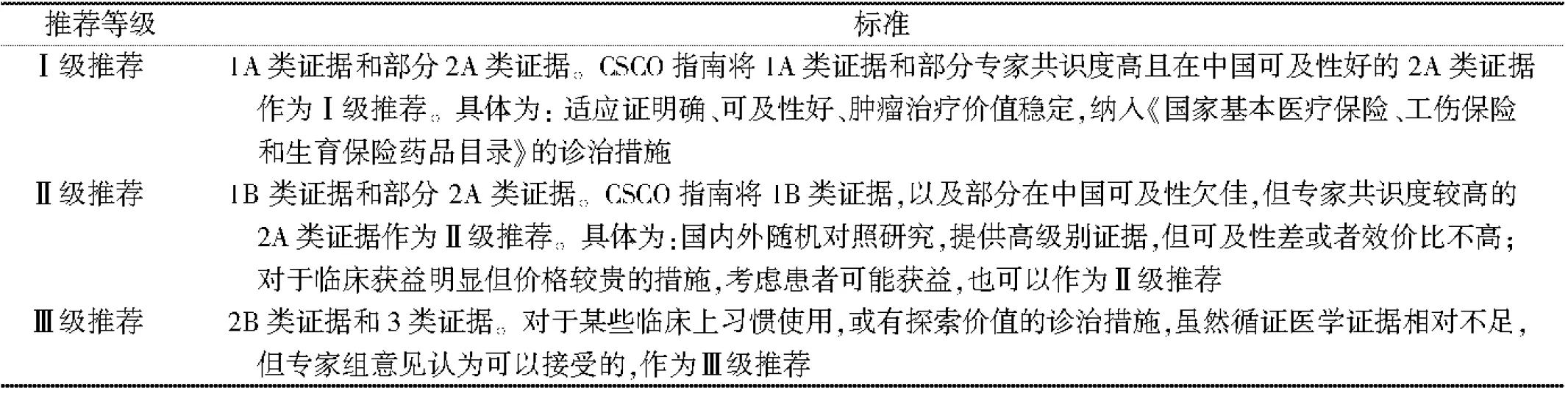
表2 CSCO 诊疗指南推荐等级
2 临床药理学
芬太尼,化学式为N-[1-(2-苯乙基)-4-哌啶基]-N-苯基-丙酰胺,分子量为336.46。由于其分子量小,脂溶性高,对皮肤的刺激性小等特点而被制成透皮给药制剂。“透皮传递”技术具有刺激性小、致敏性低、黏性好、柔软易剥离等特点,患者使用舒适度较高。同时,经皮给药途径消除了肝脏的首过效应,将大幅提高生物利用度。目前临床存在两种类型的芬太尼透皮贴剂:骨架型和储库型。储库型芬太尼透皮贴剂由四层结构组成:背衬膜、储药池、控释膜、胶黏层。2009年报道储库型芬太尼透皮贴剂存在内部药品渗漏到包装外的风险,被FDA及相关生产企业全部召回。此后储库型芬太尼透皮贴剂被改进为骨架型芬太尼透皮贴剂,其结构为背衬膜、含药骨架型胶黏层(见图1)。骨架型芬太尼透皮贴剂系采用现代压敏胶技术制备的含芬太尼透皮给药控释剂型,保证药物以恒定速率通过皮肤进入血液循环系统,发挥全身持久且稳定的镇痛作用。骨架型芬太尼透皮贴剂较储库型的面积减小1/2,且与皮肤的粘贴及伸曲度更好,对局部皮肤的刺激性更小,吸收起效更快,无药物突释风险,安全性更高[3]。
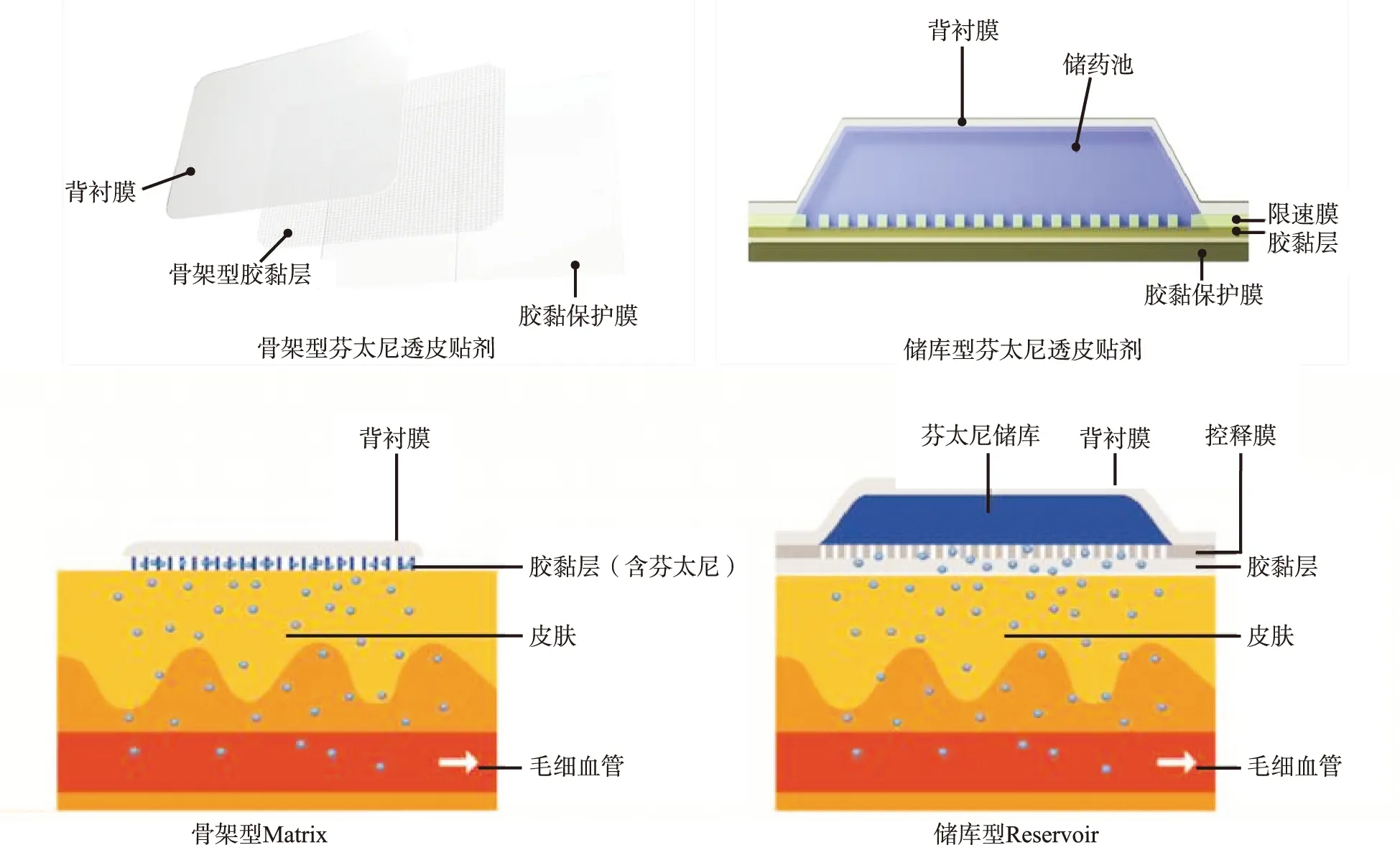
图1 芬太尼透皮贴两种剂型
2.1作用机制 芬太尼作为一种合成的纯阿片受体激动剂,其药理作用与吗啡等阿片类药物相似,主要作用于μ阿片受体,产生中枢性镇痛作用,较吗啡有更强的镇痛效力和更快的起效时间,其镇痛效力为吗啡的100倍。
2.2药代动力学 芬太尼透皮贴剂的释放速率保持相对恒定。首次使用贴剂,芬太尼的血清浓度逐渐增加,6~12 h达到起效浓度,12~24 h内达到稳态,并在此后保持相对稳定至72 h,达峰时间一般在首次使用后24~72 h。芬太尼的血清浓度与贴剂的尺寸(剂量)成正比,患者所能达到的稳态药物血清浓度取决于个体对芬太尼的皮肤渗透性和清除率。已有观察显示,血清芬太尼药物浓度的高低存在个体间差异,提高皮肤温度可使药物吸收增加。芬太尼不经皮肤代谢,主要经肝脏中细胞色素P450家族代谢酶(CYP3A4)快速和广泛地代谢,主要代谢产物是无活性的去甲芬太尼。在用药24 h后去除贴剂,血清芬太尼浓度逐渐下降,大约17 h(范围:13~22 h)后下降至约50%(停药后芬太尼继续从皮肤中释放入血,血清浓度的下降速度比静脉注射缓慢)。芬太尼经肝脏代谢失活,其生物半衰期为2~4 h。约75%的芬太尼主要以无活性代谢产物形式在24 h内经尿液排出,尿液中原型药物少于10%,另有约9%的芬太尼以代谢产物形式经粪便排出。
3 临床应用
3.1适应证 治疗中度到重度慢性疼痛以及那些只能依靠阿片样镇痛药治疗的难以消除的疼痛。
3.2优选人群 芬太尼透皮贴剂适用于中重度癌痛患者,具有无创给药、血药浓度平稳、长效镇痛72 h、吸收不受胃肠道状态的影响,代谢产物无活性等特点,适用芬太尼透皮贴剂的优选人群如下。
3.2.1阿片稳定需求的人群
[专家推荐]阿片稳定需求的患者推荐优选芬太尼透皮贴剂进行镇痛治疗。ESMO(2018年)癌痛指南建议阿片稳定需求的患者[4],芬太尼透皮贴剂和丁丙诺啡透皮贴剂是最佳的选择。NCCN(2021年)成人癌痛指南同样推荐24 h内阿片稳定需求的患者转换成芬太尼透皮贴剂或其他阿片缓释制剂[5](推荐等级Ⅰ级,证据等级2A级,共识度:96.15%)。
3.2.2不能或不愿经口服给药的人群[4,6-8]
(1)不能吞咽的患者:①合并食管瘘、气管瘘、喉返神经麻痹等。②肿瘤所致的吞咽困难:如口腔癌、鼻咽癌、喉癌、食管癌、甲状腺癌、纵隔转移癌等肿瘤可能伴有吞咽困难。③其他原因造成的吞咽困难:如脑卒中患者、禁食、恶病质、终末期患者、意识减退妨碍口服等。④放化疗、靶向治疗等引起的重度口腔黏膜炎患者。
(2)不愿口服给药的患者。
[专家推荐]
(1)不能口服的患者推荐芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级1A级,共识度:100.00%)。
(2)不愿经口服给药的患者推荐芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
3.2.3中、重度肝肾功能不全的人群[4,9-10]癌症及其并发症的进展,以及抗肿瘤治疗的影响,可能使癌症患者出现肝肾功能不全的情况。不同阿片类药物的代谢过程和代谢产物不尽相同,肝肾功能不全的患者应用阿片类药物,需密切注意患者的安全性,严格掌握禁忌证。芬太尼在肝脏代谢,代谢产物去甲芬太尼无生物活性。肝功能不全对芬太尼的药代动力学影响较小。中、重度肝功能不全患者使用芬太尼透皮贴剂相对安全,长期应用需密切监测不良反应。芬太尼经体内代谢后,10%以原形由尿液排泄。轻度肾功能不全者无需减量,中、重度肾功能不全者适当减量,长期应用需密切监测不良反应。肝肾功能不全患者阿片药物应用及剂量调整见表3,4。

表3 阿片类药物在肝功能不全中的剂量调整

表4 阿片类药物在肾功能不全中的剂量调整
[专家推荐]中、重度肝肾功能不全的患者推荐芬太尼透皮贴剂进行镇痛治疗,长期应用需密切监测不良反应(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
3.2.4恶性肠梗阻的人群[5,11-12]恶性肿瘤而引起的肠道梗阻在晚期消化道及盆腔肿瘤中较为常见,是肿瘤晚期并发症之一。常伴随腹痛、腹胀、纳差、睡眠障碍等症状。对于合并中、重度癌痛的恶性肠梗阻患者,芬太尼贴剂可以有效缓解疼痛。
[专家推荐]合并恶性肠梗阻的癌痛患者,推荐芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级1A级,共识度:94.23%)。
3.2.5口服阿片类药物出现不可耐受的严重恶心及呕吐的人群 YANG等[13]一项针对中国人群的系统评价Meta分析研究,收录了32个单独临床试验共 2651例。分析结果显示,芬太尼透皮贴剂与长效口服阿片药物具有相同的镇痛作用,但是便秘、恶心呕吐以及眩晕嗜睡等不良反应发生的概率明显减少。NCCN成人癌痛指南(2021)[5]指出“当恶心持续时间超过1周应考虑阿片更替”,同样 EAPC 阿片类药物治疗癌痛指南(2012)[14]也指出“当出现恶心呕吐时,建议转换阿片类药物,改变给药途径,如从口服给药改为透皮给药或胃肠外给药或减少药物剂量”。透皮给药应是恶心呕吐,尤其是长期恶心呕吐患者的一个理想的给药途径。呕吐分级:① 呕吐每天1~4次为Ⅰ级;②呕吐每天5~9次为Ⅱ级;③呕吐每天10次及以上为Ⅲ级。
[专家推荐](1)对于口服吗啡、羟考酮等阿片类药物出现严重恶心反应的患者,推荐更换芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级1A级,共识度:100.00%)。(2)对于口服吗啡、羟考酮等阿片类药物出现Ⅱ级以上呕吐反应的患者,推荐更换芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级1A级,共识度:98.08%)。
3.2.6顽固性便秘及慢性便秘的人群 由于芬太尼在中枢和胃肠道的药物分布比例为1:1.1,而吗啡等口服阿片药物为1:3.4,相比口服阿片类药物,芬太尼较少和胃肠道μ阿片受体结合,所以使用芬太尼透皮贴剂的便秘发生风险大幅降低[15-17]。NCCN成人癌痛指南(2021)[5]指出“当出现顽固性便秘时可考虑转换成芬太尼透皮贴剂进行镇痛治疗”。
[专家推荐]对于口服吗啡、羟考酮等阿片类药物发生Ⅲ级以上便秘或持续1周以上反应的患者,推荐更换芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅰ级,证据等级1A级,共识度:98.08%)。
3.2.7对口服药依从性差的人群[18]
[专家推荐]芬太尼透皮贴剂一次镇痛72 h,相较于口服吗啡患者的依从性更佳。针对不能够按时服药及对口服药依从性差的患者,推荐芬太尼透皮贴剂进行镇痛治疗(推荐等级Ⅱ级,证据等级2A级,共识度:98.08%)。
3.3选择时机
3.3.1一线用药 疼痛是人类的第五大生命体征,初诊癌症患者的疼痛发生率约25%,而晚期癌症患者的疼痛发生率可达60%~80%,其中1/3的患者为重度疼痛。临床研究显示,全国136家中心纳入4492例癌痛患者,使用芬太尼透皮贴后缓解癌痛的总体有效率可达到96.8%[19]。2018年WHO《成人和青少年癌痛的药物治疗和放射治疗管理指南》中提出芬太尼透皮贴剂、吗啡、羟考酮是癌性疼痛常用的强阿片类镇痛药[1]。
[专家推荐]推荐芬太尼透皮贴剂是中、重度癌痛患者治疗的一线用药之一(推荐等级Ⅰ级,证据等级2A级,共识度:88.46%)。
3.3.2阿片耐受患者 阿片耐受的定义[5]:阿片耐受是指无疾病进展前提下,患者应用阿片类药物的镇痛效果减低,需要持续增加剂量才可维持同等镇痛效果的现象。按照美国FDA标准,阿片耐受是指已经按时服用阿片类药物至少1周以上,包括接受25 μg·h-1芬太尼透皮贴剂,口服吗啡60 mg·d-1,羟考酮30 mg·d-1,氢吗啡酮8 mg·d-1,羟吗啡酮25 mg·d-1,或其他等效剂量阿片类药物的治疗;不满足上述持续止痛时间及剂量要求时定义为阿片未耐受仍达不到预期镇痛效果。
[专家推荐]根据过去24 h使用阿片类药物剂量总和进行等效剂量转换,具体剂量转换关系见表5。爆发痛的处理剂量:过去24 h使用阿片类药物剂量总和的10%~20%。每日短效阿片类药物解救用药次数≥3次时,应当考虑将前24 h用药总量转换成芬太尼透皮贴剂的总剂量,按时给药。72 h按时换贴,可根据使用时记录的时间进行更换,也可统一更换为新的贴剂(推荐等级Ⅰ级,证据等级2A级,共识度:98.08%)。

表5 剂量转换关系[9,20]
3.3.3不愿口服或不可口服的阿片未耐受患者 芬太尼透皮贴剂是否可以用于阿片未耐受患者,临床中存在一定的争议。对于初始镇痛治疗采用过可待因、曲马多等弱阿片类药物或者复方制剂的慢性中、重度癌痛患者,亦可采用芬太尼透皮贴剂治疗。多项研究表明,对未使用过强阿片类药物癌痛患者,初始镇痛治疗给予低剂量芬太尼透皮贴剂,同样安全和有效[21-22]。
[专家推荐]不愿口服或不可口服的阿片未耐受患者可选择芬太尼透皮贴剂进行镇痛治疗。起始给予低剂量的芬太尼透皮贴剂(12.5或25 μg·h-1)作为基础背景给药,每小时进行疼痛的评估并进行爆发痛的处理。短效阿片类药物解救用药次数≥3次·d-1时,考虑当前背景剂量不足,应加量(12.5或25 μg·h-1)。短效阿片类药物解救用药次数≤2次·d-1时,考虑维持当前剂量,按时给药。72 h 按时换贴,可根据使用时记录的时间进行更换,也可统一更换为新的贴剂(推荐等级Ⅱ级,证据等级2A级,共识度:94.23%)。
3.4特殊类型的癌痛
3.4.1神经病理性癌痛 神经病理性疼痛,亦为神经痛,是指由于外周或中枢神经系统的损伤、病变或功能紊乱所引起的疼痛,可分为外周性和中枢性神经病理性疼痛。神经病理性疼痛的发病机制比较复杂,多种机制均可引起。具体来说,外周机制包括细胞膜兴奋性增高、外周致敏,中枢机制包括细胞膜兴奋性增高、中枢致敏、去神经超敏现象等。外周机制中离子通道的变化对神经病理性疼痛的发生起着重要作用。外周神经损伤后,钙离子通道异常反复放电,导致钙离子大量内流,从而引起痛觉过敏和异常疼痛。癌性神经病理性疼痛常见病因可分为自身因素和肿瘤治疗因素。自身因素:骨转移、肿瘤压迫、神经浸润、肿瘤所致的周围环境改变(pH改变、细胞因子产生、肿瘤致痛剂和化学增活素释放)。肿瘤治疗因素:化疗相关疼痛(常见药物∶长春新碱,紫杉醇,顺铂,双肽硼酸)、放疗(损伤外周神经系统)、外科手术(肿瘤手术损伤神经)[23]。
[专家推荐](1)阿片类药物(如芬太尼透皮贴剂,吗啡等)可联合抗惊厥类药物(如普瑞巴林和加巴喷丁)用于神经损伤所致的撕裂痛、放电样疼痛及烧灼痛[23](推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。(2)阿片类药物(如芬太尼透皮贴剂,吗啡等)可联合三环类抗抑郁药(如阿米替林)用于中枢性或外周神经损伤所致的麻木样痛、灼痛[23](推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
3.4.2骨转移性癌痛 骨是恶性肿瘤晚期常见的转移部位,乳腺癌、前列腺癌、肺癌等出现骨转移最为常见[24]。目前,临床上针对骨转移癌痛的治疗分为病因治疗和对症治疗,对症治疗以三阶梯镇痛治疗为基础,涵盖镇痛泵、中医针灸和中药渗透、热疗理疗等。按照WHO癌痛三阶梯镇痛原则治疗,80%~90%肿瘤骨转移疼痛可得到有效缓解。
[专家推荐]推荐阿片类药物(如芬太尼透皮贴剂,吗啡等)联合双膦酸盐(如帕米膦酸二钠、唑来膦酸)或地舒单抗治疗骨转移性癌痛(推荐等级Ⅱ级,证据等级2A级,共识度:98.08%)。
3.4.3癌性疼痛伴有肠梗阻
[专家推荐]对于癌性疼痛伴有肠梗阻的患者使用芬太尼透皮贴剂联合抗胃肠分泌药物如抗胆碱药物(氢溴酸东莨菪碱、山茛菪碱等)、生长抑素类似物(奥曲肽和长效奥曲肽)、激素类药物、止吐药物及补液进行镇痛治疗[5,11](推荐等级Ⅱ级,证据等级2A级,共识度:98.08%)。
3.5不良反应 芬太尼透皮贴剂属阿片类药物,具有阿片类药物共同的不良反应,如便秘、恶心、呕吐和嗜睡等。这些不良反应会随着用药时间延长而逐渐减轻,并产生耐受,一般3~7 d。终身不耐受的不良反应为便秘。由于芬太尼透皮贴剂采用经皮给药方式,不经过胃肠道系统,因此恶心呕吐、便秘等不良反应的发生率明显低于口服阿片类药物。芬太尼透皮贴剂引起的严重不良反应是呼吸抑制,经对症处理均可缓解。其不良反应的处理如下。
3.5.1恶心呕吐 芬太尼可直接刺激延髓化学感受器,同时也作用于胃肠道受体,引起恶心呕吐的发生。引起恶心、呕吐的发生率约30%,一般发生于用药初期,症状多在一周内缓解。这类不良反应的发生及其严重程度与个体差异有关。患者出现恶心、呕吐时应首先排除是否有其他原因,如便秘、脑转移、放化疗、高钙血症等。轻度恶心可选用甲氧氯普胺、氯丙嗪或氟哌啶醇。重度恶心、呕吐者应按时给予止吐药及静脉营养液的补充[25],并加强患者的护理工作:
(1)患者饮食宜清淡、易消化,少量多餐,避免进甜食或油腻、辛辣、刺激性强的食物。(2)饭后漱口,保持口腔的清洁和进餐环境的整洁。(3)对于既往有阿片类药物恶心呕吐史和敏感体质的患者,遵医嘱给予止吐药物治疗,预防恶心、呕吐症状的发生。
[专家推荐]初用芬太尼透皮贴剂第1周内,同时给予止吐药预防,如甲氧氯普胺等(推荐等级Ⅰ级,证据等级1A级,共识度:96.15%)。
3.5.2便秘 临床研究已证实阿片受体广泛分布于胃肠道平滑肌细胞、交感神经末梢及外周感觉神经末梢内。芬太尼作用于胃肠道和脊髓等多部位,引起便秘的原因包括:与肠道内μ阿片受体结合,阻断了肠道动力所需的节律肠壁收缩运动而损伤了肠道功能,使肠蠕动缓慢,肠液分泌减少、吸收增多;降低肠肌层丛中兴奋性和抑制性神经元的活性,使患者对引起排便反射的刺激不敏感;增加肠壁平滑肌张力并抑制协调性蠕动,从而使非蠕动性收缩增加; 通过激活μ受体和δ受体,减少上皮分泌和促进水、电解质的重吸收,进而促进便秘的形成。便秘作为阿片类药物常见的不良反应,很多患者常常终身不可耐受[26-27]。临床上需重视便秘的预防,可采取下列方式加强护理:
(1)充分了解患者每日排便情况、粪便的性状、肛门排气情况、腹胀情况、肠蠕动情况。(2)评估患者进食情况,鼓励患者多饮水,多食富含粗纤维的蔬菜及新鲜水果。(3)根据患者自身状况鼓励床上或床下活动。(4)实施环形顺时针按摩腹部,预防性使用中成药腹部外贴,促进肠蠕动。(5)顽固性便秘使用芬太尼透皮贴剂期间,可备用缓泻剂。根据患者的大便习惯,使用缓泻剂预防便秘。(6)便意明显且排便困难时给予开塞露,必要时可灌肠。
[专家推荐]使用芬太尼透皮贴剂期间,可备用缓泻剂,根据患者的大便习惯使用缓泻剂(推荐等级Ⅰ级,证据等级1A级,共识度:100.00%)。
3.5.3嗜睡及过度镇静 阿片类药物引起过度镇静与中枢神经系统抑制作用有关,当相对“过量”的阿片药物与脑部阿片受体结合后,引起膜电位超极化,使神经递质释放减少,包括乙酰胆碱、去甲肾上腺素、多巴胺及P物质等,从而阻断神经冲动的传递,在产生镇痛作用的同时亦产生镇静作用。这种效应可与镇静药和镇静性催眠药的呼吸抑制作用呈相加作用[28]。
[专家推荐](1)对于发生过度镇静,首先考虑减量或停药,再考虑阿片类药物的轮换(推荐等级Ⅲ级,证据等级2B级,共识度:96.15%)。(2)对于曾发生过度镇静的患者,可预防性给予中枢兴奋剂:哌醋甲酯,右旋安非他命(推荐等级Ⅲ级,证据等级2B级,共识度:92.31%)。
3.5.4尿潴留 尿潴留发生机制可分为外周与中枢作用。阿片类药物增加平滑肌张力,会引起膀胱痉挛,增加括约肌张力导致尿潴留。另吗啡结合脊髓阿片受体,抑制骶副交感神经发放冲动,使输尿管收缩,膀胱逼尿肌松弛的同时,括约肌张力增加,膀胱容量增大,膀胱内压不能克服尿道括约肌阻力而导致尿潴留[29]。目前认为阿片类药物引起尿潴留的机制是以脊髓机制为主。发生尿潴留时首先可诱导自行排尿,采取流水诱导、热水冲会阴部和按摩膀胱区等。诱导排尿失败时可以考虑导尿。对于持续尿潴留难缓解的患者,可以考虑换用镇痛药物。
[专家推荐]使用芬太尼透皮贴剂发生尿潴留不能缓解者,可采取相应措施进行对症处理(推荐等级Ⅲ级,证据等级2B级,共识度:100.00%)。
3.5.5瘙痒 应用阿片类药物抑制疼痛,脊髓轴索内接受多重感受的神经元可能同时接受瘙痒和疼痛信号,使两种信号混淆,而加重瘙痒症状[30]。阿片类药物引起的皮肤瘙痒占2%~10%,一般发生在硬膜外或脊柱内注射阿片类药物,芬太尼透皮贴剂引起的皮肤瘙痒发生率相对较低,其可能机制为中枢介导的组胺释放。出现瘙痒时,告知患者用指腹或手心轻轻拍打局部皮肤,也可用手指用力按压血海、足三里穴位2~3 min。忌用手搔抓皮肤、热水烫洗瘙痒部位及使用肥皂等刺激性强的物品,嘱患者穿宽松棉质的衣服,严重瘙痒者遵医嘱用药。
[专家推荐](1)出现皮肤瘙痒一般是阿片类药物的毒副反应,而对于芬太尼透皮贴剂还需要考虑是否由于过敏导致(推荐等级Ⅱ级,证据等级1B级,共识度:98.08%)。(2)抗组胺药通常用于瘙痒症状的治疗,包括西替利嗪、苯海拉明、氯雷他定等(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
3.5.6眩晕 药物性眩晕一般是指药物所致的前庭和耳蜗损害而引起的眩晕[31]。而阿片类药物引起眩晕的机理主要是对中枢的抑制作用。皮层中枢受抑制时表现为头昏及轻度失平衡,但并无运动错觉。应用阿片类药物后,由于皮层中枢的强抑制,有关平衡的各种传入信息不能在中枢获得综合与分析,因而患者出现头昏症状,主诉为昏沉。不属于真性眩晕范畴。
[专家推荐](1)初次使用阿片类药物时剂量不宜过大,应从低剂量逐渐增加到最佳剂量。轻度眩晕可在用药数日后自行缓解。中重度眩晕则要考虑酌情降低阿片类药物的服用剂量。严重者药物治疗,以减轻症状。同时,患者需要注意休息、改变体位时动作要缓,避免深蹲及旋转,同时监测血压和心率(推荐等级Ⅰ级,证据等级2A级,共识度:98.08%)。(2)体弱者、贫血患者使用芬太尼透皮贴剂更易发生眩晕,此类患者使用时需要酌情减量(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
3.5.7呼吸抑制 呼吸抑制是阿片类药物最严重的不良反应。阿片类药物结合μ受体后,干扰脑桥和脊髓中控制呼吸节律的呼吸中枢,通过对脑干呼吸中枢的直接作用,产生剂量相关的呼吸抑制,如大剂量使用阿片类药物可引起窒息。呼吸抑制的临床表现:针尖样瞳孔,呼吸次数减少(<8次·min-1)和(或)潮气量减少,潮式呼吸,紫绀,嗜睡甚至昏迷,骨骼肌松弛,皮肤湿冷,有时可出现心动过缓和低血压[32]。
预防措施:规律用药,小剂量起用,根据病情逐渐加量;对于年老体弱者、严重心肺功能不全者在使用阿片类药物时应密切观察其呼吸、神志、精神状态等。治疗措施:给予1 mL纳洛酮(0.4 mg·mL-1)加入0.9%氯化钠溶液稀释至10 mL,每30~60秒静脉给药1~2 mL,直到症状改善,必要时重复给药,如果10 min内仍无效,且纳洛酮给药总量达到1 mg,需重新评估呼吸抑制的原因及严重程度。因为纳洛酮半衰期短,对于半衰期长的阿片类药物,考虑静脉持续输注纳洛酮。
[专家推荐](1)合并慢性阻塞性肺病、严重肺气肿、心肺功能不全患者慎用芬太尼透皮贴剂(推荐等级Ⅰ级,证据等级2A级,共识度:98.08%)。(2)对于肿瘤终末期合并呼吸困难患者,在排除呼吸道梗阻等因素后可使用芬太尼透皮贴剂(推荐等级Ⅰ级,证据等级1A级,共识度:98.08%)。
3.6药物相互作用
3.6.1芬太尼与中枢神经系统抑制剂的相互作用 芬太尼通过对脑干呼吸中枢的直接作用产生呼吸抑制,因此芬太尼与其他中枢神经系统抑制剂合用,包括苯二氮类药物和其他镇静剂/催眠药、阿片类药物、全身麻醉药、吩噻嗪类药物、肌肉松弛药、抗组胺药,可不成比例地增加中枢神经系统抑制作用,可能发生呼吸抑制、低血压、深度镇静、昏迷或死亡[33-34]。
[专家推荐]建议使用芬太尼期间不饮酒,若患者因替代治疗方案选择有限,需与苯二氮类药物等中枢神经系统抑制剂合用,应尽量采取小剂量、短疗程联合用药,同时密切关注患者呼吸抑制和镇静症状(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
3.6.2芬太尼与CYP3A4抑制剂的相互作用 芬太尼主要通过CYP3A4代谢,与CYP3A4抑制剂(如利托那韦、酮康唑、伊曲康唑、醋竹桃霉素、克拉霉素、奈非那韦、奈法唑酮、胺碘酮、氨普那韦、阿瑞匹坦、地尔硫、红霉素、氟康唑、呋山那韦、维拉帕米或西柚汁)合用时,会导致血液芬太尼浓度升高,从而增加或延长芬太尼的疗效和不良反应,也可能引起严重的呼吸抑制[35]。但是也有研究表明,仅有8%的芬太尼是通过CYP3A4途径代谢,即使同时使用强效CYP3A4抑制剂,也不会产生主要的药物相互作用[36-37]。
[专家推荐]当同时给予CYP3A4抑制剂时,应进行密切监测,必要时应调整芬太尼剂量(推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
3.6.3芬太尼与CYP3A4诱导剂的相互作用 芬太尼与CYP3A4诱导剂(如利福平、卡马西平、苯巴比妥、苯妥英)合用时,可导致芬太尼清除率增高,血药浓度和疗效降低,可能需要调整剂量[37-39]。停止CYP3A4诱导剂治疗,诱导剂的作用逐渐减退,可能导致芬太尼血浓度升高,从而增加延长疗效和不良反应,也可能引起严重的呼吸抑制。
[专家推荐]与CYP3A4诱导剂合用时,应进行密切监测,必要时应调整芬太尼的剂量(推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
3.6.4芬太尼与利尿剂的相互作用 芬太尼影响抗利尿激素释放的机制目前还不明确,可能是由于芬太尼作用于μ受体后,诱导抗利尿激素的释放[40-41],芬太尼如与利尿剂合用,可能降低利尿剂的疗效。
[专家推荐]与利尿剂合用时,应监测患者的利尿降低和/或血压影响体征,必要时增加利尿剂的剂量(推荐等级Ⅲ级,证据等级2B级,共识度:94.23%)。
3.6.5芬太尼与5-HT能药物的相互作用 芬太尼属于阿片类药物的苯基哌啶亚类,它是一种5-HT激动剂,可增强5-HT的释放,并能微弱地抑制5-HT再摄取,从而增加突触内5-HT水平。尚无芬太尼单药引起5-HT综合征的报道。但是与其他5-HT能药物合用或与单胺氧化酶抑制剂(MAO1)合用,包括选择性5-HT再摄取抑制剂(SSRIs)、5-HT和去甲肾上腺素再摄取抑制剂(SNRIs)、三环抗抑郁剂(TCAS)、曲普坦、5-HT3受体拮抗剂、影响5-HT神经递质系统的药物(如米氮平、曲唑酮、曲马多)、某些肌肉松弛剂(如环苯扎林、美他沙酮)、MAO1(如利奈唑胺和亚甲蓝),合用可能增加5-HT综合征的风险,这是一种危及生命的疾病[42-45]。
[专家推荐]应由有经验的医生评估芬太尼与5-HT能药物或MAO1一起使用的风险,并密切监测,特别是在治疗开始和剂量调整期间。若怀疑有5-HT综合征,应停止芬太尼透皮贴剂治疗。有报道,芬太尼贴剂与5-HT能药物同时使用期间,增加芬太尼的更换频率可能触发5-HT综合征,因此不建议增加芬太尼贴剂的更换频率(推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
4 安全管理
4.1芬太尼透皮贴剂大剂量应用的安全性 芬太尼透皮贴剂是否可以大剂量使用在临床中存在一定的顾虑。说明书中也提到芬太尼透皮贴剂的剂量超过300 μg·h-1,一些患者可能需要额外的或改变阿片类药物的用药方法。芬太尼透皮贴剂作为强阿片类药物,在临床应用中无剂量限制, 国内外文献报道使用芬太尼透皮贴剂从300~1050 μg·h-1[46-47],可安全有效的缓解患者的疼痛情况。因此,临床上可结合患者具体情况给予大剂量芬太尼透皮贴剂(>300 μg·h-1)治疗,必要时联合非药物治疗手段干预。
[专家推荐]芬太尼透皮贴在临床应用过程中,患者疼痛未达到缓解,经综合评估,若为剂量不足,应在患者可接受不良反应的情况下遵循加量原则进行加量,直至疼痛达到缓解(推荐等级Ⅱ级,证据等级2A级,共识度:98.08%)。
4.2老年患者[48]肿瘤患者受器官功能退化、血浆蛋白水平低等因素影响,药物代谢速度缓慢,用药不良反应发生率高。患者在治疗过程中主要出现的不良反应为排尿困难、便秘、瘙痒、恶心、呕吐及嗜睡。研究表明,芬太尼透皮贴剂在老年肿瘤患者中不良反应的发生率明显低于口服吗啡和羟考酮。
[专家推荐](1)对于老年患者(年龄大于等于65岁),芬太尼透皮贴剂初始剂量可以等同于成人剂量(25 μg·h-1)开始使用(推荐等级Ⅰ级,证据等级2A级,共识度:98.08%)。(2)对于口服吗啡、羟考酮等阿片类药物发生Ⅱ级以上不良反应且不能耐受的老年患者,建议更换为芬太尼透皮贴剂(推荐等级Ⅱ级,证据等级2A级,共识度:96.15%)。
4.3儿童患者[49-51]芬太尼贴剂说明书指出:本品在儿童中使用的有效性和安全性尚未明确。研究表明,对于≥2岁的阿片耐受的儿童慢性疼痛患者,应用芬太尼透皮治疗系统控制疼痛是安全且有价值的。药代动力学研究表明,儿童达到稳态血清药物浓度的时间似乎更长,清除率(以每千克小时表示)更高,儿童消除半衰期比成人短。与成人相比,在不良反应的影响或特征上没有根本的区别。
由于儿童对芬太尼代谢较快,儿童可能比成人需要更长的时间才能达到稳定的血浆芬太尼浓度,与年龄较大的儿童或成人相比,年龄较小的儿童可能需要更高的剂量。但需要谨慎使用,避免过量引起呼吸抑制等严重不良反应。
[专家推荐]儿童肿瘤疼痛患者使用芬太尼透皮贴剂初始剂量可从低剂量12.5 μg·h-1起始(推荐等级Ⅲ级,证据等级2B级,共识度:92.31%)。
4.4存储
[专家推荐]芬太尼贴剂应存放在常温保存,置于儿童和宠物看不见和接触不到的地方。使用后贴剂应沿粘贴面对折,然后放回原来的包装中遵医嘱处理。任何意外接触芬太尼贴剂粘附面的非用药人员,应立即移除并立即就医(推荐等级Ⅱ级,证据等级2A级,共识度:96.15%)。
4.5处方管理 2020年版《中国药典》中,《缓释、控释制剂指导原则》明确规定:缓释制剂系指在规定释放介质中,按要求缓慢地非恒速释放药物,其与相应的普通制剂比较,给药频率减少一半或给药频率有所减少;控释制剂系指在规定释放介质中,按要求缓慢地恒速或接近恒速释放药物,其与相应的普通制剂比较,给药频率减少一半或给药频率有所减少。芬太尼透皮贴剂以恒定的释药速率通过皮肤进入体内,故芬太尼透皮贴剂属于控释剂型。对于麻醉药品控缓释剂型的处方用量和天数,2007年发布施行的《处方管理办法》中做出了明确规定,芬太尼透皮贴剂的处方管理应参照此规定。
为门(急)诊患者开具,每张处方不得超过7日常用量;为门(急)诊癌症疼痛患者和中、重度慢性疼痛患者开具,每张处方不得超过15日常用量;为住院患者开具每张处方应当为1次常用量。
5 患者教育
5.1使用方法
5.1.1部位选择
[专家推荐]芬太尼透皮贴剂粘贴部位应选择前胸、后背、上臂、大腿内侧或腹部无毛发且平坦区域进行粘贴,避开脊椎、有损伤、瘢痕、放疗及易活动部位的皮肤作为粘贴部位。对于晚期癌症卧床患者,翻身时要注意不要摩擦贴剂,以防贴剂卷边或脱落;对于大小便失禁或床上大小便患者不宜贴敷在大腿内侧;对于出汗较多患者不宜贴附在后背、前胸或腹部。对于较瘦的患者或恶液质患者,贴剂尽量贴在有皮下组织处,避开骨隆突处;选用的部位用清水清洗时,应避免用力揉搓皮肤,禁忌使用肥皂、清洁剂、75%乙醇或碘酊等有机溶剂涂擦局部。贴膜紧贴皮肤,中间无空隙,以手掌轻按贴膜30 s,并用手指沿贴膜边缘再按1次,确保贴膜与皮肤充分接触[52-53](推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
5.1.2按时换贴
[专家推荐]正常情况下72 h按时换贴,少部分患者需要48 h更换(如剂量终末期疼痛患者)(推荐等级Ⅲ级,证据等级2B级,共识度:100.00%)。
(1)维持镇痛效果低于72 h,可当日重新对患者进行滴定(即释吗啡),计算出当日即释吗啡总量,换算成等效芬太尼透皮贴剂剂量给药。滴定的芬太尼贴剂剂量加基础给药剂量作为下个给药周期总剂量。
(2)吗啡或羟考酮口服用药轮换为芬太尼透皮贴剂时,可在末次口服用药6~12 h后进行芬太尼透皮贴剂的更换,期间仍遵循疼痛滴定原则。
(3)如患者出现连续3个使用周期镇痛效果低于60 h,需对患者疼痛情况重新做评估,必要时采用联合用药模式或非药物方式进行疼痛治疗。
(4)更换贴剂时撕下旧贴,避免芬太尼药物蓄积,并同时更换粘贴部位。
5.1.3停药
[专家推荐]应该采用逐渐减量法,每3天减量10%~25%,直到每天剂量相当于 30 mg口服吗啡的药量即12.5 μg·h-1芬太尼透皮贴剂,再继续贴用两天后即可停药[20](推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
5.2注意事项
5.2.1避免接触热源 芬太尼透皮贴剂在使用过程中应该避免接触热源。药品说明书的提示温度增加至40 ℃时血药浓度升高1/3,因为热量可促进芬太尼释放,并使芬太尼通过皮肤吸收增加,而这可导致出现严重的不良反应。应指导患者避免将本品的贴用部位直接与热源接触,如:加热垫、电热毯、加热水床、烤灯或日照灯、强烈的日光浴、热水瓶、长时间的热水浴等,如果使用贴剂时有发热情况,须立刻告知医生[54-55]。
[专家推荐](1)发热的患者不建议使用,但对于低热的患者需要使用时可酌情使用,但需密切观察(推荐等级Ⅲ级,证据等级3级,共识度:98.08%)。(2)使用芬太尼透皮贴剂的期间可进行简单的淋浴,但应避免长时间冲洗粘贴部位。不建议进行盆浴(推荐等级Ⅱ级,证据等级2A级,共识度:98.08%)。
5.2.2易出汗的患者
[专家推荐]出汗较多患者应粘贴在上臂内侧或大腿内侧汗液较少的部位,并用透气敷料加以固定,以减少卷边或脱落机会(推荐等级Ⅲ级,证据等级2B级,共识度:98.08%)。
5.2.3换贴后是否再有起效时间
[专家推荐]首次使用芬太尼透皮贴剂6~12 h需要过渡镇痛剂量的阿片类药物进行渡过贴剂的起效期。更换贴剂时,脂肪内储存有芬太尼,血药浓度保持稳定,因此不需要过渡镇痛的阿片类药物[56-57](推荐等级Ⅱ级,证据等级2A级,共识度:100.00%)。
5.2.4可否剪切使用
[专家推荐]骨架型芬太尼透皮贴剂可以剪切使用,相较储库型剂量调整更加灵活,而储库型芬太尼不可剪切,存在药液渗漏的风险[58](推荐等级Ⅲ级,证据等级2B级,共识度:100.00%)。
5.2.5应急预案
[专家推荐]对于出现严重不良事件的患者,立即移除贴剂,并用湿毛巾清洁局部皮肤,防止药物的继续吸收。禁止使用热毛巾擦洗,避免毛孔及毛细血管扩张而加速皮肤上残留药物的吸收。并在此后监测至少24 h(推荐等级Ⅰ级,证据等级2A级,共识度:100.00%)。
6 患者管理
(1)需长期使用芬太尼透皮贴剂的门(急)诊癌症疼痛患者或中、重度慢性疼痛患者,首诊医师应当亲自诊查患者,建立相应的病历,要求其签署《知情同意书》。病历中应当留存下列材料复印件:二级以上医院开具的诊断证明;患者户籍簿、身份证或者其他相关有效身份证明文件;为患者代办人员身份证明文件。
(2)对长期使用芬太尼透皮贴剂的门(急)诊癌症患者和中、重度慢性疼痛患者,应每3个月复诊或者随诊一次。
7 随访
建立健全癌痛患者随访制度,对于接受癌痛规范化治疗患者出院后一周内进行第一次随访,疼痛缓解1~2周随访一次[59],居家访视每周一次,对于爆发痛在8分以上的患者,进入下一周期个性化治疗与随访[60]。随访内容包括疼痛和不良事件评估,并记录。开展患者指导,注重人文关怀,最大限度满足患者的镇痛需要,保障其获得持续、合理、安全、有效的治疗。
随着临床实践的进步和临床硏究的发展,疼痛治疗药物在剂型、种类、给药途径方面不断丰富,芬太尼透皮贴剂作为长效止痛制剂丰富了临床癌痛患者的镇痛用药手段,同时疼痛三阶梯治疗方案的内涵和理念也有进一步发展,如第二阶梯药物的弱化、缓释制剂的滴定、疼痛管理目标的改变、及早控制癌痛原则的衍变等[61]。合理、规律、有效运用现有的镇痛药物,不仅能最大程度地缓解肿瘤患者疼痛症状,而且能够减少甚至避免不良反应,提高患者生存质量。展望未来,我们将不断改进和更新指南,细化诊疗方案,积累我国高质量循证医学证据,从而提高医药护在芬太尼透皮贴剂临床应用方面的认知度和诊疗能力,减少不同地区的诊疗水平差异。
《芬太尼透皮贴剂临床合理用药指南》编写组
特邀顾问:
于世英 华中科技大学同济医学院附属同济医院
魏少忠 湖北省肿瘤医院
杜光 华中科技大学同济医学院附属同济医院
主任委员:
陈元 华中科技大学同济医学院附属同济医院
专家成员名单(按姓氏拼音排序):
曹风军 十堰市人民医院
陈凤菊 华中科技大学同济医学院附属同济医院
陈萍 十堰市人民医院
褚倩 华中科技大学同济医学院附属同济医院
戴助 湖北省肿瘤医院
邓涤 武汉大学中南医院
杜伟 荆州市第一人民医院
段春燕 恩施土家族苗族自治州中心医院
范厚武 监利市中医医院
呙清临 公安县中医医院
胡建莉 华中科技大学同济医学院附属协和医院
胡作为 武汉市第一医院
柯红 国药葛洲坝中心医院
匡黎 国药东风总医院
李道俊 宜昌市中心人民医院
李俊 孝感市中心医院
李林均 湖北省中西医结合医院
李欣 宜昌市第二人民医院
刘金梅 华中科技大学同济医学院附属协和医院
刘静 长江大学附属黄冈市中心医院
刘修莉 宜昌市第一人民医院
罗秀丽 湖北省中医院
明帮春 十堰市太和医院
潘险峰 荆州市中心医院
冉凤鸣 湖北省肿瘤医院
冉瑞智 恩施土家族苗族自治州中心医院
舒诚荣 咸宁市中心医院
孙建海 湖北省第三人民医院
唐昃 黄石市中心医院
陶卫平 武汉大学人民医院
王纯 武汉市中心医院
王惠芬 湖北省肿瘤医院
王建中 武汉钢铁(集团)公司第二职工医院
王群 武汉市第五医院
徐苏颖 湖北省肿瘤医院
杨波 中国人民解放军中部战区总医院
易铁男 襄阳市中心医院
尹宜发 宜昌市第二人民医院
张程亮 华中科技大学同济医学院附属同济医院
张弓 武汉大学中南医院
赵艳霞 华中科技大学同济医学院附属协和医院
赵勇 中国人民解放军中部战区武汉总医院
赵元华 湖北省肿瘤医院
执笔组长:
付强 华中科技大学同济医学院附属同济医院
执笔成员:
韩娜 华中科技大学同济医学院附属同济医院
李娜 武汉大学人民医院
桂玲 华中科技大学同济医学院附属同济医院
史琛 华中科技大学同济医学院附属协和医院
戎佩佩 武汉大学人民医院
曾凡 华中科技大学同济医学院附属同济医院
饶翮 武汉大学中南医院
陈元 华中科技大学同济医学院附属同济医院
