西瓜藤镇痛活性部位筛选及作用机制研究*
2021-11-04龚小妹欧春丽侯小利张文玉陈硕周小雷王硕
龚小妹,欧春丽,侯小利,张文玉,陈硕,周小雷,王硕
(1.广西药用植物研究所,西南濒危药材资源开发国家工程实验室,南宁 530021;2.山东省济南市历下区人民医院中药科,济南 250000)
西瓜藤为葫芦科(Cucurbitaceae)植物西瓜(Citrulluslanatus)的藤茎。其作为农作物废弃物,资源非常丰富,如不合理利用会造成资源浪费,还会给环境造成压力。开展其药用价值研究,对开发新的药用资源,实现中药资源可持续发展具有重要意义[1]。笔者前期研究发现,西瓜藤总提取物具有较好抗炎镇痛活性[2-6],但其镇痛作用活性部位及机制尚不明确。在前期研究基础上,笔者采用2.5%甲醛溶液致小鼠足下疼痛实验研究西瓜藤镇痛活性部位,并研究西瓜藤镇痛活性部位的镇痛作用机制,以期为西瓜藤的进一步开发应用提供参考。
1 材料与方法
1.1实验动物 健康昆明种小鼠,雌雄各半,体质量(20±2)g,无特定病原体(SPF)级,由广西医科大学实验动物中心提供,实验动物生产许可证号:SCXK(桂)2014-0002,实验动物使用许可证号:SYXK(桂)2014-0003。饲养条件:小鼠分笼饲养,自由饮食,饲养室温度(23±2) ℃,相对湿度(60±5)%,光暗周期同昼夜周期。
1.2药物 西瓜藤采自广西壮族自治区南宁市吴圩,经广西药用植物研究所赵以民副研究员鉴定,为葫芦科植物西瓜CitrullusLanatus的藤茎;吲哚美辛片(山西云鹏制药有限公司生产,批号:A120708)。
1.3试剂 β-内啡肽(beta-endorphin,β-EP)、5-羟色胺(5-hydroxy tryptamine,5-HT)、一氧化氮(NO)、前列腺素E2(prostaglandin E2,PGE2)、P物质(substance P,SP)和去甲肾上腺素(noradrenaline,NE)等试剂盒由武汉华美生物工程有限公司生产,批号分别为D27014434、C32025571、D27011128、C051024113、B051125119、D27013145;总RNA提取试剂盒(天根生化科技有限公司,批号:O3527);2.5%甲醛溶液(甲醛含量37.0%~40.0%,西陇化工股份有限公司,批号:1305051);乙醇、石油醚、乙酸乙酯、正丁醇(天津市富宇精细化工有限公司生产,批号分别为110930,1208291,1305181,110825)。
1.4主要仪器 SB-1100水浴锅、N-1106旋转蒸发仪、EYELA-CA-1111循环冷凝真空泵(上海爱明仪器有限公司);HX502T电子天平(慈溪市天东衡器公司,感量:0.1 mg);Tecan Infinite F200酶标仪(瑞士帝肯Tecan);BIO-RAD基础电泳仪(北京市六一仪器厂);离心机(德国艾本德生命科学公司,型号:Centrifuge 5430R)。
1.5西瓜藤提取物的制备 取西瓜藤干品5 kg,粉碎,分别用药材量的10和8倍水煮沸提取2和1.5 h,合并提取液,浓缩干燥,即得西瓜藤水部位提取物(浸膏0.8 kg)。取西瓜藤干品20 kg,粉碎,用药材量的5倍80%乙醇分别超声处理2和1 h,滤过,减压浓缩得醇提取浸膏2.4 kg(每克浸膏相当于生药8.3 g),将浸膏分散于去离子水5000 mL,静置过夜,3000 r·min-1离心(r=10 cm),分离不溶于水的黏稠固体悬浮物。取水溶液,依次用3倍量石油醚、乙酸乙酯、正丁醇萃取样品,得石油醚部位提取物浸膏(0.12 kg)、乙酸乙酯部位提取物浸膏(0.13 kg)、正丁醇部位提取物浸膏(0.40 kg)[5]。
1.6致痛实验 取健康昆明种小鼠110只,雌雄各半,采用随机分组法分为11组,每组10只,分别为吲哚美辛组[吲哚美辛片,0.009 g·kg-1·d-1,于实验前将吲哚美辛片用研钵粉碎,过孔径0.075 μm(200目)筛,按成人每天每次使用69.23 mg换算成小鼠给药剂量,0.9%氯化钠溶液溶解,配成0.9 mg·mL-1混悬液,按0.2 mL·(20 g)-1·d-1灌胃],空白对照组和模型对照组[给予0.9%氯化钠溶液,按0.2 mL·(20 g)-1·d-1灌胃],西瓜藤石油醚部位提取物大剂量、小剂量组(给药剂量相当于生药20.0,5.0 g·kg-1·d-1),西瓜藤乙酸乙酯部位提取物大剂量、小剂量组(给药剂量相当于生药20.0,5.0 g·kg-1),西瓜藤正丁醇部位提取物大剂量、小剂量组(给药剂量相当于生药20.0,5.0 g·kg-1·d-1),西瓜藤水部位提取物大剂量、小剂量组(给药剂量相当于生药20.0,5.0 g·kg-1·d-1)。空白对照组左后足跖皮下注射0.9%氯化钠溶液,其他各组给药前左后足跖皮下注射2.5%甲醛溶液30 μL,计时,立即置平底大玻璃容器,记录给药前小鼠注射2.5%甲醛溶液后1~5 min(Ⅰ相)和15~35 min(Ⅱ相)内痛反应累积时间,评分。1周后,空白对照组和模型对照组灌胃0.9%氯化钠溶液,0.2 mL·(20 g)-1,其他各组灌胃相应药物,连续7 d。末次给药后1 h,空白对照组左后足跖皮下注射0.9%氯化钠溶液,其他各组左后足跖皮下注射2.5%甲醛溶液30 μL,立即置平底大玻璃容器,分别记录小鼠注射2.5%甲醛溶液后1~5 min(Ⅰ相)和15~35 min(Ⅱ相)内痛反应累积时间,评分。评分方法:第一部分为注射2.5%甲醛溶液抬起足时间,第二部分为注射2.5%甲醛溶液舔、咬、抖动足时间,将给药前后评分值代入公式1分别计算各组累积分值,由公式2得出给药后镇痛评分值。公式1:累积分值=(第一部分时间×1+第二部分时间×2)/300;公式2:镇痛评分值=(给药后累计分值/给药前累计分值)×100%[7]。
1.7小鼠血清炎症递质测定 取健康昆明种小鼠60只,雌雄各半,采用随机分组法分为6组,每组10只,分别为空白对照组和模型对照组[0.9%氯化钠溶液,0.2 mL·(20 g)-1·d-1],吲哚美辛组(吲哚美辛片,0.009 g·kg-1·d-1,配制方法同“1.6”项),西瓜藤乙酸乙酯部位提取物大剂量、中剂量、小剂量组(给药剂量相当于生药20.0,10,5.0 g·kg-1·d-1),均连续灌胃给药7 d。末次给药后1 h,除空白对照组外,其他各组小鼠左后足跖皮下注射2.5%甲醛溶液30 μL,15 min后经眼球取血,3500 r·min-1离心15 min(r=10 cm),取上清液检测血清NO、PGE2、5-HT、β-EP、SP与NE含量。
1.8小鼠脑内环氧合酶测定[8]
1.8.1动物分组与模型的制备 取健康昆明种小鼠288只,雌雄各半,随机分组法分为6组,每组48只。给药方法同“1.7”项。连续给药7 d,末次给药后1 h,各组分别取小鼠6只,雌雄各半,处死并取大脑,记为Beffer时间点;剩下各组小鼠,除空白对照组外,其他组小鼠左后足跖皮下注射2.5%甲醛溶液30 μL以诱导炎性痛。并在注射2.5%甲醛溶液后1,2,3,4,5,6,7 d,各组(包括空白对照组)分别取小鼠6只,雌雄各半,处死并取大脑,记为1,2,3,4,5,6,7 d时间点。
1.8.2cDNA第一链合成 在“1.8.1”项中各时间点取的小鼠大脑,采用总RNA提取试剂盒提取总RNA,cDNA第一链合成试剂盒把总RNA合成cDNA。
1.8.3反转录聚合酶链反应分析 将合成cDNA进行聚合酶链反应。聚合酶链反应所用引物:GAPDH(5′-TGAACGGGAAGCTCACTGG-3′,5′-TACAGCAACAGGG-TGGTGGA-3′;产物长度307 bp),COX-1(5′-AGGA-GATGGCTGCTGAGTTGG-3′,5′-AATCTGACTTTCTGA-GTTGCC-3′,产物长度602 bp),COX-2(5′-GGGAA-GCCTTCTCCAACC-3′,5′-GAACCCAGGTCCTCGCTT-3′,产物长度293 bp)。反应条件95 ℃ 2 min,随即30个循环聚合酶链反应,循环温度方案:95 ℃30 s,65 ℃30 s,72 ℃1 min。循环结束后,72 ℃温育10 min,聚合酶链反应所得产物经加有溴化乙锭(ethidium bromide,EB)的琼脂糖电泳,凝胶成像仪进行图像分析。用Quantity One软件测条带的灰度值(integrated density value,IDV),计算出相对IDV。相对IDV=目的基因IDV/内参GAPDH IDV。观察西瓜藤镇痛活性部位对小鼠脑内COX-1、COX-2表达的影响。
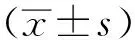
2 结果
2.1小鼠疼痛评分 见表1。与模型对照组比较,西瓜藤乙酸乙酯部位提取物大剂量、小剂量组和吲哚美辛组小鼠给药后Ⅰ相、Ⅱ相累计分值和镇痛评分值均显著降低(P<0.05)。其他各组镇痛作用不明显。因此选择西瓜藤乙酸乙酯部位提取物作为有效镇痛部位进行镇痛机制研究。
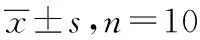
表1 各组小鼠疼痛评分结果
2.2小鼠血清炎症因子测定结果 见表2。与空白对照组比较,模型对照组小鼠血清NO、PGE2、5-HT、SP、NE含量均显著升高(P<0.05),β-EP含量显著降低(P<0.05)。与模型对照组比较,大剂量西瓜藤乙酸乙酯部位提取物可降低2.5%甲醛溶液致痛小鼠血清P物质含量(P<0.05);大剂量、中剂量西瓜藤乙酸乙酯部位提取物能显著升高2.5%甲醛溶液致痛小鼠血清β-EP含量(P<0.05),降低血清NO、PGE2、5-HT、NE含量(P<0.05)。
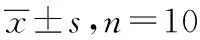
表2 6组小鼠血清NO、PGE2、5-HT、β-EP、SP、NE含量测定结果
2.3小鼠脑内环氧合酶变化 与空白对照组比较,模型对照组致痛前(0 d)脑内COX-1与COX-2表达均无明显变化,致痛后1~4 d脑内COX-1表达较弱,COX-2表达逐渐增强;5~7 d脑内COX-1表达逐渐增强,COX-2表达逐渐减弱。与模型对照组比较,西瓜藤乙酸乙酯部位提取物各剂量组和吲哚美辛组致痛前(0 d)脑内COX-1与COX-2表达均无明显变化;西瓜藤乙酸乙酯部位提取物大剂量组和吲哚美辛组小鼠致痛后1~4 d脑内COX-2表达被明显抑制,5~7 d脑内COX-1表达被明显抑制,见图1~3。
3 讨论
疼痛是机体受到内、外环境刺激后,组织释放致痛物质并传导至感觉中枢,最终进入意识阶段的一个非常复杂的过程,严重影响患者身心健康。目前临床上对疼痛的治疗主要以西药为主,按作用机制可分为中枢镇痛药和外周镇痛药两类。中枢镇痛药主要以阿片生物碱类药吗啡为代表,但易产生成瘾性与耐药性;外周镇痛药主要以解热镇痛类药对乙酰氨基酚、阿司匹林等为代表,但常伴随胃肠道反应、变态反应、凝血障碍等不良反应,因此开发疗效可靠、不良反应少、无依赖性的中药或天然镇痛药物已成为当前镇痛药物研究热点[9-10]。
由于疼痛机制复杂,选择与临床疼痛症状相似的动物模型揭示镇痛药作用机制十分必要[11-12]。2.5%甲醛溶液致痛小鼠模型是目前国际公认的研究药物镇痛作用的主要模型,其导致的疼痛可分为两期,第一期为直接刺激神经末梢引起的疼痛,第二期为炎症递质(如NO、β-EP、5-HT、PGE2、SP、NE等)产生并释放所致[11-12],当机体受到炎性痛刺激时,PGE2作为重要的炎症递质,激活伤害性感受器,导致痛觉过敏,进一步发动和传递痛觉信号[13],β-EP可以通过激动阿片受体从而引起抗伤害性感受或镇痛作用[14],SP能够在神经末梢释放并参与疼痛在脊髓中枢的传导和调制[15],同时产生过多的NO,促进疼痛传导,增加致痛递质的释放[16],5-HT作为一种致痛因子借助第二信使刺激局部和旁分泌并在感觉神经末梢释放而导致疼痛[17]。作为交感神经递质,NE的异常升高与疼痛有密切关系[18]。COX是PGs合成过程中的重要限速酶,其同工酶有COX-1和COX-2,COX-2在疼痛急性早期起重要作用,COX-1与疼痛后期维持有关[19-21]。
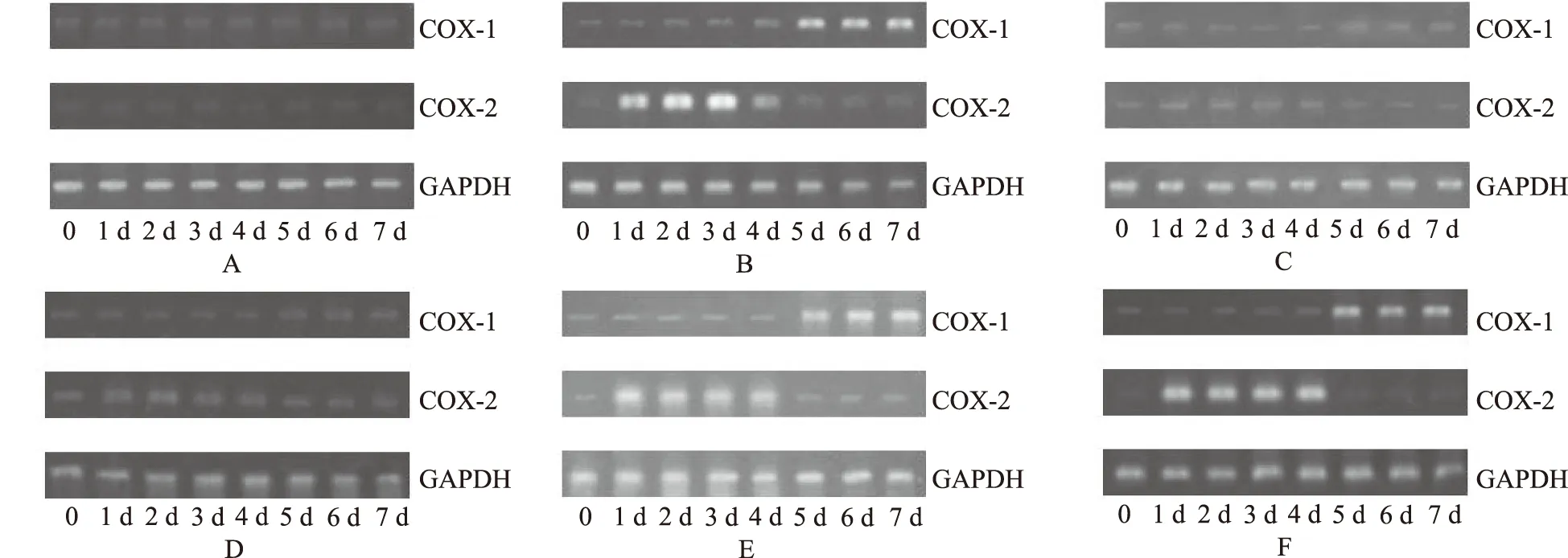
A.空白对照组;B.模型对照组;C.吲哚美辛组;D.西瓜藤乙酸乙酯提取物大剂量组;E.西瓜藤乙酸乙酯提取物中剂量组;F.西瓜藤乙酸乙酯提取物小剂量组。
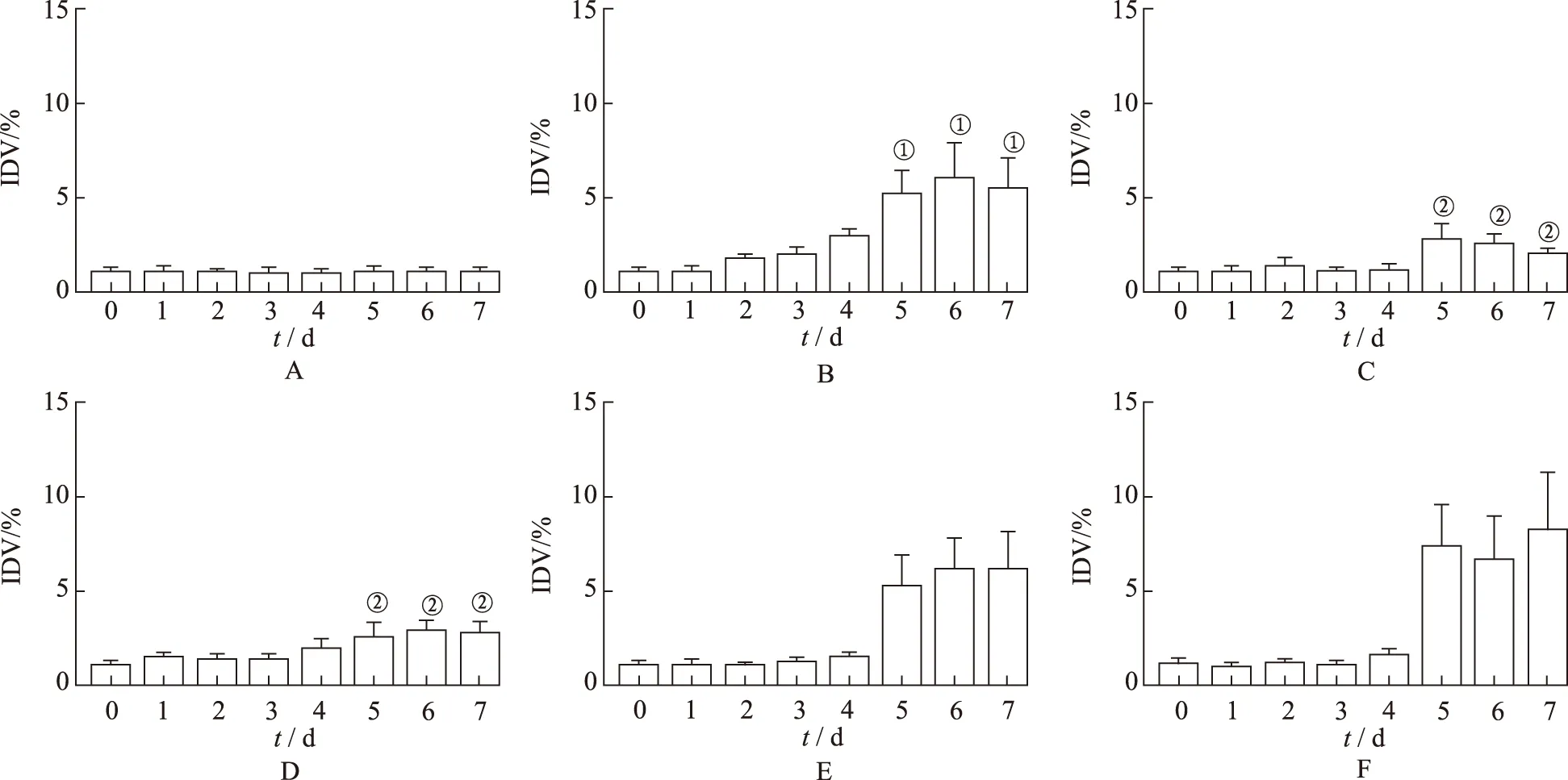
A.空白对照组;B.模型对照组;C.吲哚美辛组;D.西瓜藤乙酸乙酯提取物大剂量组;E.西瓜藤乙酸乙酯提取物中剂量组;F.西瓜藤乙酸乙酯提取物小剂量组;①与空白对照组比较,P<0.05;②与模型对照组比较,P<0.05。
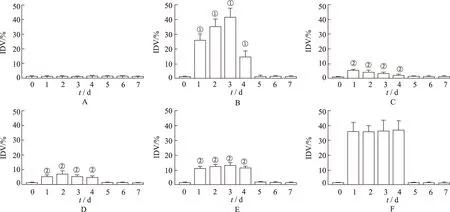
A.空白对照组;B.模型对照组;C.吲哚美辛组;D.西瓜藤乙酸乙酯提取物大剂量组;E.西瓜藤乙酸乙酯提取物中剂量组;F.西瓜藤乙酸乙酯提取物小剂量组;①与空白对照组比较,P<0.05;②与模型对照组比较,P<0.05。
研究表明[22-23],中药镇痛作用主要通过提高中枢阿片肽、5-HT、NO水平,阻断中枢性钙通道,抑制前列腺素合成,减少脑组织兴奋性氨基酸含量,以及通过减少外周致痛物质分泌等发挥作用。本研究显示,西瓜藤乙酸乙酯部位提取物能显著降低2.5%甲醛溶液致痛模型小鼠Ⅰ相、Ⅱ相镇痛评分值,降低外周致痛物质NO、PGE2、5-HT、SP、NE含量,升高β-EP含量;同时能抑制2.5%甲醛溶液致痛后小鼠大脑内COX-1与COX-2表达,可见西瓜藤乙酸乙酯部位提取物可通过中枢和外周两方面发挥较好镇痛作用,本实验结果可为将西瓜藤开发成新型中药镇痛新药提供参考,也为农作物废弃物的合理再利用提供新思路。
