急性百草枯中毒小鼠氨基酸代谢特点
2021-11-04朱旷旷谢建絮余海波
朱旷旷, 谢建絮, 余海波, 彭 艾
(同济大学附属第十人民医院肾脏风湿科,上海 200072)
百草枯(paraquat, PQ)作为高效、环保的除草剂,在全球范围内广泛用于农业领域清除各种杂草[1]。PQ因其剧毒性而被一些国家限制使用,尽管如此,PQ中毒致死事件的发生依旧不容乐观。直接接触和经口摄入是PQ中毒的主要途径,由于临床缺乏特效解毒药物,口服PQ死亡率高达90%[2]。
近年来,多项研究证实氨基酸在活性氧类(rea-ctive oxygen species, ROS)产生及抗氧化应激损伤中发挥重要作用,如支链氨基酸(branched-chain amino acids, BCAA)、含硫氨基酸等[3]。PQ干扰细胞内的电子传递链系统造成线粒体损伤,造成机体内部氧化应激水平激增和炎症风暴,是PQ中毒造成器官损伤的主要机制[4-5]。可见,氨基酸代谢在氧化应激损伤中的作用机制可能在PQ诱导的器官损伤中发挥关键作用。
PQ进入人体后迅速分布于各组织器官,且在肺、肝脏和肾脏中异常聚集[6],然而目前关于PQ中毒后氨基酸代谢特征的研究鲜有报道。因此,本研究通过高效液相色谱质谱串联(liquid chromatography tan-dem mass spectrometry, LC-MS/MS)技术靶向检测PQ中毒小鼠的血浆和肝脏的氨基酸水平,并进一步探索血浆氨基酸与肝肾功能的关联性,旨在寻找更加灵敏的辅助诊断指标,进而为PQ中毒早期的临床诊疗以及评估策略提供理论指导。
1 材料与方法
1.1 试剂
化学标准品包括丙氨酸、异亮氨酸、亮氨酸、鸟氨酸、天冬氨酸、天冬酰胺、赖氨酸、甘氨酸、缬氨酸、谷氨酸、苏氨酸、苯丙氨酸、精氨酸、半胱氨酸、蛋氨酸、丝氨酸、组氨酸、脯氨酸、酪氨酸、色氨酸、牛磺酸等21种氨基酸及相应的内部标准品、PQ均购自美国Sigma公司;LC-MS级试剂甲醇、乙腈、甲酸、七氟丁酸均购自美国赛默飞公司。
1.2 实验动物
30只无特定病原体级别雄性小鼠(C57BL/6J,6周龄)购自上海吉辉实验动物饲养有限公司,饲养于同济大学沪北实验动物中心,12 h光照/黑暗循环且恒温环境下自由饮食。动物实验获得同济大学附属第十人民医院实验动物伦理委员会的批准,实验动物许可证号为SYXK2018-0034。
1.3 PQ小鼠模型构建及样品采集
将30只小鼠随机分为3组: 空白对照组(对照组,n=10,注射无菌生理盐水)、百草枯中毒4 h组(PQ中毒4 h组,n=10)和百草枯中毒48 h组(PQ中毒48 h组,n=10),将百草枯粉剂溶于无菌生理盐水中按50 mg/kg给药[7]。给药4 h/48 h后腹膜下注射3.5%水合氯醛0.35 mL,麻醉后收集血液置于抗凝Eppendorf管中,于5427R离心机(Eppendorf,德国汉堡公司)中,4 ℃,800×g,离心15 min,吸取血浆置于1.5 mL Eppendorf管后存于-80 ℃。分离肝组织于液氮中淬灭后存于-80 ℃。
1.4 血浆样品制备
将标准品以及带有相应同位素标记的氨基酸分别制成1 mg/mL的水溶液,随后将两者等体积混合后使用甲醇稀释配制成内标混合液。将对照组和PQ中毒4 h组小鼠血浆置于冰上缓慢解冻后,取20 μL血浆加入混有20 μL内标溶液以及160 μL含0.5%甲酸的甲醇溶液的Eppendorf管中,使用MixMate混匀仪(Eppendorf,德国汉堡公司)振荡5 min,4 ℃,13 000×g,离心10 min,取上清液存于-20 ℃。
1.5 组织样品制备
取出对照组和PQ中毒4 h组肝脏置于冰上缓慢融化后,分离适量样品并称重,加入500 μL 80%的甲醇溶液(含0.1%氨水)后使用组织破碎机在4 ℃、65 Hz条件下匀浆6 min;涡旋振荡30 s后4 ℃ 超声振荡30 min,于-20 ℃静置1 h后,4 ℃静置30 min,4 ℃,13 000×g,离心15 min,取上清液。
1.6 LC-MS/MS分析
使用LC-MS/MS靶向检测血浆和肝脏的氨基酸水平,在配备Venusil ASB-C18(2.1 mm×150 mm,3.0 μm,博纳艾杰尔科技公司)反向色谱柱的1200 Infinity液相色谱仪(美国安捷伦科技公司)上分离收集的样品。柱温40 ℃、流动相流速0.36 mL/min以及4 ℃条件下自动进样5 μL,流动相包括水相和有机相,分别是含有0.4%甲酸以及0.02%七氟丁酸的水(A相)和含有0.3%甲酸及0.02%七氟丁酸的乙腈(B相),洗脱梯度为0~3.5 min,99%A;3.5~5 min,99%~15%A;5~10 min,15%~3%A;10~13 min,3%~99%A;13~15 min,99%A。使用QTRAP 4500质谱仪(美国AB SCIEX公司)三重四极杆-线性离子阱复合质谱系统进行质谱检测,在多反应监测模式下正模式电喷雾电离源离子喷雾电压为5 500 V,气帘气流速2 L/h、离子源气体1流速55 L/h、离子源气体2流速55 L/h,源温度550 ℃,通过注入浓度为1 μmol/L的单一化合物溶液,优化分析物、内标物的解簇电势、碰撞能量以及碰撞池出口电势。
1.7 肝肾功能检测
分离好血清后使用血肌酐(serum creatinine, SCr)、血尿素氮(blood urea nitrogen, BUN)、谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine transaminase, ALT)测定试剂盒(南京建成生物工程研究所,中国),根据生产商的说明书分别检测小鼠SCr、BUN、AST、ALT的水平。
1.8 统计学方法

采用SIMCA-P 16.0.2软件进行代谢组学分析。通过主成分分析(Principal Component Analysis, PCA)来减少两组数据的维度并在无监督模式下进行分类,初步认识数据的集中趋势及离群值。使用监督模式下的正交偏最小二乘-判别分析(orthogonal partial least square-discriminate analysis, OPLS-DA)进一步研究两组数据间氨基酸血浆分布特点,建立分类模型以及计算代谢物的变量重要性值(various important projection, VIP)。采用置换检验评估拟合优度参数(R2)和预测能力参数(Q2),对OPLS-DA建立的预测模型进行验证。以VIP>1,P<0.05为条件筛选差异氨基酸。应用Spearman相关系数分析差异氨基酸与肝肾功能的相关性。
2 结 果
2.1 PQ中毒肝肾功能变化
与对照组相比,PQ中毒4 h组SCr变化无统计学意义(P=0.455),BUN水平显著降低(P=0.009);PQ中毒4 h组肝功能指标AST、ALT较对照组均显著上升(P=0.012、0.023)。PQ中毒48 h组小鼠BUN较对照组显著增高(P=0.001),而SCr、ALT、AST水平虽呈上升趋势,但差异均不具有统计学意义(均P>0.05),提示肾功能随着中毒时间的推移将逐步恶化,见表1。

表1 PQ中毒小鼠肝肾功能Tab.1 Liver and kidney function of mice poisoned by paraquat
2.2 PQ中毒早期氨基酸代谢特点
为了观察PQ中毒早期氨基酸代谢特征,以筛选出更加灵敏的潜在生物标志物,通过LC-MS/MS技术靶向检测对照组和PQ中毒4 h组小鼠血浆和肝脏的氨基酸水平。本研究成功鉴定出上述21种氨基酸(肝组织样本中半胱氨酸水平低于检测阈值,故未列出),见表2~3。

表2 血浆氨基酸水平Tab.2 Plasma levels of amino acids (μg/mL)

表3 肝组织氨基酸水平Tab.3 Amino acid levels in liver tissue (μg/mg)
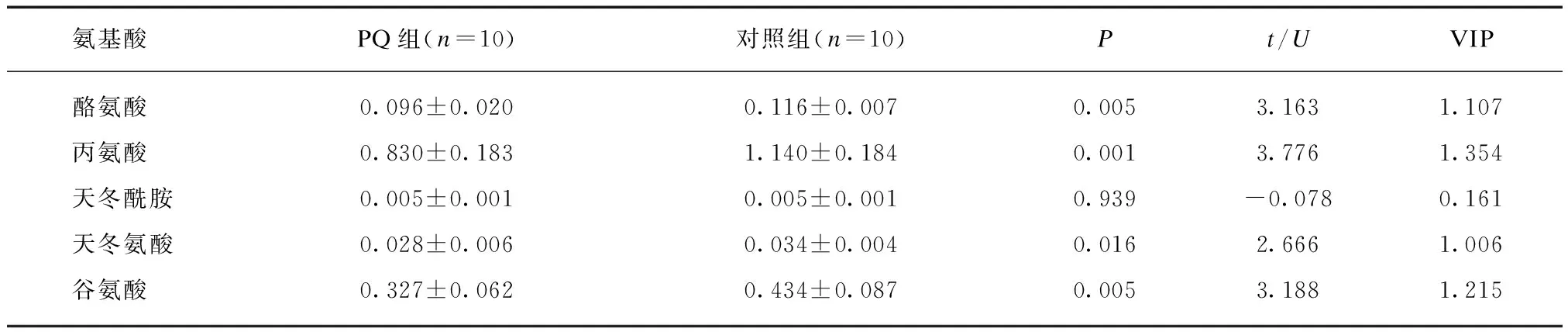
续表
2.2.1 氨基酸代谢的多元统计分析 对21种氨基酸进行多元统计分析,无监督模式的PCA分析显示,血浆氨基酸能够按PQ组和对照组聚类分布,即氨基酸代谢水平可较好地区分两组样本,表明PQ中毒后的氨基酸代谢发生显著改变。95% Hotelling’s T2置信区间线图未发现有超出区间外的离群值。进一步采用结合正交校正信号且有监督模式的OPLS-DA分析两组氨基酸代谢特征,在该模式下氨基酸能够更好地区分PQ组和对照组。OPLS-DA模型的置换检验显示Q2回归线与Y轴截距为负,表明OPLS-DA模型构建有效(R2=0.486, Q2=-781),在肝脏中亦是如此(图1)。在OPLS-DA模型下计算出的氨基酸VIP值见表2~3。

图1 血浆氨基酸的主成分分析和正交偏最小二乘-判别分析Fig.1 Principal component analysis and orthogonal partial least squares-discriminant analysis of plasma amino acidsA: PCA散点得分图;B: Hotelling’s T2置信区间线图;C: OPLS-DA散点得分图;D: 置换检验
2.2.2 差异代谢物分析 与对照组相比,PQ中毒4 h组血浆亮氨酸、色氨酸、缬氨酸、异亮氨酸、组氨酸、苯丙氨酸、牛磺酸显著上调,苏氨酸、精氨酸、蛋氨酸、丝氨酸显著下调(P<0.05);肝脏赖氨酸、亮氨酸、缬氨酸、异亮氨酸、鸟氨酸、牛磺酸显著上调,甘氨酸、色氨酸、丝氨酸、酪氨酸、丙氨酸、天冬氨酸、谷氨酸显著下调(P<0.05)。最终根据VIP>1、P<0.05筛选出7种可早期诊断PQ中毒的差异氨基酸,即牛磺酸、缬氨酸、亮氨酸、苯丙氨酸、色氨酸、异亮氨酸以及蛋氨酸。见表2~3。
2.3 差异氨基酸与肝肾功能相关性分析
通过斯皮尔曼相关性分析7种差异氨基酸与SCr、BUN、ALT和AST的关系,以进一步探讨PQ中毒4 h后氨基酸代谢与肝肾功能的潜在关联。亮氨酸、色氨酸、缬氨酸、异亮氨酸、苯丙氨酸和牛磺酸与AST水平显著正相关(均P<0.05),亮氨酸、缬氨酸、异亮氨酸、苯丙氨酸及牛磺酸与ALT水平显著正相关(均P<0.05);异亮氨酸和亮氨酸与SCr显著负相关(均P<0.05),蛋氨酸仅与BUN水平呈显著正相关(P<0.01),见图2。表明PQ中毒4 h后氨基酸代谢与肝肾功能存在显著关联,差异氨基酸可能是评估肝肾功能的潜在指标。
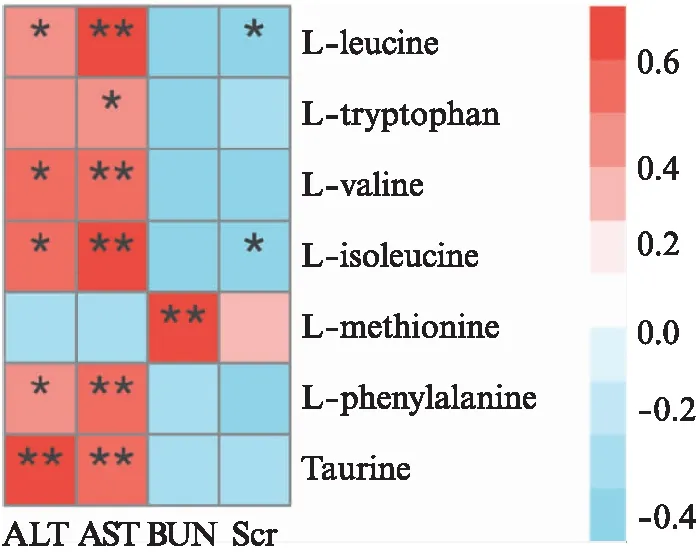
图2 差异氨基酸与PQ中毒4 h肝肾功能相关性热图Fig.2 Heat map of the correlation between amino acids and liver, kidney functions after 4 hours of paraquat poisoningL-leucine: 亮氨酸;L-tryptophan: 色氨酸;L-valine: 缬氨酸;L-isoleucine: 异亮氨酸;L-methionine: 蛋氨酸;L-phenylalanine: 苯丙氨酸;Taurine: 牛磺酸
3 讨 论
PQ中毒患者主要死于肺纤维化导致的呼吸功能不全,肝脏和肾脏也是PQ中毒早期的主要靶器官。据报道,PQ诱导的急性肾损伤可导致PQ无法及时排泄,进一步加重PQ浓度蓄积[8]。然而,Mohamed等[9-10]证实SCr并非PQ中毒后反应肾功能损伤的良好标志,应该寻求如胱抑素C、中性粒细胞明胶酶相关载脂蛋白这类更为灵敏特异的生物标志物评估肾损伤。在本研究中,PQ中毒4 h 后SCr未发生显著改变,而BUN较对照组显著降低,这可能是PQ中毒后引起小鼠消化系统功能的紊乱、厌食导致。PQ中毒48 h后BUN较对照组显著增高表明PQ中毒后肾功能的持续损害,而SCr虽有增高趋势但差异不具有统计学意义。肝脏作为人体最大的代谢器官,在机体解毒以及对抗外源性氧化物质中起到重要作用。PQ中毒引起肝损伤的主要特点是肝转氨酶的升高和组织病理学的显著改变[11]。与之前的研究一致[12],本研究PQ中毒4 h组的AST、ALT水平显著增高,虽然PQ中毒48 h组AST、ALT无统计学差异,但也表现出增高趋势,这表明PQ引起的肝脏急性损伤占主导地位,在短期内可能随着时间的延长有所波动,其具体机制有待进一步探究。
本研究通过LC-MS/MS技术检测血浆与肝脏的氨基酸代谢水平,发现PQ中毒后氨基酸代谢发生明显改变。PCA和OPLS-DA的多元统计分析显示,氨基酸可以有效区分PQ中毒4 h组与对照组。通过VIP>1且P<0.05筛选出牛磺酸、缬氨酸、亮氨酸、苯丙氨酸、色氨酸、异亮氨酸以及蛋氨酸是作为区分PQ中毒与健康对照的关键因素。
氨基酸参与多种病理生理进程,牛磺酸是一种不参与蛋白质合成的含硫氨基酸,骨骼肌中含量丰富,其主要食物来源于海鲜[13]。牛磺酸不仅可作为氧化还原稳态和骨骼肌功能的调节剂,在神经系统疾病例如帕金森、阿尔茨海默症模型中也发挥了保护作用[13-15]。在氧化应激环境下,牛磺酸可代谢成牛磺酸氯胺,进而与核因子E2相关因子1(nuclear factor E2-related factor 1, Nrf2)的抑制蛋白即Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1, Keap1)结合,随后导致与Keap1偶联的Nrf2易位到细胞核内并与各种抗氧化反应元件结合,促进各种抗氧化反应酶相关基因的编码[13]。除了在转录水平上影响氧化应激水平外,牛磺酸还可以独立于牛磺酸氯胺直接激活Nrf2合成抗氧化相关的酶[13]。蛋氨酸是合成牛磺酸的前体氨基酸,在转硫途径中降解为半胱氨酸,随后被氧化为半胱氨酸亚磺酸盐,最终在半胱氨酸亚磺酸脱羧酶的催化下分解为牛磺酸[16]。本研究发现PQ中毒4 h组血浆牛磺酸表达显著上调,而牛磺酸前体氨基酸蛋氨酸显著下调。这可能是由于PQ中毒早期氧化应激水平升高导致的牛磺酸水平代偿性增高。不难预测PQ在体内持续蓄积发生失代偿后,蛋氨酸水平会进一步减少,一方面会导致牛磺酸的耗竭,另一方面也会使机体内部抗氧化系统酶性物质(如超氧化物歧化酶)活性降低和非酶性物质(如谷胱甘肽)的减少,氧化应激水平进一步加重[17]。另外,在肝脏组织中同样发现牛磺酸水平显著增高,推测这可能是代偿性反应引起的肝脏合成增加。
色氨酸是含量最少的一种营养必须氨基酸,主要在吲哚胺2,3-二加氧酶(indoleamine 2,3-dioxygenase, IDO)的催化下经犬尿氨酸途径代谢,而IDO的活性很大程度上受到炎症因子的驱动,从而发挥免疫调节的作用[18]。在PQ中毒4 h后,色氨酸在血浆中均明显上调,其可能原因是IDO的活性在PQ环境下受到抑制,导致免疫防御功能和调控作用的减弱,在体内诱发严重的炎症反应。另外,研究中发现色氨酸和苯丙氨酸与小鼠AST、ALT活性显著正相关,色氨酸和苯丙氨酸均属于芳香族氨基酸,主要在肝脏中代谢。因此,当肝脏发生损害时可能会损害苯丙氨酸的代谢,导致苯丙氨酸在血浆中的浓度增高[19],这与本研究结果一致。
亮氨酸、缬氨酸、和异亮氨酸统称为BCAA,属于营养必须氨基酸,氧化后促进三羧酸循环和氧化磷酸化来为细胞提供能量[20]。然而有研究表明BCAA浓度过高不仅将激活NADPH氧化酶的催化亚基,还会导致线粒体功能障碍进而诱发过量ROS以及通过激活核因子κB途径来促进外周血单核细胞和内皮细胞的炎症反应和氧化应激损伤[21-22]。这些结果表明支链氨基酸有助于反应不同病理状态下的炎症过程,本研究发现,PQ中毒4 h组中血浆和肝组织的BCAA均显著增高,提示PQ中毒后BCAA浓度升高所致内皮细胞氧化应激损伤可能是肺纤维化的潜在机制[23],有待进一步研究。
既往很多报道表明补充BCAA可有效缓解慢性肝脏疾病[24-25],牛磺酸缺乏也会导致肝功能异常[26]。本研究结果显示,PQ中毒4 h后牛磺酸、BCAA与肝功能显著负相关,提示PQ导致的肝脏损害后BCAA、牛磺酸代偿性增高以缓解受损的肝功能。血浆中蛋氨酸水平与PQ中毒4 h组小鼠的BUN显著正相关,与Cooke等[27]发现在饮食上蛋氨酸限制能够表现出肾脏保护作用的结果一致,机制可能与下调炎症和纤维化有关。
综上所述,本研究筛选出牛磺酸、缬氨酸、亮氨酸、苯丙氨酸、色氨酸、异亮氨酸以及蛋氨酸等7种氨基酸,可作为早期诊断PQ中毒并评价肝肾功能的潜在生物标志物,同时也为临床早期诊治提供了新策略。然而,本研究仍存在一定的局限性。首先样本量较少,尚需进一步扩大样本量进行验证;其次是本实验仅对PQ中毒早期的氨基酸进行了检测,PQ中毒后续的氨基酸代谢如何变化以及潜在机制仍需进一步研究。
