乳腺癌患者ANXA6基因的表达及其病理意义
2021-11-04刘古月闫佩毅涂焕平冯一鸣蔡骁垚姝1
刘古月, 闫佩毅, 涂焕平, 冯一鸣, 蔡骁垚, 金 姝1,
(1. 南华大学衡阳医学院,湖南 衡阳 421001; 2. 同济大学附属普陀人民医院外科,上海 200060; 3. 同济大学附属普陀人民医院检验科,上海 200060; 4. 同济大学附属普陀人民医院病理科,上海 200060)
近年来,随着对乳腺癌病因、发病机制以及诊断和治疗的深入研究,许多学者发现乳腺癌的发生发展与自噬的形成过程存在着密切的联系。既往研究中,Wang等[2]以AHA标记技术结合mass sPectrometry方法,筛选出一个新合成的蛋白分子磷脂结合蛋白annexin A6(ANXA6)。ANXA6基因是一种钙离子依赖的膜联蛋白,通过不同的细胞类型特异性机制在不同类型的肿瘤中发挥作用[3]。Sun等[4]等的研究表明,ANXA6基因与肿瘤自噬有关。然而ANXA6基因与乳腺癌的关系较少报道,本研究通过免疫组织化学方法、RT-PCR及Western印迹法,探讨ANXA6基因在人乳腺癌组织中的表达,及其与患者临床病理特征的关系。
1 资料与方法
1.1 组织标本
2006年11月—2010年12月同济大学附属普陀人民医院收治的55例乳腺癌患者,均为女性,年龄39~86岁,平均(59.95±11.30)岁。肿瘤分期、分型参照第七版美国癌症联合委员会分期系统。入组患者术前未经化疗或放疗,且未发现其他并发肿瘤,经我院乳腺外科手术切除肿瘤。术后取肿瘤标本中癌与癌旁组织(距离肿瘤边缘至少5 cm的正常乳腺组织[5],经由病理科医师确认),放入-80 ℃冻存备用。
1.2 试剂和仪器
鼠抗人AR单克隆抗体购自基因科技(上海)有限公司;EnVision Detection System、Peroxidase/DAB+购自丹麦DAKO公司;FastKing一步法RT-PCR试剂盒购自天根生化科技有限公司;TRIzol购自美国Invitrogen公司;BCA蛋白定量试剂盒及Loading Buffer购自Cell Signaling Technology。HI1210切片机、RM2235石蜡切片机、HI1210展片机购自德国Leica公司;PCR仪S1000购自BioRAD公司;酶标仪FC购自美国热电ThermoFisher公司;超声破碎仪Q700购自美国Qsonica公司。
1.3 实验方法
1.3.1 免疫组织化学方法 化学石蜡包埋组织切片,烘干后用二甲苯脱蜡,以梯度乙醇脱水,3%过氧化氢去离子水孵育10 min,以PBS冲洗2~3次。将切片放入pH值为6.0的枸橼酸抗原修复液中抗原修复,以PBS洗涤。滴加一抗100 μL,稀释浓度为1∶200,阴性对照以磷酸盐缓冲液代替,4 ℃孵育过夜。以PBS洗涤,加入二抗100 μL,在恒温箱中静置1 h,用PBS冲洗2~3次,加入二氨基联苯胺(DAB)5~10 min,镜下观察见棕黄色颗粒,以蒸馏水冲洗终止反应。以苏木精复染2 min,盐酸酒精分化。乙醇脱水,蒸馏水冲洗,封片。
1.3.2 RT-PCR技术验证 ANXA6在乳腺癌组织及癌旁组织中的表达按TRIzol说明书提取两组乳腺癌组织及癌旁组织RNA,根据FastKing一步法RT-PCR试剂盒说明书进行RT-PCR操作,以PCR仪S1000扩增,以β-actin为内参,反应体系为50 μL,扩增条件: 42 ℃ 30 min反转录,95 ℃ 3 min预变性,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃ 5 min。引物序列(5′→3′),ANXA6上游引物: GGA-GGCCATACTGGACATAATC,下游引物: CACAG-TTCCCTTCAGCTCTAC;β-actin上游引物: CTCGC-CTTTGCCGATCC,下游引物: TCTCCATGTCGTC-CCAGTTG。
1.3.3 Western印迹法验证 ANXA6在乳腺癌组织及癌旁组织中的表达取两组乳腺癌组织及癌旁组织,加入RIPA裂解液,低温高速匀浆后冰上裂解2 h,4 ℃,12 000×g,离心5 min后吸取上清液。配制SDS-PAGE分离胶。BCA试剂盒蛋白定量,测定浓度后调整并统一上样浓度。取Loading buffer与蛋白溶液充分融合沸水浴10 min,冷却后取等量蛋白上样,SDS-PAGE凝胶电泳分离后转膜,5%脱脂奶粉封闭,室温轻摇60 min。孵育一抗,内参(1∶10 000),目的蛋白(均以1∶400稀释),4 ℃孵育过夜,孵育二抗(1∶10 000),室温轻摇40 min后以TBST洗膜。4 ℃ 平衡10 min后曝光。放入显影液显影后3 min,条带出现后放入定影液定影2 min。
1.4 统计学方法

2 结 果
2.1 ANXA6基因在人类乳腺癌组织中高表达
55例患者癌与癌旁组织中ANXA6基因的阳性表达分别为96.3%(53/55)和52.7%(29/55),差异有统计学意义(P<0.05)。ANXA6基因在癌组织中表达阳性率为(69.55±31.18)%,在癌旁组织中表达阳性率为(36.73±41.22)%,差异有统计学意义(P<0.001),两组免疫组化结果具体散点分布见图1。同时分析每例患者,发现55例患者中,ANXA6基因在癌组织中表达上调率为74.5%(41/55),下调率为20.0%(11/55)。结果提示,在大多数人乳腺癌组织标本中ANXA6基因呈现上调表达。以β-actin为内参,RT-PCR及Western印迹法结果提示两组癌组织与癌旁组织中,癌组织的ANXA6基因高表达,见图2。癌与癌旁组织免疫组化中ANXA6表达结果见图3。
特别地,当三角形ABC为等腰直角三角形时,点P为三角形ABC内部的一点,∠A=α=90°,∠B=β=45°,∠C=γ=45°.且点P到三角形ABC三个顶点A、B、C的距离分别为a、b、c,满足条件asinα+csinγ>bsinβ、bsinβ+csinγ>asinα、asinα+bsinβ>csinγ.易知:
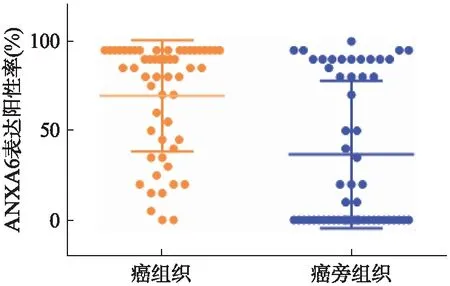
图1 ANXA6基因在癌组织与癌旁组织免疫组化中表达阳性率Fig.1 The positive rate of ANXA6 gene in immunohistoc-hemistry of cancer and para-cancerous tissues
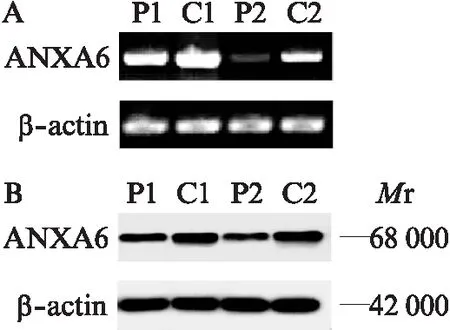
图2 RT-PCR及Western印迹法验证ANXA6在癌组织及癌旁组织中的表达Fig.2 RT-PCR and Western blotting were used to verify the expression of ANXA6 in cancer tissues andpara-cancerous tissuesA: RT-PCR验证ANXA6在癌组织及癌旁组织中的表达;B: Western 印迹法验证ANXA6在癌组织及癌旁组织中的表达;P为癌旁组织,C为癌组织

图3 ANXA6基因在人类乳腺癌组织中的免疫组化分析Fig.3 Immunohistochemical analysis of AnxA6 gene in human breast cancer利用抗ANXA6基因进行免疫反应,DAB染色(×250);A: 乳腺癌组织,B: 癌旁组织
2.2 ANXA6基因在癌组织中的表达与临床病理特征的关系
为了了解ANXA6基因表达与患者临床病理特征的关系,将55例患者按肿瘤大小、有无淋巴结转移、临床病理分期、5年生存率、年龄进行分组,分析不同组别中ANXA6基因的表达,结果显示ANXA6基因在癌组织中的表达阳性率与肿瘤大小、临床病理分期相关(P<0.05)。且将所有患者按肿瘤大小分4组(T1~T4),组间两两比较,ANXA6基因在癌组织中的表达阳性率差异统计学有统计学意义(P<0.05)。ANXA6基因在癌组织中阳性率与有无淋巴结转移、年龄、5年生存率不相关(P>0.05),见表1。
表1 ANXA6基因在癌组织中的表达与临床病理特征的关系Tab.1 The correlation between the expression of ANXA6 gene and clinicopathological features in breast cancer
55例患者癌组织中ANXA6表达上调率与肿瘤大小(χ2=8.469,P=0.004)、有无淋巴结转移(χ2=28.018,P<0.001)、临床病理分期(χ2=13.830,P<0.001)、5年生存率(χ2=26.398,P<0.001)、年龄(χ2=6.262,P=0.012)均相关(P<0.05)。
2.3 ANXA6基因在癌组织中的表达与肿瘤组织学分级的关系
乳腺癌组织学分级根据癌组织的形态特征,包括: 腺管和腺体形成,核多形性,核分裂计数进行评分,Ⅰ级为高分化(3~5分),Ⅱ级为中分化(6~7分),Ⅲ级为低分化(8~9分)。ANAX6基因在癌组织中的表达阳性率与肿瘤组织学分级(Ⅰ级: 95.00%±0.00%,Ⅱ级: 65.71%±31.79%,Ⅲ级: 79.55%±28.41%,P=0.215)不相关(P>0.05);55例患者癌组织中ANXA6表达上调率与肿瘤组织学分级(χ2=24.773,P<0.001)相关(P<0.05)。
2.4 ANXA6基因在癌组织中的表达与内分泌相关受体的关系
为了研究ANXA6与内分泌相关受体的关系,检测其与雌激素受体(estrogen receptor, ER),孕激素受体(Progesterone receptor, PR),人表皮生长因子受体2(human epidermal growth factor receptor, HER2)及雄激素受体(androgen receptor, AR)的关系。
AR在乳腺癌组织细胞核中表达阳性率高于癌旁组织[(69.27±34.49)%vs(23.82±30.70)%,P<0.001)]。ANXA6基因在癌组织中的表达阳性率与ER、HER-2、AR不相关(P>0.05),与PR相关(P<0.05),见表2。
表2 ANXA6基因在癌组织中的表达与免疫组化中ER、PR、HER-2的关系Tab.2 The correlation between the expression of ANXA6 gene and ER, PR, HER-2 in breast cancer
55例患者癌组织中ANXA6表达上调率与PR(χ2=12.004,P=0.001),HER-2(χ2=5.420,P=0.020),AR(χ2=25.204,P<0.001)相关(P<0.05),与ER(χ2=1.232,P=0.267)不相关(P>0.05)。
2.5 ANXA6基因在癌组织中的表达与肿瘤自噬相关蛋白的关系
为了探究ANXA6基因与肿瘤自噬的相关性,检测ANXA6基因与肿瘤组织中自噬相关蛋白,微管相关蛋白轻链3蛋白B(microtubule-associated proteins light chain3B, LC3B)、泛素结合蛋白(P62)及转录因子EB(transcription factor EB, TFEB)的关系。本实验检测了不同自噬标志物在癌与癌旁组织中的表达,结果提示其在癌组织中表达高于癌旁组织中且差异均有统计学意义,见表3、图4~6。

图4 LC3B基因在人类乳腺癌组织中的免疫组化分析Fig.4 Immunohistochemical analysis of LC3B gene in human breast cancer利用抗LC3B进行免疫反应,DAB染色(×250);A: 乳腺癌组织,B: 癌旁组织
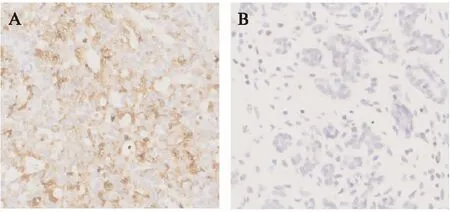
图5 P62基因在人类乳腺癌组织中的免疫组化分析Fig.5 Immunohistochemical analysis of P62 gene in human breast cancer利用抗P62进行免疫反应,DAB染色(×250);A: 乳腺癌组织,B: 癌旁组织
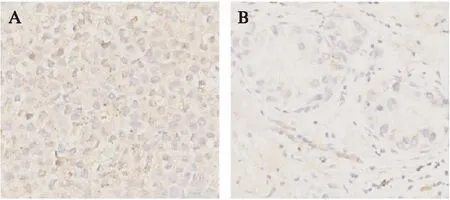
图6 TFEB在基因在人类乳腺癌组织中的免疫组化分析Fig.6 Immunohistochemical analysis of TFEB gene in human breast cancer利用抗TFEB进行免疫反应,DAB染色(×250倍)利用抗P62进行免疫反应,DAB染色(×250);A: 乳腺癌组织,B: 癌旁组织
表3 癌组织及癌旁组织中自噬相关蛋白的表达阳性率Tab.3 The positive rate of autophagy-related proteins in cancer tissues and para-cancerous tissue
ANXA6基因在癌组织中表达阳性率与LC3B(r=0.313,P=0.020)、TFEB(r=0.295,P=0.029)相关(P<0.05),与P62(r=0.233,P=0.087)不相关(P>0.05)。
癌组织中ANXA6基因表达上调率与TFEB(χ2=6.110,P=0.013)相关(P<0.05),与LC3B(χ2=0.428,P=0.513)、P62(χ2=0.015,P=0.903)不相关(P>0.05)。
3 讨 论
尽管目前乳腺癌的发病机制及治疗手段研究较为深入,但乳腺癌的发病率依旧跃居全球恶性肿瘤发病率的第1位。因此,需要进一步寻找乳腺癌的早期诊断方法及新的治疗靶点。ANXA6基因属于高度保守的磷脂膜蛋白结合蛋白家族,它是膜联蛋白中最大的,在内皮细胞、肝细胞、心肌细胞内均有表达,而活化后的ANXA6基因与晚期内体带负电的磷脂分子结合,促进细胞内吞[6]。Sun等[4]的研究证明在宫颈癌中敲除ANXA6基因,可抑制饥饿诱导的自噬(autophagy),恢复ANXA6基因表达可增强自噬。但其在肿瘤中的作用尚有争议。
本研究检测了55例乳腺癌患者癌组织与癌旁组织中ANXA6基因的表达情况,结果显示ANXA6基因在癌组织中表达阳性率明显高于癌旁组织(P<0.05),且ANXA6基因的阳性表达率与肿瘤大小,临床病理分期相关,肿瘤体积越大,临床病理分期越晚,ANXA6基因呈高表达,推测ANXA6基因可能与乳腺患者的预后不良有关,本研究中ANXA6基因的表达与淋巴结转移无关,但其与依据肿瘤大小、淋巴结转移、远处转移共同决定的临床病理分期相关,考虑这一结果可能因此次研究入组样本量较小,若后期研究加大样本量,或可进一步明确其与淋巴结转移的关系。而ANXA6基因的表达与组织学分级无关,其与癌组织分化程度的关系目前尚未见相关报道,需进一步研究证实。随着乳腺癌研究的不断深入,其5年生存率也不断提高,因此,此次研究中ANXA6基因与患者的5年生存率不相关可以预见。另外,对55例患者各自的癌组织与癌旁组织阳性表达率进行比较,得出每个患者的ANXA6基因表达上调率,结果提示,ANXA6基因癌表达上调率与肿瘤大小、临床病理分期、有无淋巴结转移、组织学分级均有关,推测ANXA6基因癌表达上调率与癌表达阳性率结合,可能更准确评估乳腺癌患者的预后。
目前关于ANXA6基因在恶性肿瘤中的作用尚有争论。有研究表明,ANXA6基因曾被用于宫颈癌的潜在标志物,该研究证明ANXA6基因与宫颈癌的恶性程度及肿瘤进展有关。ANXA6基因过度表达于宫颈鳞状细胞癌,此现象在其N末端尤为明显[7-8]。该研究结果与本次研究中ANXA6基因在乳腺组织中高表达结果基本一致。但也有研究表明,ANXA6基因在三阴性乳腺癌中存在潜在的肿瘤抑制作用,与非三阴性乳腺癌相比,三阴性乳腺癌中ANXA6基因表达水平较低且Ki-67表达水平较高,而ANXA6基因的低表达与短期无复发生存显著相关[3]。目前针对ANXA6基因在乳腺癌中的表达及其对于肿瘤的作用报道较少且尚无一致结论。
本研究分析了ANXA6基因在癌组织中的表达阳性率和上调率,并比较了两者与ER、PR、HER-2及AR的相关性,结果提示: ANXA6基因表达阳性率与ER、HER-2、AR不相关,与PR相关,上调率与ER不相关,与PR、HER-2、AR相关。PR位于ER通路下游,是雌激素与ER结合诱导产生的,PR的表达可反映ER功能的完整性,针对ER阴性且PR阳性的乳腺癌病例较为少见,且经重新检测后,有至少94%的患者结果发生改变[9]。因此,对于ER和PR表达与ANXA6基因相关不一致尚无定论,且目前关于ANXA6基因与ER、PR、HER-2相关性的报道较少。另有研究显示,乳腺患者中有60%~80%为AR阳性,而AR的表达与患者预后有关,AR阳性患者较阴性患者总生存期及无进展生存期延长[10]。本研究随访时间为5年,目前无ANXA6基因与5年生存率相关的依据。
自噬是通过溶酶体降解细胞内错误折叠的蛋白质和损伤的细胞器,循环营养成分,使细胞内环境保持稳定的过程,是在真核细胞中普遍存在的“自我吞噬”现象[11]。研究表明,自噬对肿瘤具有双向调节作用。在肿瘤发生的早期,自噬能清除受损的细胞器,促进营养物质的循环,抑制肿瘤的发生。而在肿瘤进展过程中,自噬可通过帮助肿瘤细胞抵抗营养缺乏、缺氧等不利因素,产生能量,提供代谢物质,从而保护肿瘤细胞,使其继续存过,促进肿瘤发展[12]。LC3是哺乳动物中酵母Atg6的一种同源物,参与自噬的整个过程,是目前最常用的自噬标志物。既往研究证明,敲除乳腺癌细胞中的LC3,可抑制自噬,细胞增殖和集落形成被显著抑制[13]。而LC3B作为LC3的一个亚型蛋白,也是自噬相关蛋白,它可以反映自噬的动态过程,LC3B的增加即自噬体增加,提示自噬处于活动期[14]。TFEB是一种转录调节因子,属于小眼症/转录因子E家族中一员,有螺旋-环-螺旋-亮氨酸拉链结构,通过激活自噬及溶酶体途径在肿瘤的发生发展中起重要作用[15]。已有研究表明,TFEB的表达失调在乳腺癌、肾癌、黑色素瘤等多种恶性肿瘤中有重要的致病作用[16]。P62是一种自噬受体,在选择性自噬中[17],作为自噬底物被降解,随着自噬活性的增强,P62减少,因此,P62与自噬活性呈负相关[18]。提示了LC3B、P62作为自噬标志蛋白与转录因子TFEB在自噬中的重要作用。本研究对比了ANXA6基因与自噬相关蛋白LC3B、P62、TFEB的相关性。结果显示ANXA6基因在癌组织中表达阳性率与LC3B、TFEB相关,且其上调率与TFEB相关。这一结果与以往研究相符,也进一步证实了ANXA6基因与肿瘤自噬有关。而在本研究中ANXA6基因的表达阳性率与P62的表达不相关,上调率与LC3B及P62不相关。目前,ANXA6基因与乳腺癌自噬的关系尚无一致结论。
综上所述,ANXA6基因在乳腺癌中的阳性表达可能成为乳腺癌的辅助诊断依据,进一步研究ANXA6基因诱导的自噬在乳腺癌中的机制,可能为揭示乳腺癌的发生发展规律及为新的抗肿瘤药物寻找新的治疗靶点提供依据。
