无患子叶斑病病原菌鉴定及其生物学特性
2021-11-04郑婉铮林先云陈全助冯锦秀冯丽贞
郑婉铮,孙 宇,林先云,陈全助,冯锦秀,蔡 琦,冯丽贞*
(1.福建农林大学林学院,福州 350002;2.顺昌县林业局,福建顺昌 353200;3.福建农林大学金山学院,福州 350002)
无患子(Sapindus mukorossi)别名黄金树、肥皂树等,属无患子科(Sapindaceae)无患子属(Sapindus)[1],落叶乔木,广泛分布于我国南方。无患子用途较多,具有很高的实用价值。其树形美观,木质坚硬厚重,既可用于制作各种家具及雕刻,又可作为行道树和庭园荫树[2-3];其果皮、果实及茎中含有黄酮类化合物、脂肪酸等,不仅是天然活性香料,也有抗病毒、免疫调节和镇痛等药效[4-6];且果皮表面的活性成分倍半萜糖苷类和三萜皂苷类,是天然的活性剂,去污力强,天然无公害,已运用至医疗及日常生活中的多个领域[7-8]。在顺应绿色发展的时代潮流下,无患子作为天然的洗护珍果,其生产发展具有广阔前景[9]。
由于大面积纯林种植,林分结构单一,林分抗逆性差,以致无患子病害频繁暴发。受害植株叶部干枯,甚至提早脱落,影响植株光合作用,产量急剧下降,严重影响经济效益,成为限制无患子产业发展的重要因素。目前对于无患子的病害研究大都集中在煤污病、黑星病、炭疽病、枯萎病和溃疡病[10-13]。有鉴于此,本研究以福建省顺昌县受害无患子人工林基地采集的病样组织为研究对象,通过组织分离法、致病性测定、形态学鉴定及分子生物学鉴定,确定无患子叶斑病病原菌种类,在此基础上探究病原菌生物学特性,研究结果将为无患子叶斑病的科学防治提供依据。
1 材料和方法
1.1 菌株的分离培养与纯化
用组织分离法[14]对菌株进行分离。采集具有典型叶斑病症状的无患子叶片,用无菌手术刀剪取病健交接处3 mm×3 mm的叶部组织,先用75%的酒精消毒30 S,5%的次氯酸钠消毒2 min,再用无菌水漂洗4次,并置于灭菌纸上干燥后,接种至PDA培养基上28℃培养箱中黑暗培养。待叶片长出菌丝时,挑取菌落边缘的菌丝至PDA培养基进行多次纯化。
1.2 致病性测定
接种分为有伤接种和无伤接种,接种前将无患子离体叶片用75%的酒精进行消毒,无菌水洗脱酒精后将叶片分为两组。一组采用针刺法,采用无菌针头针刺4~5个相邻的孔,取0.6 cm的菌饼接种在伤口处。另一组直接将0.6 cm的菌饼接种至无损伤叶片,以空白PDA菌饼为对照,置于25℃培养箱中保湿培养,逐日观察记录,每处理5个重复。取接种发病后的部位进行组织分离并镜检观察。
1.3 形态学鉴定
菌落形态特征观察:将病原菌接种至PDA培养基上,黑暗条件下28℃恒温培养,逐日观察培养皿内菌落的形态特征。
菌落显微特征观察:将病原菌接种至综合PDA培养基[14](马铃薯200 g取汁,葡萄糖20 g,磷酸二氢钾 3 g,硫酸镁1.5 g,水 1 000 mL)上,置于黑光灯下24 h不间断照射,诱导子座产生后,观察子座特征及产孢结构等形态特征。
1.4 分子生学物学鉴定
参照真菌DNA提取试剂盒(E.Z.N.A.SP Fungal DNA mini kit)说明书提取病原菌DNA,ITS序列扩增引物采用ITS1/ITS2,PCR反应体系:98℃预变性3 min;98℃变性 10 s,58℃退火 15 s,72℃延伸30 s,34个循环;72℃再延伸10 min。测序工作委托福州白鲸生物科技有限公司完成。结合所得ITS序列的BLAST比对结果,选择参比序列。ITS序列的系统亲缘关系通过CLUSTAL-X软件校正,MEGA7软件完成系统发育树的构建。
1.5 生物学特性研究
1.5.1 不同培养基对菌落生长的影响
供试的7种培养基分别为PDA、PSA、Czapek、Bilays、WA、黄豆和淀粉琼脂[15],将病原菌接入不同培养基中央后25℃下暗培养7 d,菌落测量方法采用十字交叉法,各处理3次重复。
1.5.2 不同碳、氮源对菌丝生长的影响
碳源真菌生理培养基:碳源5 g,硝酸钠1 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,琼脂17 g,水1 000 mL。将碳源等量替换成葡萄糖、果糖、麦芽糖、蔗糖、乳糖、甘露醇和可溶性淀粉,将病原菌接入不同碳源培养基中央后25℃下暗培养7 d,菌落测量方法采用十字交叉法,各处理3次重复。
氮源真菌生理培养基:氮源1 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,葡萄糖5 g,琼脂17 g,水1 000 mL。将氮源等量替换成硝酸钾、氯化铵、硝酸钠、酵母膏、磷酸氢二钾、蛋白胨、硝酸钙、牛肉浸膏,培养方法与统计方法同上。
1.5.3 温度对菌丝生长的影响
设置 5、10、15、20、25、28、30 和 35 ℃共 8 个不同温度梯度,将病原菌接入PDA平板中央后分别置于上述不同温度培养箱中暗培养7 d,菌落测量方法采用十字交叉法,各处理3次重复。
1.5.4 pH值对菌丝生长的影响
用1 mol/L的氢氧化钠及盐酸溶液调整PDA培养基 pH 值至 5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0 和13.0等9个不同pH值梯度,将病原菌接入不同pH值的培养基平板中央后,25℃下暗培养7 d,菌落测量方法采用十字交叉法,各处理3次重复。
1.5.5 光照对菌丝生长的影响
3种光照条件分别为全光照、12 h光暗交替和全黑暗。将病原菌接入PDA平板中央后,不同光照条件下25℃培养7 d,菌落测量方法采用十字交叉法,各处理3次重复。
1.5.6 菌丝致死温度测定
致死温度分别设置为 37、40、45、50和 55 ℃,取病原菌菌饼置于加入无菌水的2 mL的离心管中,各温度梯度水浴10 min后接种到PDA平板中25℃暗培养7 d,菌丝是否生长分别用符号“+”和“-”表示,各处理3次重复。
1.6 数据处理
数据统计分析在Microsoft Excel 2017和SPSS 19.0中完成,经多重比较分析不同条件下菌落生长影响的相关性,显著水平设置为P=0.05。
2 结果与分析
2.1 病害症状
对具有典型症状的无患子叶斑病观察发现,该病害主要为害无患子叶片,患病初期该部位出现黄褐色斑点,后逐渐向外扩展,形成不规则的淡褐色或深褐色的病斑,病斑上常伴有黑色小点(图1A),潮湿条件下会产生黑色墨汁状液体(图1B)。
2.2 病原菌分离及致病性测定
通过组织分离法共分离出9种菌株,命名为SW-1、SW-2、SW-3、SW-4、SW-5、SW-6、SW-7、SW-8、SW-9,用离体接种对分离到的9种菌株进行致病性测定。结果发现,接种SW-9菌饼的无患子叶片在有伤接种与无伤接种的情况下均能产生黄褐色不规则病斑(图1C、1D),其余8种菌株进行无伤接种及有伤接种后都无典型病斑。利用组织分离法对发病叶片进行再分离、纯化,获得菌株与原始菌株一致,完成柯赫氏法则,表明SW-9为致病菌株。
2.3 形态学鉴定
菌落在PDA培养基28℃培养7 d后,菌落平均直径5.72 cm,菌落近圆形;气生菌丝呈白色,绒毛状平铺(图2A、图2B)。培养15 d后,菌落铺满培养皿,菌落中心产生炭黑色色素,菌落背面呈淡黄色,并带有黑色晕圈。培养30 d后,菌落呈炭黑色,部分表面革质化,菌落背面无变化(图2C、图2D)。在综合PDA固体培养基上培养30 d可形成子座,子座不分枝或者分枝,圆柱形,高约0.5~2 cm;表面黑色、光滑;内部白色(图2E);分生孢子器椭圆形,孔口稍微凸起,长83.49~114.28μm,宽45.93~57.62μm(图2F);孢子椭圆状;单孢;光滑;不等边至稍等边;长 7~8 μm,宽 3~4 μm(图 2G)。
2.4 分子生物学鉴定
通过NCBI的BLAS在线工具对SW-9的ITS序列进行比对,SW-9的ITS序列与Xylaria arbuscula(JQ761007)的一致性为99.64%。为验证其准确性,进一步进行系统进化聚类分析,结果表明,SW-9与Xylaria arbuscula聚在同一分支,与其他种亲缘关系较远。结合形态学特征和进化分析,将菌株SW-9鉴定为Xylaria arbuscula。将其ITS序列提交至 GeneBank,获得序列登录号为 MK747250。
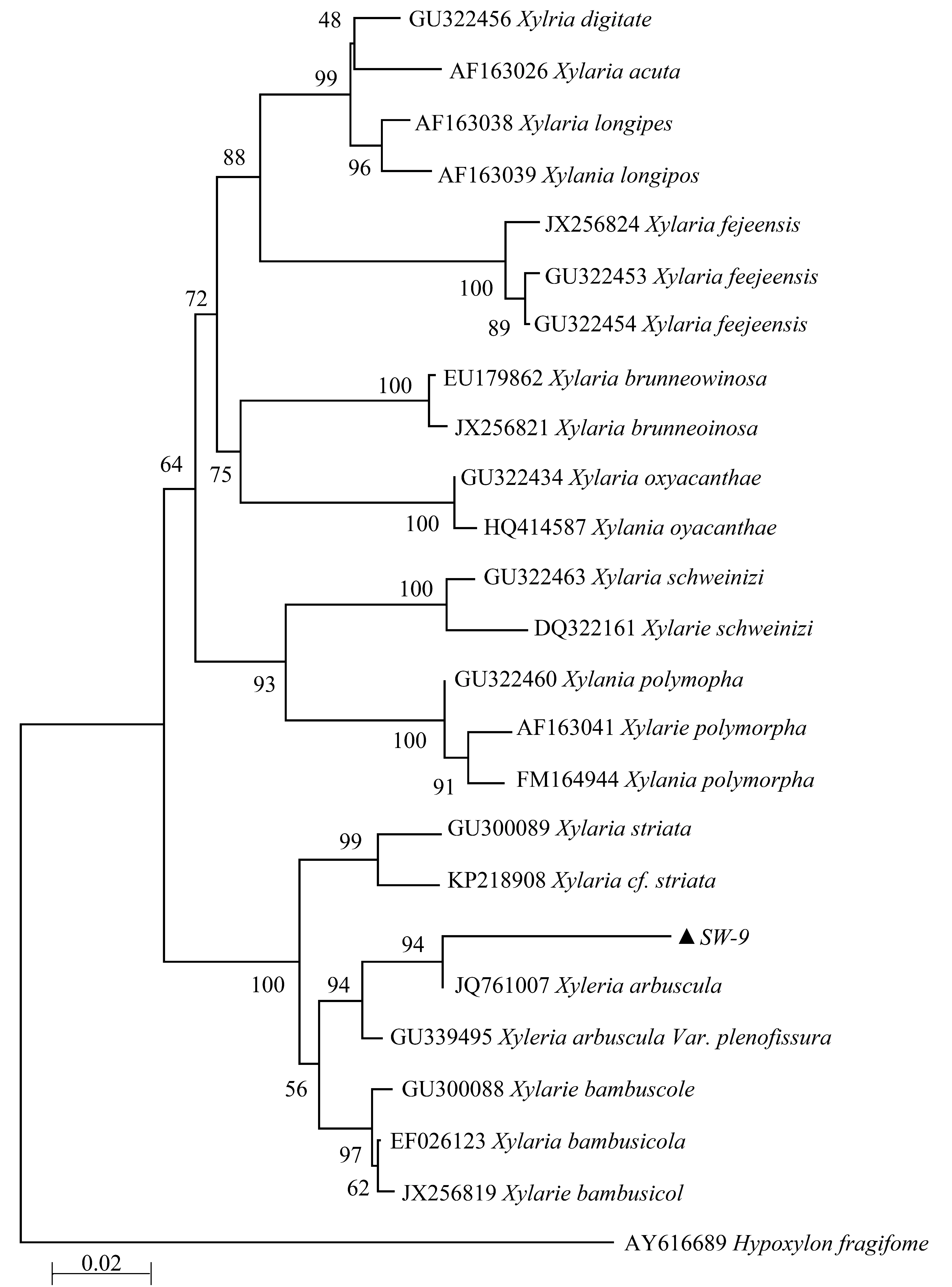
图3 基于ITS序列和邻接法构建系统发育进化树Figure 3 Phylogenetic tree constructed by neighbor-joining analysis of ITS gene sequences of Xylaria arbuscula isolates
2.5 生物学特性研究结果
2.5.1 不同培养基对菌落生长的影响
该病原菌菌丝在不同培养基上生长速度和菌落特征差异较大(见图4)。菌落在PDA生长最好,菌丝浓密,呈绒毛状;其次为Czapek及PSA培养基,菌落特征与在PDA上的生长状态相似,但菌落生长速度较慢;在淀粉琼脂培养基上,菌丝较稀疏;在Bilays培养基上菌丝浓密,但生长速度缓慢;在WA及黄豆培养基上,菌落生长稀疏且缓慢。

图4 不同培养基对菌落生长的影响Figure 4 The effect of different culture media on mycelial growth of Xylaria arbuscula
2.5.2 不同碳、氮源对菌落生长的影响
不同碳、氮源对病原菌菌丝生长的影响差异显著,结果见图5、图6。在碳素营养中,菌丝对麦芽糖利用效果最好,其次为葡萄糖、果糖、可溶性淀粉,对甘露醇、蔗糖、乳糖的利用率低。在氮素营养中,以蛋白胨、酵母膏、牛肉浸膏的利用效果好,其次为硝酸钙、硝酸钾,对氯化铵及硝酸钾利用率较低。

图5 不同碳源基对菌落生长的影响Figure 5 The effect of carbon resources on mycelial growth of Xylaria arbuscula

图6 不同氮源基对菌落生长的影响Figure 6 The effect of nitrogen resources on mycelial growth of Xylaria arbuscula
2.5.3 不同温度对菌落生长的影响
由图7可见,不同温度条件对病菌菌丝生长影响显著。病原菌在5~35℃内均能生长,最适温度为28℃,培养7 d后的菌落直径为6.16 cm,最适温度区间为25~30℃,在5~15℃范围内生长缓慢,不利于病原菌生长。

图7 不同温度对菌落生长的影响Figure 7 The effect of temperature on mycelial growth of Xylaria arbuscula
2.5.4 不同pH对菌落生长的影响
结果如图8所示,在pH 5~13范围内该病原菌均可生长,偏酸性条件下生长状况较好,最适生长的pH范围是6~7,7 d后菌落直径分别为5.72 cm和5.99 cm。

图8 不同pH值对菌落生长的影响Figure 8 The efffect of pH on mycelial growth of Xylaria arbuscula
2.5.5 不同光照对菌落生长的影响
根据图9中3种不同光照条件处理的菌落生长状况来看,24 h全黑暗条件下菌落生长相对较快,菌落直径为5.69 cm。24 h全光照与12 h/12 h光暗交替条件下菌落直径分别为5.58 cm、5.63 cm。
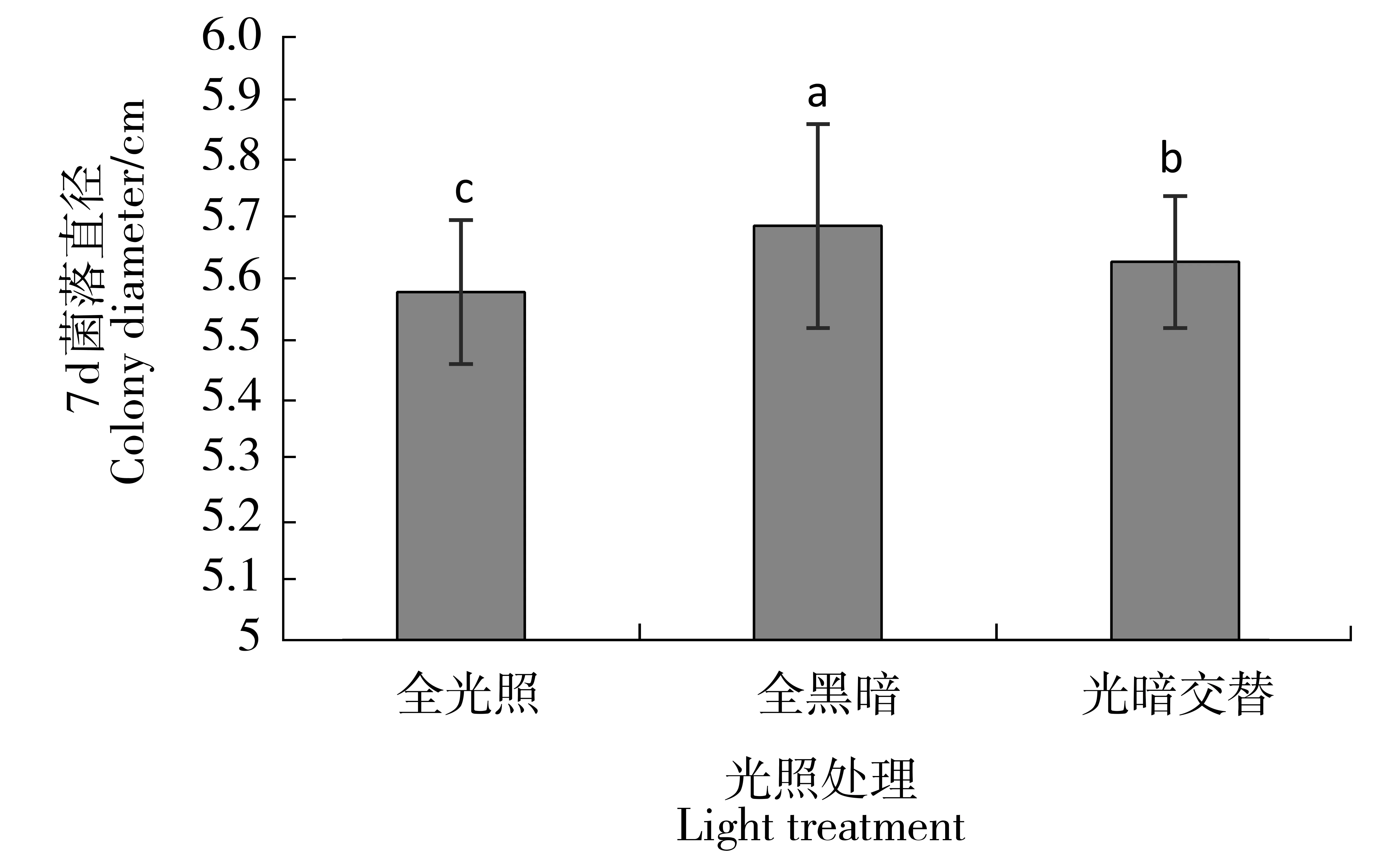
图9 不同光照条件对菌落生长的影响Figure 9 The effect of light on mycelial growth of Xylaria arbuscula
2.5.6 菌丝致死温度测定
对该病原菌菌丝致死温度测定的结果见表1,40℃以上菌丝均不能生长,因此该病原菌的致死条件为40℃、10 min。

表1 菌丝致死温度测定Table 1 The mycelial growth temperature of Xylaria arbuscula
3 讨论与结论
炭角菌属Xylaria是1789年Hill ex Schrank建立的[16],隶属于真菌界子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)炭角菌目(Xylariales)炭角菌科(Xylariaceae)[17],炭角属是炭角菌科中最大的属,为该科的模式属,全球有300余种[18],目前,在中国有124种1变种1变型[19]。炭角菌的生境较广,可生于木头、粪便、杂物、植物种子、果实或叶片上,部分种类生于昆虫巢上[20-21]。炭角菌属有些种类是重要的植物病原菌,可造成重大经济损失,例如,由Xylaria buscula[22]引起的澳洲坚果溃疡病、Xylaria mali[22]引起的苹果根腐病,以及Xylaria pedunculata[23-24]在鸡腿菇等食用菌栽培中引起的病害,该菌生于栽培食用菌的覆土层上,对食用菌的栽培危害很大,轻者减产,重者造成绝收。关于Xylaria arbuscula引起的无患子叶斑病为首次报道。
通过对无患子叶斑病病原菌(Xylaria arbuscula)生物学特性研究发现,该菌生长的温度范围较广,酸碱度的适应能力较强,光照条件对该菌的生长影响较小。在添加不同氮源的培养基中,菌丝生长旺盛,表明该菌能够较好地利用有机氮源。最有利于该菌菌丝体生长的碳、氮源分别是麦芽糖、葡萄糖和蛋白胨、酵母膏、牛肉浸膏,最适生长培养基为PDA、Czapek及PSA培养基,且在综合PDA上经黑光灯照射下能较快产生子座,显示该菌对综合营养的需求较高。
无患子叶斑病导致受害植株病叶容易脱落,病叶易随着风或雨传播,导致附近植株或整个种植区感染,不断扩大叶斑病发生面积。而该病原菌(Xylaria arbuscula)适应生长的温度范围广,对各pH值的适应能力强,因此,应对修剪病叶及落叶及时处理,冬季清园,避免病原菌顺利越冬,来年继续造成侵染。后续可在室内筛选有效的化学药剂,结合科学的营林措施,通过综合防治策略,有效防止无患子叶斑病,进而有效保证无患子的质量和产量。
