水淹胁迫对35/66杨和NL-80351杨幼苗生理特性的影响
2021-11-04谭灵杰陈良华朱珍珍杨林凯
柳 奇,谭灵杰,陈良华,朱珍珍,舒 锟,杨林凯,雷 浩
(长江上游林业生态工程四川省重点实验室/长江上游森林资源保育与生态安全国家林业和草原局重点实验室/华西雨屏区人工林生态系统研究长期科研基地/四川农业大学生态林业研究所,成都 611130)
水淹胁迫是河岸带和地势低洼地带影响植物生长、发育和生产力的重要因素之一。水淹胁迫对植物生理的负面影响是多方面的:通常条件下,水淹将导致植物根系的氧气供应减少,使根系处于缺氧状态,根系有氧呼吸受到抑制[1],无氧呼吸加强,产生乙醇、乙醛等有毒物质[2],增加根系细胞的膜脂过氧化程度,引发氧化胁迫伤害;水淹会导致植物细胞膜渗透性增加、叶绿素降解和气孔关闭[3],降低碳同化速率,加速植物叶片衰老、凋落,抑制植物的生长发育和生产力的形成;无氧呼吸产生的乙醇以及土壤还原性反应(如反硝化反应)的增强会导致植物根系产生并积累大量的有毒、有害物质,降低植物根系的活力,引发根系吸收功能障碍,降低根系对水分和养分的吸收能力,导致根系供水、供肥能力下降,引起植物矿质营养亏缺。植物能够通过调节形态生长和生理代谢过程适应水淹胁迫环境,如形成肥大的皮孔、通气组织和不定根,增加组织孔隙度和渗漏氧[4],促进根部O2的供应和矿质营养的同化作用;启动无氧呼吸和抗氧化调节机制等方式维持植物的生理代谢平衡。
美洲黑杨(Populus deltoides)自1972年从意大利成功引种,已在我国长江中下游地区、江汉江淮平原和华北平原大规模地繁育推广和造林应用,在区域木材供给、生态防护和促进林业产业发展方面发挥着不可替代的作用。美洲黑杨具有生长快、材质好、适应性强和经济效益高等优点,具有良好的耐水湿特性,现已成为江河沿岸、季节性淹水滩地和“退田还湖”区营建防护林及生态公益林的优良备选材料。35杨和NL-80351杨是该区域应用栽培最广的品种之一。35杨(P.deltoides CL35/66),雄株,意大利Calale Monferrato杨树研究所选育的美洲黑杨自由授粉后代,1986年引入我国;NL-80351杨(P.deltoides cv.NL-80351),雌株,是从I-69杨(P.deltoides Bartr.cv.Lux)×I-63 杨(P.deltoides Bartr.cv.Harvard)的杂交F1代中选育出来的用材林新品种。35杨生长迅速,其胸径和树高的年生长量分别可达7 cm和5.8 m,干形圆满、出材量大、材质良好,具有较强的抗病虫性。NL-80351杨无性系的胸径和树高的年生长量分别超过4.0 cm和4.0 m,干形圆满通直、尖削度小、分枝角度小、冠幅较窄、抗性强[5-6],在江苏、浙江和河北等地广泛栽培应用。两个美洲黑杨无性系品种应用推广的区域均是地势平坦且容易受季节性洪涝灾害影响的长江中下游地区和江淮地区,但很少有学者关注这些主栽品种间的水淹耐受性差异和相关的生理机制。
已有的研究从生长、生理和分子机制等方面比较了美洲黑杨与其他杨树物种之间[7-9]、美洲黑杨不同杂交子代无性系[10-13]、不同性别[14]以及品种间的水淹耐受性差异。这些研究结果发现不同美洲黑杨材料对水淹胁迫具有广泛的遗传变异,水淹条件下不定根和通气组织的形成、碳同化能力的维持、水势的稳定、活性氧的清除并保持细胞结构的完整性对水淹条件下美洲黑杨的存活和生长起着关键作用。这些研究很少关注水淹条件下非结构性碳水化合物(non-structural carbohydrates,NSC)在美洲黑杨不同器官和不同根级间的分配,也很少有研究关注水淹条件下叶片氮代谢这一关键生理过程受到的影响。因此,本研究以广泛应用栽培的35杨、NL-80351杨为对象,研究水淹胁迫和正常生长状态下的不同品种在生物量积累与分配、非结构性碳水化合物的转移与分配、抗氧化酶活性、氮代谢酶活性的响应特征,分析水淹胁迫对两个品种杨树生长及生理特征的影响,比较它们对水淹胁迫的适应性差异,为美洲黑杨适生区易受水涝影响区域主栽品种的选择和定向育种亲本的选择提供理论依据。
1 材料和方法
1.1 实验材料及设计
供试材料为35杨和NL-80351杨1a生枝条扦插苗,枝条采自江苏省镇江市京口区共青团农场种质资源圃。将塑料袋套在聚乙烯圆台型花盆中(直径30 cm,深度35 cm),装入15 kg匀质土壤,设置5个不套塑料袋盆,装入等重的土壤。试验用土采自四川农业大学成都校区附近的农田表层土(0~30 cm),土壤类型为水稻土(pH 7.6,有机质10.1 g/kg,铵态氮 3.3 mg/kg,硝态氮 0.2 mg/kg,有效磷 37.7 mg/kg,有效钾11.5 mg/kg)。2019年4月上旬,将健康的1年生枝条剪成15 cm的节段,每盆扦插一节,每个节段保留1个芽露出土壤表面。7月初,每个品种选择30株长势一致的健康幼苗(25 cm左右)用于实验处理。本实验的实验设计为2个品种和2个水分处理(即对照和水淹)的完全随机实验设计,共4组处理,每组15株幼苗(即5个重复,每个重复3株)。对照组进行常规的水分管理,保证其正常生长。水淹组的水位高于幼苗基部5 cm,每天定时补水,维持淹没的水位。实验处理在四川农业大学成都校区进行,苗木放置于仅遮蔽雨水的大棚中处理,处理时长为30 d。
1.2 指标测定
水淹胁迫处理结束后,每组处理随机选取5株幼苗测定生物量。收获地上部分,分为叶和茎两种器官。取出所有根系并尽量保持完整,用清水清洗根系,清洗后的根系样品按照K.S.Pregitzer等[15]的方法把根系进行分级,最先端的根定为1级根,1级根的母根为2级根,2级根的母根为3级根,一直分至6级。1级和2级在形态结构、生理和代谢活性上非常相似,故把1~2级混合一起后进行研究。所有样品经105℃杀青30 min,烘干至恒重后称重。计算总生物量、根冠比以及各级根占总根的百分比。将所有烘干的样品磨碎后过100目筛,细粉用于NSC含量的测定。
每处理随机选择5株幼苗,取下顶端第3片完全展开叶片,将其保存于液氮后储藏于-70℃冰箱中,用于丙二醛(MDA)、抗氧化酶活性、氮代谢相关酶活性的测定(以上指标均采用鲜重计算)。
葡萄糖、蔗糖和淀粉含量的测定参照L.Camisón[16]和Yang B.[17]等的方法,MDA含量测定参照Li G.等[18]的方法,超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性参照Fan Y.等[14]的方法测定,硝态氮、铵态氮含量和硝酸还原酶(NR)活性、谷氨酰胺合成酶(GS)活性、谷氨酸合酶(GOGAT)活性、谷氨酸脱氢酶(GDH)活性的测定参照F.Horchani[19]和Gao S.等[20]的方法。
1.3 数据处理
本试验采用Microsoft Excel 2013进行数据整理及作图,在SPSS 25.0统计软件中对数据进行单因素方差分析(one-way ANOVA),并用 Tukey法(P20.05)进行处理间差异显著性检,杨树品种、水淹处理及其交互作用对参数影响的显著性采用双因素方差分析进行检验。
2 结果与分析
2.1 水淹胁迫对两个品种美洲黑杨生物量积累与分配的影响
植物的生物量是反映植物生长状况和适应环境能力最直观的指标。正常生长条件下,两个品种的杨树幼苗生物量无显著差异,与各自对照相比,水淹处理并没有显著影响两个品种杨树的叶、茎和总生物量,但显著降低了它们的根生物量和根冠比,35杨和NL-80351杨根系生物量分别下降61.73%和75.06%,根冠比分别下降62.86%和81.08%。
双因素方差分析结果表明(表1),品种作为独立因子对叶、茎生物量、总生物量和根冠比的影响不显著,对根系总生物量影响显著;水分作为独立影响因子对杨树叶生物量、总生物量影响不显著,对茎生物量影响显著,对根系生物量、根冠比影响极显著;品种和水淹处理的交互效应对叶、茎、根、总生物量和根冠比均无显著影响。可见,35杨和NL-80351杨的根系生长受到水淹的影响最为明显,且NL-80351杨受到的影响更大。
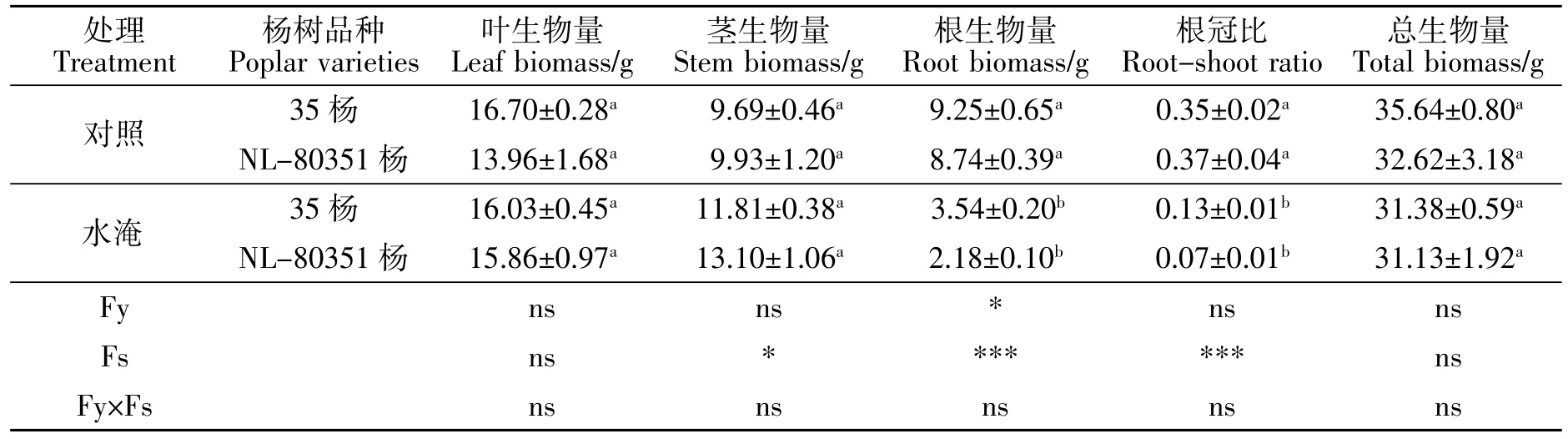
表1 水淹胁迫对35杨和NL-80351杨幼苗生物量积累与分配的影响(平均值±标准误)Table 1 Effects of waterlogging stress on seedling biomass accumulation and allocation of Poplar 35 and Poplar NL-80351 (mean±SE)
2.2 水淹胁迫对两个品种美洲黑杨各级根系生物量及分配比例的影响
水淹胁迫条件下,35杨的5、6级根生物量分别降低了68.80%和76.22%,NL-80351杨3~6级根生物量分别降低了55.32%、74.66%、83.15%和78.68%。与对照相比,水淹胁迫引起两品种杨树1~3级根生物量占比增加,6级根的生物量占比下降,35杨的这种差异更为明显(图1)。对照条件下,35杨1~4级根的占比均小于NL-80351杨,但在淹水条件下,两者1~4级根的比例大致相当。

图1 水淹胁迫下35杨、NL-80351杨植株各级根系分布百分比Figure 1 The root distribution percentage of all levels of Poplar 35 and Poplar NL-80351 under waterlogging stress
由表2可知,品种作为独立因子对1~3级根和5级根生物量影响不显著,对4级根、6级根生物量影响极显著;水分作为独立因子对1~3级根生物量影响不显著,对4~6级根生物量影响极显著。品种和水分交互效应对1~2级根生物量影响不显著,对5、6级根生物量影响显著,对3、4级根生物量影响极显著。由此可见,水淹条件下,35杨和NL-80351杨低级根未受到明显影响,水淹胁迫主要影响较高级别根系生物量的积累,从而导致其根系总生物量降低,同时也导致各级根系占比表现出一定的差异。

表2 水淹胁迫对35杨和NL-80351杨幼苗各级根系生物量的影响(平均值±标准误)Table 2 Effects of waterlogging stress on root biomass of seedlings 35 and NL-80351 at all levels(mean±SE)
2.3 水淹胁迫对35杨、NL-80351杨植株葡萄糖、蔗糖、淀粉含量的影响
水淹胁迫对35杨和NL-80351杨植株葡萄糖、蔗糖、淀粉含量及其分布情况产生了一定的影响。如图2所示,与各自对照相比,水淹处理并没有显著影响两个品种3级、5级和6级根中葡萄糖的含量。水淹处理显著增加了35杨茎和4级根葡萄糖的含量,增幅为30.06%和112.39%;水淹胁迫条件下NL-80351杨茎葡萄糖含量下降,降幅为52.06%。
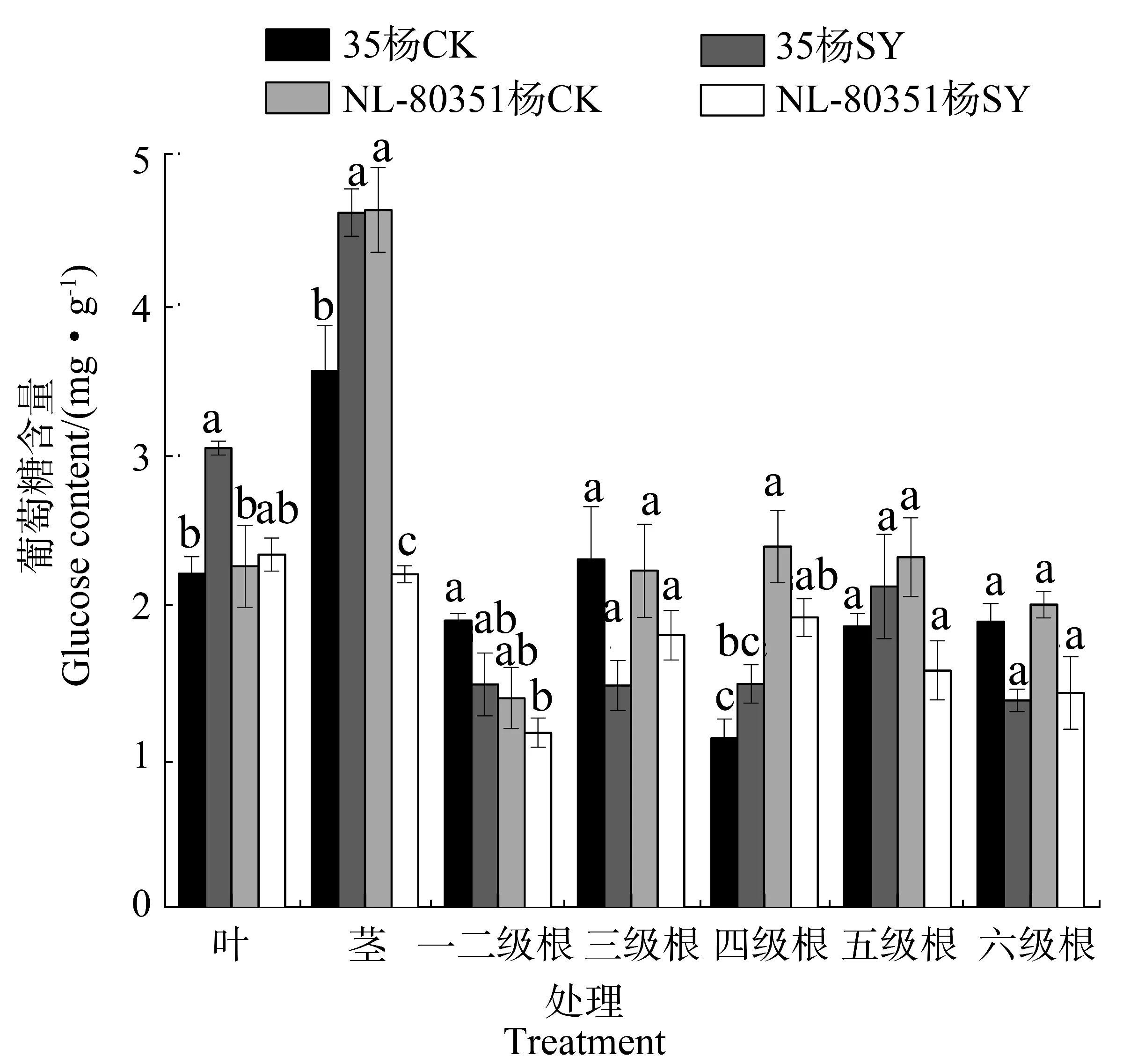
图2 水淹胁迫下35杨和NL-80351杨幼苗不同器官中的葡萄糖含量Figure 2 Glucose content in different organs of Poplar 35 and Poplar NL-80351 seedlings under waterlogging stress
与各自对照相比,水淹处理并没有显著影响35杨各器官及根系的蔗糖含量,但增加了NL-80351杨叶、4级根和6级根中的蔗糖含量(增幅分别为46.27%、34.12%、60.14%),降低了茎、1~3级根中蔗糖的含量,其中茎蔗糖含量的降低达显著水平(图3)。

图3 水淹胁迫下35杨和NL-80351杨幼苗不同器官中的蔗糖含量Figure 3 Sucrose content in different organs of Poplar 35 and Poplar NL-80351 seedlings under waterlogging stress
图4表明,对照条件下,NL-80351杨叶和茎的淀粉含量显著高于35杨,但5级根中的淀粉含量却显著低于35杨。与对照相比,水淹处理使得35杨植株茎、1~2级根、6级根淀粉含量显著增加,增幅分别为33.33%、39.28%和40.93%,5级根中淀粉含量显著下降;水淹处理使得NL-80351杨茎淀粉含量显著下降,使其1~2级根、3级根淀粉含量显著增加,增幅分别为44.14%和36.40%。
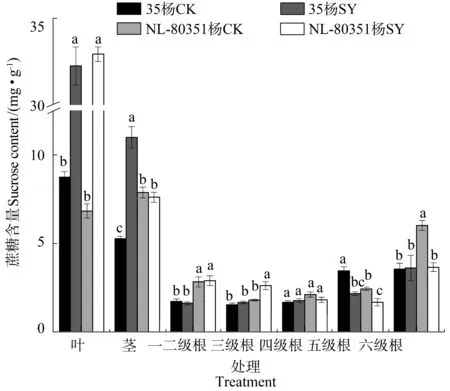
图4 水淹胁迫下35杨和NL-80351杨幼苗不同器官中的淀粉含量Figure 4 Starch content in different organs of Poplar 35 and Poplar NL-80351 seedlings under waterlogging stress
综上,水淹胁迫条件下,35杨叶片、茎的淀粉含量及茎的葡萄糖含量显著增加,NL-80351杨叶片淀粉和蔗糖含量增加,茎的葡萄糖、蔗糖和淀粉含量降低,两者不同根级的NSC没有表现出一致的规律,由此可见,NL-80351杨各器官及根系NSC含量对于水淹胁迫的响应更为明显。
2.4 水淹胁迫对35杨和NL-80351杨幼苗叶片抗氧化酶和MDA含量的影响
SOD、POD是植物体内参与活性氧代谢的主要酶,SOD 催化分解 O2-,使之转化为过氧化氢(H2O2);而POD则被认为是植物清除H2O2的酶,它们的活性变化在一定程度上反映了植物体内活性氧的代谢情况。丙二醛是膜脂过氧化的中间产物,常常用来反映植物受逆境伤害的程度。在对照条件下,NL-80351杨叶片SOD、POD活性均显著高于35杨,两者MDA含量差异不明显。与各自对照相比,水淹处理引起35杨叶片SOD和POD活性显著增强,一定程度增加了MDA的含量,但未达显著水平;水淹胁迫并没有显著影响NL-80351杨叶片SOD和POD活性,但使其叶片MDA含量显著增加。可见,35杨对活性氧的清除能力、对水淹胁迫的适应能力均优于NL-80351杨。
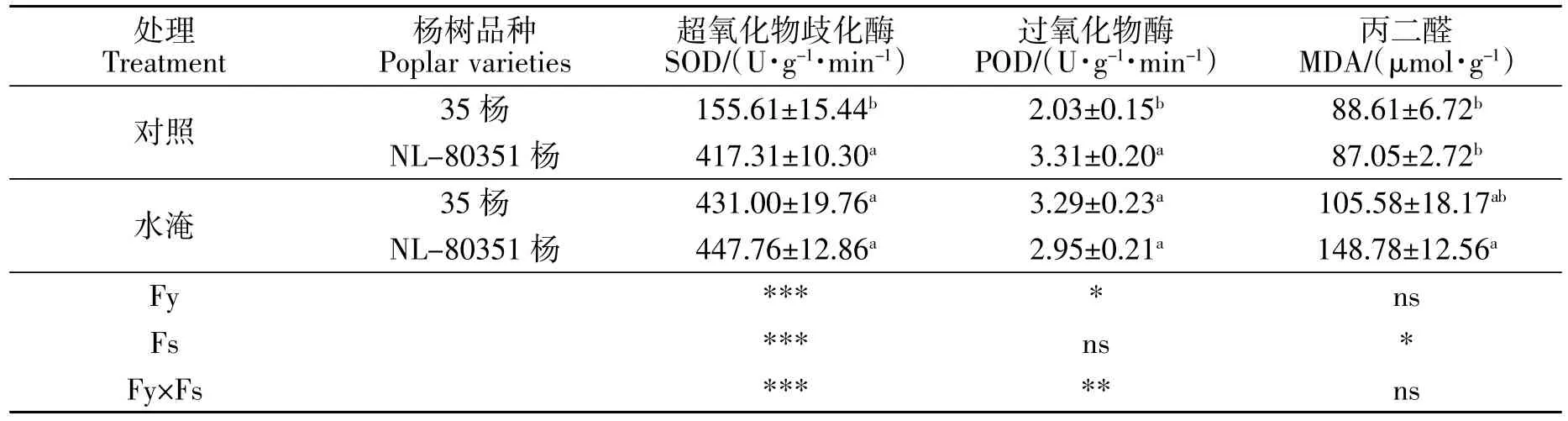
表3 水淹胁迫对35杨和NL-80351杨幼苗叶片抗氧化酶和MDA含量的影响(平均值±标准误差)Table 3 Effects of waterlogging stress on the contents of antioxidant enzymes and MDA in leaves of Poplar 35 and Poplar NL-80351 seedlings(mean±SE)
双因素方差分析结果表明(表4),品种作为独立因子对叶片SOD的活性影响极显著,对其POD活性影响显著;水分作为独立因子对杨树叶片的SOD活性影响极显著,对其叶片POD活性无显著影响,对其MDA含量影响显著;二者的交互效应对SOD活性、POD活性影响极显著。

表4 水淹胁迫对35杨和NL-80351杨幼苗叶片氮代谢酶活性和无机氮含量的影响(平均值±标准误)Table 4 Effects of waterlogging stress on nitrogen metabolism enzyme activities and inorganic nitrogen content in leaves of Poplar 35 and Poplar NL-80351 seedlings(mean±SE)
2.5 水淹胁迫对35杨和NL-80351杨幼苗叶片氮代谢酶活性和无机氮含量的影响
硝酸还原酶(NR)是氮素代谢的关键酶,谷氨酰胺合成酶(GS)是参与铵同化过程的关键酶,也是氮代谢中心的多功能酶,NR和GS对氮素的吸收和转化起着重要作用。谷氨酸合成酶(GOGAT)在催化谷氨酰胺合成谷氨酸的过程中起主要作用。由表5可知,与对照相比,水淹处理并没有显著影响35杨叶片氮代谢的酶活性及无机氮的含量;但显著抑制了NL-80351杨叶片NR、GS和GOGAT活性,降幅分别为40.09%、25.79%和56.87%,显著增强了GDH的活性并增加了铵态氮的含量。说明水淹胁迫对NL-80351杨氮代谢过程的影响更大,35杨在水淹的缺氧条件下维持氮代谢平衡的能力优于NL-80351杨。
品种作为独立影响因子对叶片GDH活性影响极显著,对叶片GOGAT活性影响显著,对叶片NR、GS活性以及硝态氮、铵态氮含量无显著影响。水淹对杨树叶片NR、GDH活性和铵态氮含量影响极显著,对叶片GS、GOGAT活性影响显著;两者的交互效应对杨树叶片GDH活性影响极显著,对NR、GS、GOGAT活性及铵态氮含量影响显著。
3 讨论与结论
植物生物量可以直接反映植物的生长状况和其对环境条件的适应能力。大多研究表明,水淹胁迫会对植物生长产生负面影响,植物生物量的变化是其适应淹水环境最直接的反映。例如,在2周的淹水处理和1周的恢复条件下,美洲黑杨I-69/55的相对生长速率下降,生物量显著下降[7-8]。2个月的水淹处理条件下,美洲黑杨3个杂交(P.deltoides Marsh.×P.nigra L.)子代无性系的生物量均显著下降[12]。本研究中,1个月的水淹处理并没有显著影响两个美洲黑杨品种的叶、茎和总生物量,两个品种均表现出了良好的水淹耐受性。另一方面,根系被认为是淹水胁迫条件下植物受伤最早、最敏感的部位[9],许多研究发现水淹条件下植物根系生物量和根冠比会下降[11],碳水化合物在韧皮部中的运输受阻及根系的腐烂是引起RS下降的主要原因。通常情况下,耐受性物种能维持根系的生长及较高的根冠比,可见NL-80351杨的水淹耐受性相对较差。进一步的根系分级研究发现,35杨根系生物量的减少主要发生在5~6级,1~4级根没有受到显著影响,对NL-80351杨而言,除1~2级根的生长没有显著受到抑制外,其余根系生物量均显著下降。值得注意的是,树木根系系统具有很大的异质性[21],低级根(1~3级根)主要承担植物对水分和养分的吸收,而较高级根序的根系则主要担负运输和贮存碳水化合物的功能。我们的研究结果表明,两种美洲黑杨在水淹胁迫条件下能维持低级根的生长,以维持吸收根的正常功能,NL-80351杨的根系生长受水淹胁迫的负面影响更大。
NSC是植物器官构建的能量和物质来源,同时还具有渗透调节的功能。NSC在植物体内的运输、积累与分配供给模式的变化与植物适应水淹胁迫环境密切相关。NSC主要由可溶性糖和淀粉组成,可溶性糖是植物体内主要的渗透调节物质之一,主要包括果糖、葡萄糖、蔗糖、果聚糖等,葡萄糖参与植物体内糖酵解过程,为植物提供ATP,蔗糖是碳水化合物运输的主要形式,调控细胞生理代谢和生长发育过程[22],淀粉则是NSC的主要储存形式。许多研究表明,水淹胁迫条件下,植物的光合产物从地上部分向地下部分的运输会受到抑制,导致光合器官中NSC的积累;根系在缺氧环境条件下生理代谢活动弱,NSC利用受阻[14],导致根系中NSC多以储存的形式存在,淀粉含量增加[1,16,23]。本研究中,在水淹胁迫下,35杨各器官的NSC总体保持稳定,仅有少数器官的NSC有显著变化;但是,NL-80351杨叶片蔗糖含量显著增加,茎蔗糖、葡萄糖、淀粉含量显著下降,低级别根系(1~3级)中蔗糖含量降低而淀粉含量显著增加,表明NL-80351杨运输、利用和储存NSC受到水淹处理的负面影响更大。
水淹胁迫引起的细胞缺氧会阻碍植物细胞生化反应过程中电子的正常传递,引起植物细胞积累大量过氧化物和超氧阴离子,引发氧化胁迫,对细胞生物大分子产生毒害作用[16,24]。抗氧化酶在清除活性氧过程中发挥着重要作用。其中,SOD和POD是参与活性氧代谢的主要酶,它们的活性变化在一定程度上反映了植物抗氧化胁迫能力[25]。MDA是膜质过氧化作用的产物,其含量的变化可以反映膜质过氧化的程度和植物对逆境环境适应能力,MDA含量越多表明植物受伤害越严重[26]。本研究中,水淹处理的两个品种的杨树MDA含量均高于对照组,NL-80351杨叶片中MDA的增加达显著水平,表明NL-80351杨受到的氧化胁迫更为严重。35杨较强的抗氧化能力与SOD和POD活性显著升高有关,而NL-80351杨两种酶活性变化不明显,无法清除过多的活性氧,引起了更强的氧化伤害。与本研究相似的是,水淹条件下,与抗性较强的美洲黑杨雄株相比,敏感的雌株叶片中SOD活性增加幅度较低[14];与非消落带的狗牙根相比,已适应周期性水淹环境的分布于消落带上的狗牙根表现出更强的耐水淹能力,这与后者更高的抗氧化酶活性密切相关[27]。
绿色植物的氮源主要以铵盐和硝酸盐为主,植物从土壤中吸收铵盐后,可直接利用它合成氨基酸,吸收硝酸盐则需要经过还原才能利用[28]。硝酸还原酶(NR)是硝酸盐代谢还原途径中的限速酶,其活性很容易受底物NO3-影响[29]。GS-GAGOT循环是高等植物体内同化铵的主要途径[30]。GDH则主要位于线粒体,与铵的亲和力较低,但行使双重功能,即当外部环境含有过量无机氮时GDH行使铵同化作用;当植物缺少有机碳源时,GDH分解谷氨酸,为TCA循环提供碳骨架,可能在植物处于逆境及衰老过程中去除铵毒方面发挥重要作用[31]。唐罗忠等[32]发现,在水淹条件下,NL-80351叶片的NR活性仅为对照的27.4%,较为耐性的I-69的活性为对照的61.6%。R.Alves等[33]发现,水淹胁迫引起齿叶蚁木(Tabebuia Serratifolia)叶片和根系的NR、GS活性显著下降,NO3-含量也降低;Horchani和 Aschi-Smiti[20]发现,在缺氧条件下,土豆(Solanum tuberosum L.)叶片中硝酸盐含量显著下降,亚硝酸盐和铵盐含量显著增加,GS显著下降,GDH显著上升。本研究中,一个月的水淹处理并没有显著影响35杨叶片氮代谢的酶活性及无机氮的含量,但显著抑制了NL-80351杨叶片 NR、GS、GOGAT、GDH 活性,显著增强了 GDH的活性并增加了铵态氮。可见,35杨在水淹的缺氧条件下具有更强的维持氮代谢平衡的能力,水淹处理显著抑制了NL-80351硝酸盐的还原和铵盐的同化,可能引起细胞铵毒的发生。
本研究发现,35杨、NL-80351杨幼苗均对水淹胁迫表现出良好的适应性。相比较而言,水淹胁迫对35杨幼苗生物量积累、NSC的分配和利用的影响明显小于NL-80351杨,35杨表现出更强的抗氧化酶活性、清除活性氧和维持细胞膜完整性的能力。此外,水淹胁迫对35杨氮代谢过程影响较小,而NL-80351杨的氮代谢过程受到显著影响,不利于其氮的同化和利用。由此可见,35杨耐受水淹胁迫的能力优于NL-80351杨,在易发生严重洪涝灾害的区域宜优先考虑种植35杨。
