马脐带间充质干细胞的分离培养与生物学特性研究
2021-11-03江文康黄国健雷彬王彩莹罗惠娜赵明明樊全宝阮慧敏陈胜锋王丙云
江文康 黄国健 雷彬 王彩莹 罗惠娜 赵明明 樊全宝 阮慧敏 陈胜锋 王丙云

摘要:【目的】建立马脐带间充质干细胞(UC-MSCs)体外分离培养体系,研究其增殖能力、分化能力和生物学特性,为推广UC-MSCs在赛马运动损伤治疗方面的应用提供理论依据。【方法】采用I型胶原酶消化法从脐带组织分离马UC-MSCs,通过绘制生长曲线及计算群体倍增时间检测其体外增殖能力,结合流式细胞仪检测和RT-PCR扩增鉴定表面标志物(CD29、CD44、CD45、CD73、CD90和CD105),并通过体外成脂成骨诱导分化检测其分化潜能。【结果】分离获得的原代马UC-MSCs为折光性强的圆形悬浮细胞,培养10 d后细胞融合达90%,且传代后细胞增殖速度明显提高,传代至P3代,细胞呈旋涡状生长,形态为均一的长梭形,生长趋势符合Logistic生长曲线规律,呈典型的S形。流式细胞仪检测结果显示,马UC-MSCs高表达CD29、CD44和CD90,表达率分别为98.45%、97.08%和96.56%,呈强阳性,但不表达CD45;RT-PCR扩增结果表明,马UC-MSCs表达CD29、CD44、CD73、CD90和CD105等MSCs表面标志物基因,但不表达CD45基因。以胰岛素、IBMX、罗格列酮和地塞米松为主要试剂进行马UC-MSCs体外成脂诱导,诱导第10 d发现细胞内有小脂滴形成,至诱导第18 d有大量脂滴形成;选用抗坏血酸、β-甘油磷酸钠和地塞米松为主要试剂进行体外成骨诱导,至诱导第7 d可观察到钙结节形成。【结论】采用I型胶原酶消化法分離获得的马UC-MSCs纯度高,且具有良好的体外增殖能力和多向分化潜能;掌握好马UC-MSCs的有效冻存方式,可为治疗赛马运动损伤提供优质的种子细胞。
关键词: 马;脐带;间充质干细胞;生物学特性;I型胶原酶消化法
中图分类号: S821.91 文献标志码: A 文章编号:2095-1191(2021)07-1998-09
Isolation, culture and biological characterization of horse umbilical cord-derived mesenchymal stem cells
JIANG Wen-kang1, HUANG Guo-jian2, LEI Bin2, WANG Cai-ying2, LUO Hui-na1, ZHAO Ming-ming1, FAN Quan-bao1, RUAN Hui-min3,
CHEN Sheng-feng1*, WANG Bing-yun1*
(1College of Life Science and Engineering, Foshan University of Science and Technology, Foshan, Guangdong 528231,China; 2Huangcun Sports Training Center of Guangdong,Guangzhou 510663 , China; 3Guangdong
VetCell Bio-tech Co., Ltd.,Foshan, Guangdong 528231, China)
Abstract:【Objective】The in vitro isolation and culture system of horse umbilical cord-derived mesenchymal stem cells(UC-MSCs) has been established to study its proliferative ability, differentiation ability and biological characteristics, and provide a theoretical basis for promoting the application of UC-MSCs in the treatment of horse racing sports injury. 【Method】Horse UC-MSCs were obtained by using type I collagenase digestion, and cell proliferation in vitro was determined by drawing growth curve and calculating population doubling time. Cell surface markers(CD29,CD44,CD45, CD73, CD90 and CD105) were identified by flow cytometry and RT-PCR amplification. The differentiation potential was detected by inducing adipose formation and osteogenesis differentiation in vitro. 【Result】The results revealed the isolated primary horse UC-MSCs was a round suspension cell with strong refraction. After 10 d of culture, the cell fusion reached 90%, and the cell proliferation rate increased after passage. After passage to the P3 generation, the cells grew in a vortex shape with a uniform long fusiform shape, and the growth trend was in accordance with the law of Logistic growth curve, showing a typical S shape. The results of flow cytometry showed that horse UC-MSCs highly expressed CD29, CD44 and CD90, and the expression rates were 98.45%, 97.08% and 96.56%, respectively, which were highly positive. But CD45 was not expressed. The results of RT-PCR showed that horse UC-MSCs expressed MSCs surface marker genes such as CD29, CD44, CD73, CD90 and CD105, but did not express CD45 gene. Adipogenesis of horse UC-MSCs was induced in vitro with insulin, IBMX, rosiglitazone and dexamethasone as main reagents. Small lipid droplets were found on the 10th day of induction, and a large number of lipid droplets formed on the 18th d of induction.Ascorbic acid, sodium β-gly-cerophosphate and dexamethasone were used as the main reagents for osteogenic induction in vitro. Calcium nodule formation was observed on the 7th d of induction. 【Conclusion】The results show that the purity of the horse UC-MSCs obtained by I-type collagen enzyme digestion is high and has good in vitro proliferation and multi-directional potential; master the effective freezing mode of horses UC-MSCS, providing quality seed cells in the treatment of horse.
Key words: horse; umbilical cord; mesenchymal stem cells; biological characteristics; I-type collagen enzyme digestion
Foundation item:Guangdong Natural Science Foundation(2017A030313171,2018A030313892); Project of Animal Stem Cell Engineering Technology Research Center of Guangdong Universities(2021GCZX006)
0 引言
【研究意义】马作为竞技类动物,常因长年累月的训练及过度负荷而造成关节严重磨损,进而引发退行性关节炎、悬韧带炎、肌腱炎、骨膜炎、肌肉拉伤和骨折等问题,很大程度上降低其竞技水平,加之传统的抗炎方法治疗效果差、恢复时间长且存在复发的现象,给赛马业带来巨大经济损失(王冠颖,2015)。间充质干细胞(Mesenchymal stem cells,MSCs)是一种非造血性且具有多向分化潜能的成体干细胞,可从骨髓、脂肪、脐带及脐带血等多种组织中分离获得(付旭锋等,2016;罗惠娜等,2020)。MSCs具有强大的免疫调节和抗炎作用,能通过细胞间相互作用及分泌多种因子以调节关节局部内环境并活化内源性祖细胞,从而修复受损的软骨组织(Glenn and Whartenby,2014)。因此,加强马MSCs生物学特性及其功能研究可为治疗赛马运动损伤提供种子细胞。【前人研究进展】目前,已成功在羊(Czernik et al.,2013)、鸡(Wang et al.,2018)、鸭(李婷婷等,2019)、奶牛(罗惠娜等,2020)及猪(马亚军等,2020)等动物上分离获得MSCs,且发现奶牛脂肪间充质干细胞(Adipose-derived mesenchymal stem cells,AD-MSCs)能促进奶牛乳腺上皮细胞增殖和抑制其凋亡(王立文,2016),对治疗因奶牛蹄叶炎引起的跛行具有良好效果(鲁文赓等,2020),还能提高牛脂肪细胞中脂肪酸的合成(岳永莉,2016)。MSCs在马运动损伤上的研究及应用已有报道,Pacini等(2007)通过向马损伤肌腱定向注射骨髓间充质干细胞(Bone marrow mesenchyml stem cell,BM-MSCs),发现在BM-MSCs注射6个月后损伤的肌腱得到修复,马的竞技水平能恢复到最佳状态。Barrachina等(2018)、Mari?as-Pardo等(2018)研究发现,MSCs能有效制止化学性诱导马关节炎前期的炎症反应和软骨降解,并改善跛行症状。越来越多的研究表明,MSCs能定向迁移至损伤部位释放各类细胞因子,通过促进血管生成、细胞增殖及抑制炎症反应和细胞凋亡,促进再生以改善组织功能,具有广阔的医学应用前景。制备BM-MSCs时易造成机体感染而存在风险,且其增殖分化能力随供体年龄增长而下降;AD-MSCs虽然采集量多,体外增殖速度快,但采集时同样存在入侵性(Shariatzadeh et al.,2019)。相比之下,脐带间充质干细胞(Umbilical cord mesenchymal stem cells,UC-MSCs)来源于产后脐带中的华通胶及血管周围组织,取材广泛方便,不存在伦理问题,且具有较低的免疫原性和良好的体外增殖能力(Li et al.,2007;Suzdaltseva et al.,2008;刘梦婷等,2020)。UC-MSCs除了具有三系分化能力外,还能诱导分化为心肌细胞(Qian et al.,2012)、肌细胞(Xu et al.,2017)和肝细胞(Yu et al.,2018)等,具有巨大的治疗潜能。【本研究切入点】在国内,有关马MSCs的研究仅止步于BM-MSCs和AD-MSCs,针对UC-MSCs的研究至今未见报道。【拟解决的关键问题】通过I型胶原酶消化法从马的脐带组织中分离获得UC-MSCs,研究其增殖能力、分化能力及生物学特性,为推广UC-MSCs在赛马运动损伤治疗过程中的应用提供理论依据。
1 材料与方法
1. 1 试验材料
供试动物为广州奥体马术场提供的中年纯血骟马。0.25%胰蛋白酶、I型胶原酶和青链霉素双抗购自美国HYclon公司,DMEM培养液和胎牛血清(FBS)购自以色列Biological Industries(BI)公司,干细胞成骨和成脂诱导液购自Cyagen公司,CD90、CD45、CD29和CD44抗体购自Abcam公司,RNA提取试剂盒和反转录试剂盒购自TaKaRa公司。主要仪器设备:流式细胞仪(美国BD公司),超净工作臺(苏州苏净仪器自控设备有限公司),离心机(德国Eppendorf公司),倒置显微镜(日本Olympus公司),PCR仪(Thermofisher公司)。
1. 2 试验方法
1. 2. 1 马UC-MSCs分离培养 于马分娩后立即剪取10 cm脐带组织,置于装有10%双抗PBS的50 mL离心管中浸泡,低温保存运回实验室,在超净工作台中无菌处理脐带组织,脐带组织以75%酒精浸泡3 s后用10%双抗PBS冲洗,洗去表面血细胞,无菌手术剪剪开脐带并剥离血管,剥离后的组织剪碎成1 mm3,置于50 mL离心管中,加入5倍体积的I型胶原酶溶液(1 mg/mL),置于37 ℃培养箱中消化2~3 h,消化液用200目细胞筛过滤,滤液1200 r/min离心5 min,弃上清液,加入含1% L-谷氨酰胺、1%双抗和10% FBS的完全培养基重悬细胞,调整细胞密度至1×107 Cells/mL,转移至60 mm培养皿,置于CO2培养箱中培养,培养48 h后半量换液去除血细胞,以后每3 d换液1次,倒置显微镜下观察细胞形态,当细胞融合70%~80%时进行传代。
1. 2. 2 细胞冻存及复苏 细胞冻存:取生长良好的P3代马UC-MSCs,0.25%胰酶消化后收集细胞,1000 r/m离心5 min,弃上清液,加入冻存液(60% DMEM+30% FBS+10% DMSO),调整细胞密度为1×106~1×107 Cells/mL,分装至冻存管中(1 mL/管),然后置于程序降温盒中,-80 ℃过夜后放入液氮罐中保存备用。细胞复苏:从液氮中取出的马UC-MSCs在37 ℃恒温水浴锅中解冻,1000 r/min离心5 min,弃上清液,加入1.0 mL完全培养基重悬细胞,取50.0 μL细胞悬液与4%台盼蓝染色混合(1∶1),Counstar自动细胞计数仪计数,分别记录活细胞数和死细胞数,重复3次,计算细胞存活率。细胞存活率(%)=活细胞数/总细胞数×100。
1. 2. 3 生长曲线制作及群体倍增时间计算 分别取生长良好的P3、P6和P9代马UC-MSCs,0.25%胰酶消化制成细胞悬液,调整细胞密度为5×104 Cells/mL,接种至24孔细胞培养板(0.5 mL/孔),置于37 ℃、5% CO2培养箱中连续培养8 d,每隔3 d换液1次,每隔24 h随机消化3孔,取50.0 μL细胞悬液与4%台盼蓝染色混合(1∶1),Counstar自动细胞计数仪计数,取3孔平均值,以单位细胞密度为纵坐标、时间为横坐标绘制生长曲线。根据Patterson公式计算细胞对数期群体倍增时间(DT):
[DT=t×[lg2/(lgNt-lgNo)]
式中,t为细胞增殖时间(h),No为起始细胞数,Nt为最终细胞数。
1. 2. 4 表面标志物鉴定 取P3代马UC-MSCs,0.25%胰酶消化制成细胞悬液,调整细胞密度为2×105 Cells/mL,转移至1.5 mL离心管中,1000 r/min离心5 min,弃上清液,加入PBS清洗2次、重复离心。分别加入CD29、CD44、CD45和CD90抗体稀释液50.0 μL孵育30 min,PBS清洗后离心,弃上清液,加入100.0 μL PBS重悬细胞,1 h内采用流式细胞仪检测马UC-MSCs表面标志物的表达情况。
1. 2. 5 RT-PCR检测标志物基因表达情况 应用RT-PCR检测马UC-MSCs标志物CD29、CD44、CD45、CD73、CD90和CD105基因的表达情况。取生长良好的P3代马UC-MSCs,采用TaKaRa试剂盒提取总RNA,反转录合成cDNA后进行PCR扩增。PCR反应体系25.0 μL:Premix Ex Taq 12.5 μL,上、下游引物各1.0 μL,cDNA模板1.0 μL,ddH2O 9.5 μL。扩增程序:95 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,进行30个循环;72 ℃延伸5 min。RT-PCR扩增产物以1.0%琼脂糖凝胶电泳进行检测。扩增引物委托生工生物工程(上海)股份有限公司合成,引物序列如表1所示。
1. 2. 6 成脂诱导 取生长良好的P3代马UC-MSCs,0.25%胰酶消化后调整细胞密度为5×104 Cells/mL,接种至24孔细胞培养板(0.5 mL/孔),置于37 ℃、5% CO2培养箱中培养。分别设对照组和诱导组,每组3个重复。诱导组细胞接种24 h后弃原培养液,PBS清洗,每孔加入0.5 mL成脂诱导A液(含FBS、双抗、谷氨酰胺、胰岛素、3-异丁基-1-甲基黄嘌呤、罗格列酮和地塞米松)诱导,3 d后更换为成脂诱导B液(含FBS、青链霉素双抗、谷氨酰胺和胰岛素)诱导1 d,再更换为成脂诱导A液,A液和B液交替使用3~5次,当细胞出现较多脂滴且脂滴变大时进行油红O染色。对照组细胞每隔3 d换液1次。
1. 2. 7 成骨诱导 取生长良好的P3代马UC-MSCs,0.25%胰酶消化后调整细胞密度为5×104 Cells/mL,接种至24孔细胞培养板(0.5 mL/孔),置于37 ℃、5% CO2培养箱中培养。分别设对照组和诱导组,每组3个重复。诱导组细胞接种24 h后弃除原培养液,PBS清洗,每孔加入0.5 mL成骨分化液(含FBS、青链霉素双抗、谷氨酰胺、抗坏血酸、β-甘油磷酸钠和地塞米松),每隔3 d换液1次,当细胞出现钙结节时进行茜素红染色。对照组细胞每隔3 d换液1次。
1. 3 统计分析
试验数据采用SPSS 19.0进行统计分析,以单因素方差分析(One-way ANOVA)进行组间差异检验。
2 结果与分析
2. 1 细胞形态学观察结果
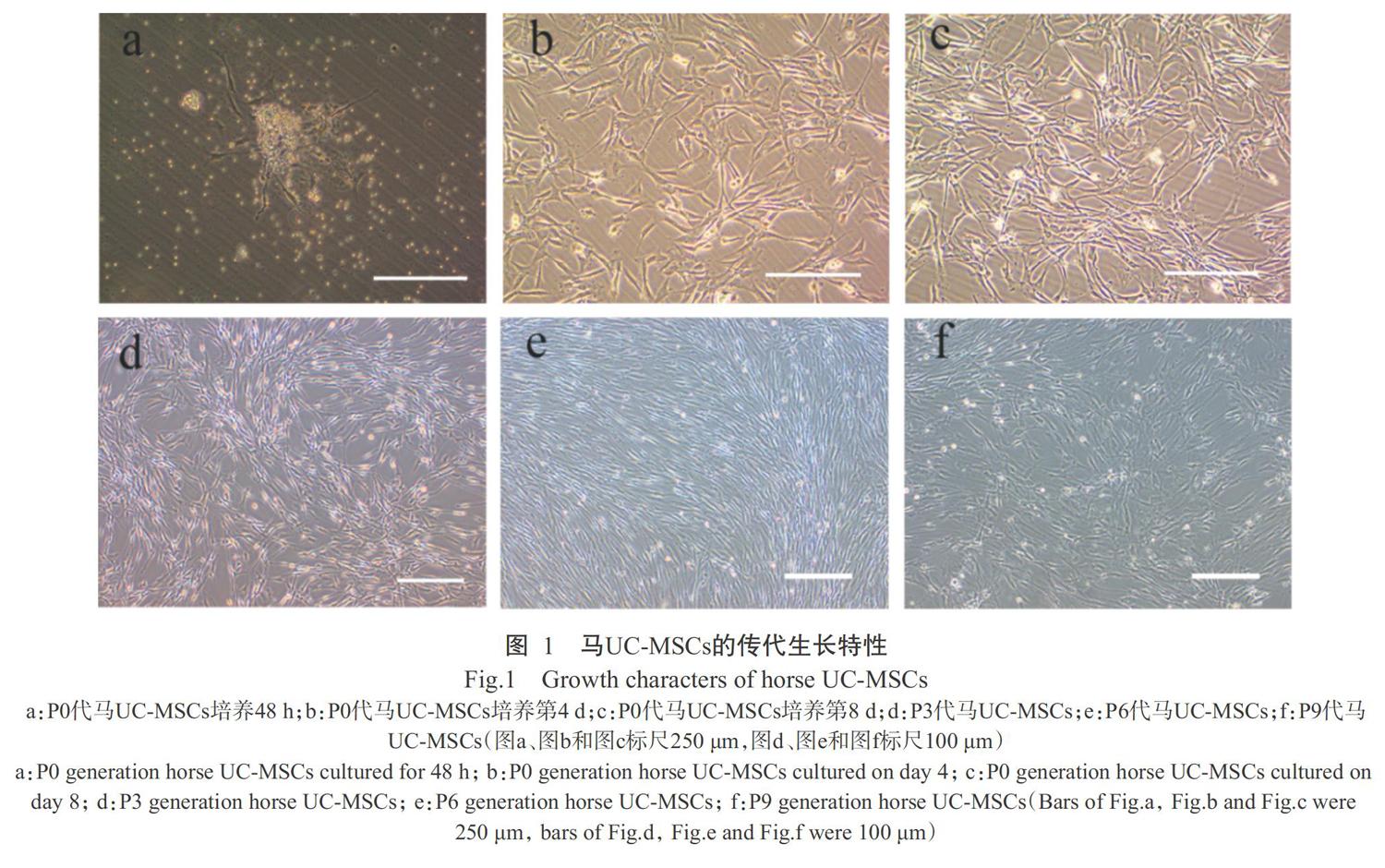
原代(P0)细胞:在倒置显微镜观察下,刚接种的P0代馬UC-MSCs为折光性强的圆形悬浮细胞,轮廓清晰;培养48 h后大部分细胞贴壁,呈圆形或椭圆形,少量细胞呈多边形或短梭形,培养基中可见少许未贴壁的血细胞(图1),换液去除;培养至第6 d,细胞融合达50%,大部分细胞呈折光性强的多角形或梭形,少量细胞表现呈扁平样,折光性较弱;培养第至10 d,细胞融合达90%,细胞呈漩涡状生长,经0.25%胰酶消化后进行传代,传代细胞即为P1代马UC-MSCs。P0代细胞生长缓慢,细胞生长不规则。
传代细胞:P1代马UC-MSCs培养8 h后完全贴壁,生长速度明显提高,细胞呈放射状向外生长,培养3 d其细胞融合达80%;传至P3代,细胞形态均一,呈现典型的长梭形;当细胞传至P9代,部分细胞胞浆内出现空泡,大量细胞形成较长的纤维状突起,此时细胞折光性消失,细胞轮廓不明显,提示细胞老化(图1)。
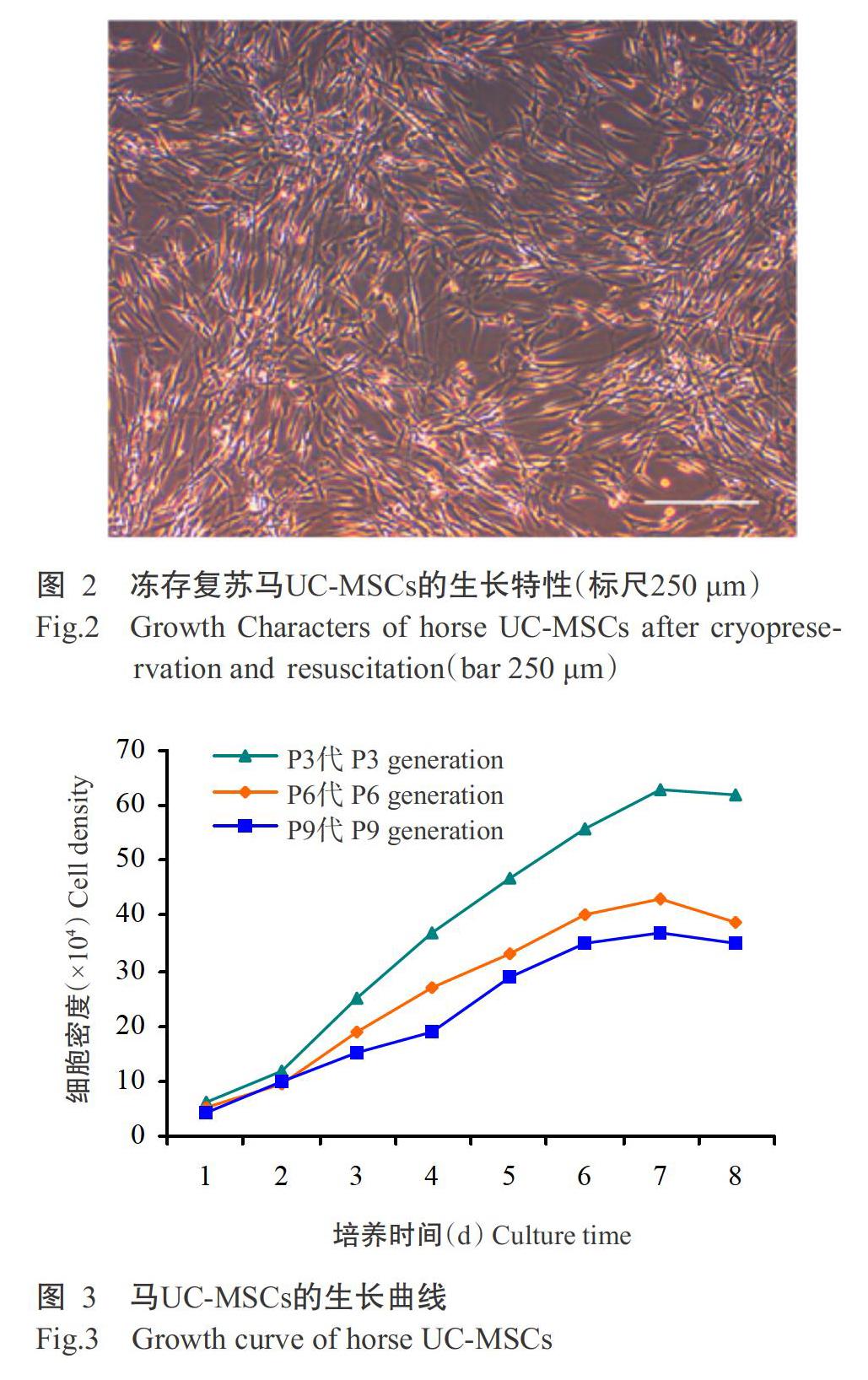
冻存3个月的P3代马UC-MSCs复苏后,仍保持折光性强的长梭形细胞形态,存活率高达93%,复苏后的细胞形态和生长特性与冻存前基本保持一致(图2)。
2. 2 生长曲线及群体倍增时间的确定
P3代、P6代和P9代马UC-MSCs的生长曲线趋势(图3)均呈S形,存在生长潜伏期、对数生长期和平台期。P3代和P6代马UC-MSCs的生长潜伏期为1 d,第2 d即进入对数生长期,第7 d进入平台期;P9代马UC-MSCs的生长潜伏期为3 d,第4 d进入对数生长期,第6 d进入平台期。根据Patterson公式计算可知,P3代、P6代和P9代马UC-MSCs群体倍增时间分别为43.98±0.94、46.67±0.87和52.14±0.58 h。其中,P3代细胞群体倍增时间与P6代细胞群体倍增时间相比差异显著(P<0.05),二者与P9代细胞群体倍增时间相比差异均达极显著水平(P<0.01)(图4)。
2. 3 马UC-MSCs表面标志物鉴定结果
采用流式细胞仪分析P3代马UC-MSCs表面标志物的表达情况,结果(图5)发现马UC-MSCs高表达MSCs的特异性表面抗原CD29、CD44和CD90,表达率分别为98.45%、97.08%和96.56%,但不表达白细胞特异性表面抗原CD45。RT-PCR扩增电泳结果(图6)也显示,马UC-MSCs表达CD29、CD44、CD73、CD90和CD105等MSCs表面标志物基因,但不表达CD45基因。流式细胞仪检测结果和RT-PCR扩增结果完全吻合,说明P3代马UC-MSCs具有MSCs的生物学特性。
2. 4 成脂诱导分化结果
P3代马UC-MSCs培养24 h后加入成脂诱导分化液,诱导48 h后细胞形态开始发生变化。至诱导第5 d,细胞融合达100%,细胞由具有折光性的长梭形变成扁平的圆形或多角形,细胞体积增大;至诱导第10 d,部分细胞的细胞质中出现折光性小脂滴;至诱导第14 d,细胞质中的小脂滴融合成大脂滴;诱导第18 d有大量指滴形成,经油红O染色,光学显微镜观察发现染色后脂滴呈红色(图7),且形成脂滴的马UC-MSCs多聚集在培养皿周边。对照组P3代马UC-MSCs在培养过程中未见脂滴形成。
2. 5 成骨诱导分化结果
P3代马UC-MSCs培养24 h后加入成骨诱导分化液,诱导24 h后细胞形态开始发生变化。至诱导第3 d,细胞体积开始增大,细胞两端变尖,细胞形态变长;至诱导第7 d,细胞形态不规则,细胞堆积形成钙结节,呈鳞片状,不同结节间形成较宽的间隙;至诱导第10 d,钙结节变大,且数量增多,采用茜素红进行矿化结节染色,结节被染成明亮的红色(图8)。对照组P3代马UC-MSCs在培养过程中,其细胞形态变化不明显,有少量细胞死亡,未形成钙结节。
3 讨论
脐带来源于中胚层,是连接母体与胎儿的管状结构,由血管和华通胶组成,外层被羊膜包裹,起营养传输作用(Brunelli et al.,2019)。UC-MSCs最早于2003年从脐带华通胶中分离获得,并发现其具有向神经细胞分化的潜力(Mitchell et al.,2003)。UC-MSCs的分离目前尚无统一标准,常用组织贴壁法和酶消化法,其中酶消化法能在较短时间内获得大量原代细胞(Salehinejad et al.,2012;刘玲英等,2013)。已有研究表明,I型胶原酶消化法分离得到的MSCs活性高且增殖活性好(罗惠娜等,2020)。本研究通过I型胶原酶消化法分离获得马UC-MSCs,培养10 d后细胞融合达90%,且传代后细胞增殖速度明显提高,传代至P3代,细胞呈旋涡状生长,形态为均一的长梭形,生长趋势符合Logistic生长曲线规律,呈典型的S形。
目前,已在多种动物上分离获得多种不同来源的MSCs,但MSCs缺乏特异性表面抗原,主要通过其表面标志物、细胞形态及分化能力等进行综合鉴定。大量研究表明,MSCs高表达CD29、CD44、CD73、CD90和CD105,分别与细胞的黏附、纤维化调节、迁移、免疫反应及增殖有关(de Schauwer et al.,2011;杜志朋等,2019),低表达或不表达CD34和CD45。本研究通过流式细胞术结合RT-PCR扩增对分离获得的马UC-MSCs进行鉴定,流式细胞仪检测结果显示,马UC-MSCs高表达CD29、CD44和CD90,表达率分别为98.45%、97.08%和96.56%,均高于95.00%,呈强阳性,但不表达CD45;RT-PCR扩增结果表明,马UC-MSCs表达CD29、CD44、CD73、CD90和CD105等MSCs表面标志物基因,但不表达CD45基因。说明分离获得的马UC-MSCs不掺杂造血细胞,纯度较高,其表面抗原符合MSCs的生物学特征。除了表面标志物外,体外分化能力也是鉴定MSCs的主要标准。刘雪婷等(2016)采用地塞米松和β-甘油磷酸等成功诱导鸭AD-MSCs成骨,在诱导第10 d即有钙结节形成。李捷等(2017)选用地塞米松、维生素C及β-甘油磷酸钠等试剂成功诱导犬BM-MSCs生成脂滴。本研究以胰岛素、IBMX、罗格列酮和地塞米松为主要试剂进行马UC-MSCs体外成脂诱导,诱导第10 d发现细胞内有小脂滴形成,至诱导第18 d有大量脂滴形成;成骨诱导则选用抗坏血酸、β-甘油磷酸钠和地塞米松为主要试剂,诱导第7 d观察到钙结节形成。综合细胞形态、表面标志物鉴定及成脂成骨诱导结果,可确定分离获得的细胞为马UC-MSCs。
细胞冻存问题是MSCs在临床上使用受限制的主要原因之一,在体外多次培养传代下MSCs的增殖能力和分化潜能均会下降,因此种子细胞的有效冻存尤为关键,冻存质量直接影响复苏后细胞的活性及其生物学特性。影响MSCs冻存效率的因素主要包括冻存速率、温度及冷冻保护剂选择等(付旭锋等,2016)。本研究采用60% DMEM+30% FBS+10% DMSO的冻存液配比,通过程序降温盒对P3代马UC-MSCs進行冻存,3个月后复苏细胞,细胞存活率高达93%,且复苏后的细胞形态和生长特性与冻存前基本保持一致,说明该冻存方法能有效降低因冻存而造成的细胞损伤。
4 结论
采用I型胶原酶消化法分离获得的马UC-MSCs纯度高,且具有良好的体外增殖能力和多向分化潜能;掌握好马UC-MSCs的有效冻存方式,可为治疗赛马运动损伤提供优质的种子细胞。
参考文献:
杜志朋,殷国田,李苗苗,郭志坤,李琼. 2019. 不同来源間充质干细胞表面标记的比较[J]. 解剖学报,50(5):589-594. doi:10.16098/j.issn.0529-1356.2019.05.008. [Du Z P,Yin G T,Li M M,Guo Z K,Li Q. 2019. Comparison of surface markers of mesenchymal stem cells from different sources[J]. Acta Anatomica Sinica,50(5):589-594.]
付旭锋,刘平,陈冰冰,焦扬,司维,郑冰蓉. 2016. 间充质干细胞冻存方法的研究进展[J]. 云南大学学报(自然科学版),38(4):652-660. doi:10.7540/j.ynu.20160104. [Fu X F,Liu P,Chen B B,Jiao Y,Si W,Zheng B R. 2016. Review of the progress on the cryopreservation methods of mesenchymal stem cells[J]. Journal of Yunnan University(Natural Sciences Edition),38(4):652-660.]
李捷,白利鹏,陈曦,杨芳,沈留红,曹随忠,左之才,任志华,马晓平,余树民. 2017. 犬骨髓间充质干细胞的体外分离培养及鉴定[J]. 浙江农业学报,29(5):751-759. doi:10.3969/j.issn.1004-1524.2017.05.10. [Li J,Bai L P,Chen X,Yang F,Shen L H,Cao S Z,Zuo Z C,Ren Z H,Ma X P,Yu S M. 2017. Isolation,cultivation and identification of canine bone marrow mesenchymal stem cells (BMSCs) in vitro[J]. Acta Agriculturae Zhejiangensis,29(5):751-759.]
李婷婷,许龙,梁峻. 2019. 北京鸭肝间充质干细胞分离、培养及分化潜能研究[J]. 中国畜牧兽医,46(10):2882-2889. doi:10.16431/j.cnki.1671-7236.2019.10.009. [Li T T,Xu L,Liang J. 2019. Study on isolation,culture and differentiation potential of liver mesenchymal stem cells in Beijing duck[J]. China Animal Husbandry & Veterinary Me-dicine,46(10):2882-2889.]
刘玲英,柴家科,段红杰,侯玉森,尹会男,郁永辉,胡泉,郝岱峰,冯光,李涛,杜俊东. 2013. 人脐带间充质干细胞不同分离方法的效果比较[J]. 中华医学杂志,93(32):2592-2596. doi:10.3760/cma.j.issn.0376-2491.2013.32.016. [Liu L Y,Chai J K,Duan H J,Hou Y S,Yin H N,Yu Y H,Hu Q,Hao D F,Feng G,Li T,Du J D. 2013. Comparison of different methods for the isolation of human umbilical cord mesenchymal stem cells[J]. National Medical Journal of China,93(32):2592-2596.]
刘梦婷,饶巍,韩兵,肖翠红,武栋成. 2020. 人脐带间充质干细胞的体外免疫调节特性[J]. 中国组织工程研究,24(7):1063-1068. doi:10.3969/j.issn.2095-4344.1862. [Liu M T,Rao W,Hao B,Xiao C H,Wu D C. 2020. Immunomodulatory characteristics of human umbilical cord me-senchymal stem cells in vitro[J]. Chinese Journal of Tissue Engineering Research,24(7):1063-1068.]
刘雪婷,元虹懿,张明海,关伟军. 2016. 鸭脂肪间充质干细胞分离培养与生物学特性[J]. 生物技术通报,32(8):122-128. doi:10.13560/j.cnki.biotech.bull.1985.2016.08.019. [Liu X T,Yuan H Y,Zhang M H,Guan W J. 2016. Isolation and biological characterization of duck adipose-derived mesenchymal stem cells[J]. Biotechnology Bulletin,32(8):122-128.]
鲁文赓,刘庆,徐郑美,原冬伟,李维龙,毛莹莹,冯琳,杜珍珍,曹立明,司琳清,金吉东,刘丽丽,付世新,韩英浩. 2020. 脂肪间充质干细胞对奶牛蹄叶炎的疗效[J]. 畜牧与兽医,52(11):123-127. [Lu W G,Liu Q,Xu Z M,Yuan D W,Li W L,Mao Y Y,Feng L,Du Z Z,Cao L M,Si L M,Qin J D,Liu L L,Fu S X,Han Y H. 2020. Therapeutic effect of bovine adipose-derived stem cells on dairy cows with laminitis[J]. Animal Husbandry and Veterinary Medicine,52(11):123-127.]
羅惠娜,樊全宝,江文康,赵明明,王静静,罗冬章,王丙云. 2020. 奶牛脂肪来源间充质干细胞的分离培养及其生物学特性研究[J]. 南方农业学报,51(6):1462-1469. doi:10.3969/j.issn.2095-1191.2020.06.028. [Luo H N,Fan Q B,Jiang W K,Zhao M M,Wang J J,Luo D Z,Wang B Y. 2020. Isolation,culture and biological characteristics of dairy cow adipose-derived mesenchymal stem cells[J]. Journal of Southern Agriculture,51(6):1462-1469.]
马亚军,焦智慧,刘笑凝,张千振,王洪斌. 2020. 二次酶消化法原代培养猪脂肪间充质干细胞[J]. 中国兽医学报,40(11):2200-2204. doi:10.16303/j.cnki.1005-4545.2020. 11.20. [Ma Y J,Jiao Z H,Liu X N,Zhang Q Z,Wang H B. 2020. Primary culture of porcine adipose-derived me-senchymal stem cells by secondary enzyme digestion[J]. Chinese Journal of Veterinary Science,40(11):2200-2204.]
王冠颖. 2015. 马骨关节炎关节损伤机制的硏究[D]. 哈尔滨:东北农业大学. [Wang G Y. 2015. Research on the joint damage mechanism of equine osteoarthritis[D]. Harbin:Northeast Agricultural University.]
王立文. 2016. 奶牛脐带间充质干细胞通过激活PI3K/Akt/mTOR信号通路调控奶牛乳腺上皮细胞生理功能的研究[D]. 乌鲁木齐:新疆农业大学. doi:10.7666/d.Y3101367. [Wang L W. 2016. Regulatory effect of umbilical cord mesenchymal stem cells on bovine mammary epithelial cells physiological function mediated by PI3K/AKT/mTOR signaling pathway[D]. Urumqi:Xinjiang Agricultural University.]
岳永莉. 2016. 牛脂肪间充质干细胞的分离鉴定及过表达SCD1基因的研究[D]. 呼和浩特:内蒙古大学. doi:10. 7666/d.Y3374521. [Yue Y L. 2016. The study of isolation and identification of bovine adipose derived stem cells and the effect of SCD1 gene overexpression[D]. Hohhot:Inner Mongolia University.]
Barrachina L,Remacha A R,Romero A,Vitoria A,Albareda J,Prades M,Roca M,Zaragoza P,Vázquez F J,Rodellar C. 2018. Assessment of effectiveness and safety of repeat administration of proinflammatory primed allogeneic me-senchymal stem cells in an equine model of chemically induced osteoarthritis[J]. BMC Veterinary Research,14(1):241. doi:10.1186/s12917-018-1556-3.
Brunelli R,de Spirito M,Giancotti A,Palmieri V,Parasassi T,Di Mascio D,Flammini G,D'Ambrosio V,Monti M,Boccaccio A,Pappalettere C,Ficarella E,Papi M,Lamberti L. 2019. The biomechanics of the umbilical cord Wharton Jelly:Roles in hemodynamic proficiency and resistance to compression[J]. Journal of the Mechanical Behavior of Biomedical Materials,100:103377. doi:10.1016/ j.jmbbm.2019.103377.
Czernik M,Fidanza A,Sardi M,Galli C,Brunetti D,Malatesta D,Salda L D,Matsukawa K,Ptak G E,Loi P. 2013. Differentiation potential and GFP labeling of sheep bone marrow-derived mesenchymal stem cells[J]. Journal of Cellular Biochemistry,114(1):134-143. doi:10.1002/jcb. 24310.
de Schauwer C,Meyer E,van de Walle G R,van Soom A. 2011. Markers of stemness in equine mesenchymal stem cells:A plea for uniformity[J]. Theriogenology,75(8):1431-1443. doi:10.1016/j.theriogenology.2010.11.008.
Glenn J D,Whartenby K A. 2014. Mesenchymal stem cells:Emerging mechanisms of immunomodulation and therapy[J]. World Journal of Stem Cells,6(5):526-539. doi:10. 4252/wjsc.v6.i5.526.
Li C D,Zhang W Y,Jiang X X,Mao N. 2007. Human-placenta-derived mesenchymal stem cells inhibit proliferation and function of allogeneic immune cells[J]. Cell and Ti-ssue Research,330(3):437-446. doi:10.1007/s00441-007-0504-5.
Mari?as-Pardo L,García-Castro J,Rodríguez-Hurtado I,Rodríguez-Garcia M I,Nú?ez-Naveira L,Hermida-Prieto M. 2018. Allogeneic adipose-derived mesenchymal stem cells(Horse Allo 20) for the treatment of osteoarthritis-associa-ted lameness in horses:Characterization,safety,and efficacy of intra-articular treatment[J]. Stem Cells and Development,27(17):1147-1160. doi:10.1089/scd.2018.0074.
Mitchell K E,Weiss M L,Mitchell B M,Martin P,Davis D,Morales L,Helwig B,Beerenstrauch M,Abou-Easa K,Hildreth T,Troyer D,Medicetty S. 2003. Matrix cells from Wharton?s jelly form neurons and glia[J]. Stem Cells,21(1):50-60. doi:10.1634/stemcells.21-1-50.
Pacini S,Spinabella S,Trombi L,Fazzi R,Galimberti S,Dini F,Carlucci F,Petrini M. 2007. Suspension of bone marrow-derived undifferentiated mesenchymal stromal cells for repair of superficial digital flexor tendon in race hor-ses[J]. Tissue Engineering,13(12):2949-2955. doi:10. 1089/ten.2007.0108.
Qian Q,Qian H,Zhang X,Zhu W,Yan Y M,Ye S Q,Peng X J,Li W,Xu Z,Sun L Y,Xu W R. 2012. 5-Azacytidine induces cardiac differentiation of human umbilical cord-derived mesenchymal stem cells by activating extracellular regulated kinase[J]. Stem Cells and Development,21(1):67-75. doi:10.1089/scd.2010.0519.
Salehinejad P,Alitheen N B,Ali A M,Omar A R,Mohit M,Janzamin E,Samani F S,Torshizi Z,Nematollahi-Mahani S N. 2012. Comparison of different methods for the isolation of mesenchymal stem cells from human umbilical cord Wharton?s jelly[J]. In Vitro Cellular & Development Biology. Animal,48(2):75-83. doi:10.1007/s11626-011-9480-x.
Shariatzadeh M,Song J N,Wilson S L. 2019. The efficacy of different sources of mesenchymal stem cells for the treatment of knee osteoarthritis[J]. Cell and Tissue Research,378(3):399-410. doi:10.1007/s00441-019-03069-9.
Suzdaltseva Y G,Burunova V V,Vakhrushev I V,Cheglakov I B,Yarygin K N. 2008. In vitro comparison of immunological properties of cultured human mesenchymal cells from various sources[J]. Bulletin of Experimental Bio-logy and Medicine,145(2):228-231. doi:10.1007/s10517- 008-0057-y.
Wang X S,C F H,Wang J J,Ji H D,Guan W J,Zhao Y H. 2018. Isolation,culture,and characterization of chicken lung-derived mesenchymal stem cells[J]. Canadian Journal of Veterinary Research,82(3):225-235.
Xu J J,Sun M Y,Tan Y,Wang H W,Wang H P,Li P D,Xu Z R,Xia Y H,Li L S,Li Y L. 2017. Effect of matrix stiffness on the proliferation and differentiation of umbilical cord mesenchymal stem cells[J]. Differentiation,96:30-39. doi:10.1016/j.diff.2017.07.001.
Yu Y B,Song Y,Chen Y,Zhang F,Qi F Z. 2018. Differentiation of umbilical cord mesenchymal stem cells into hepatocytes in comparison with bone marrow mesenchymal stem cells[J]. Molecular Medicine Reports,18(2):2009-2016. doi:10.3892/mmr. 2018.9181.
(責任编辑 兰宗宝)
