深圳市408份不同来源样本弯曲菌的检测及耐药特征分析
2021-11-03马艳萍鞠长燕段永翔何娇明马佳智俞慕华张茂俊
马艳萍,鞠长燕,刘 敏,段永翔,何娇明,马佳智,俞慕华,张茂俊
弯曲菌为人兽共患病原菌,广泛寄生于畜禽类动物以及人类的肠道内。大部分弯曲菌感染可引起人类急性腹泻性肠炎,特异菌型菌株的感染会引起格林巴利综合征、反应性关节炎等严重并发症[1]。在欧美等发达国家弯曲菌感染导致的肠炎占首位,弯曲菌的感染现状已经超过临床上常见肠道致病菌(沙门氏菌、大肠杆菌、副溶血性弧菌等),弯曲菌同时也是这些发达国家食源性病原菌感染的主要监测病原菌[2]。
我国以前使用传统方法分离弯曲菌,检出率很低。2016年开始使用滤膜法进行弯曲菌的分离培养,分离率大幅提高[3-4]。北京顺义地区腹泻病人弯曲菌的分离率由2014—2016年0%增加到10.48%[4]。2016年深圳地区禽肉和腹泻病人空肠弯曲菌分离率分别为40.7%和5.5%[3,5],但目前国内外蔬菜、海鲜的弯曲菌检出少见报道。
2019年本课题组应用过滤法对深圳市腹泻病人,鸡肉、鸡盲肠、牛肉、猪肉、生菜和海鲜7种不同来源样本进行弯曲菌的流行与耐药特征分析,与往年菌株的耐药特征进行比对,获得深圳地区弯曲菌的流行现状及耐药变化。
1 材料与方法
1.1 实验材料
1.1.1 样品来源 本课题组从2019年6—9月共收集不同来源样本408份,包括腹泻病人159份、鸡肉69份、鸡盲肠50份、牛肉30份、猪肉30份、生菜31份和海鲜39份。
1.1.2 试剂与仪器 弯曲菌检测试剂盒(ZC-CAMPY-001,青岛中创生物科技有限公司),弯曲菌琼脂稀释法抗生素最低抑菌浓度(MIC)检测试剂盒(ZC-CAMPY-013,青岛中创生物科技有限公司),弯曲菌琼脂基础(Karmali)(Oxoid公司),弯曲菌 (食源性弯曲菌属、空肠弯曲菌、结肠弯曲菌、红嘴鸭弯曲菌) 四重核酸检测试剂盒(荧光PCR法)(深圳生科源有限公司),4950E三气培养箱(NUAIRE公司),CFX96 Touch 荧光定量PCR仪(BIO-RAD公司),全自动核酸提取工作站(罗氏公司)。
1.2 方 法
1.2.1 样品采集
1.2.1.1 病人纳入标准 执行WS271-2007《感染性腹泻诊断标准》中感染性腹泻诊断依据。取绿豆大小的粪便放入粪便样本采集液,2 h内送回实验室。
1.2.1.2 肉类样本及生菜样本 称取样本250 g放于一次性无菌密封袋中,取出试剂盒中的BPW缓冲液,稀释10倍后适量加入到袋中淹没样品反复揉搓,充分漂洗后,放4 ℃过夜。
1.2.1.3 鸡盲肠样本 从屠宰场用无菌密封袋收集鸡整个肠部,2 h送回实验室,在实验室用无菌镊子剪下鸡盲肠部分,加入到稀释10倍的BPW缓冲液。
1.2.2 增菌及分离 按照试剂盒说明书,吸取1 mL样本采集液或漂洗液加于4 mL促生长增菌液中,37 ℃微需氧(5% O2,10% CO2,85% N2)培养24 h,吸取600 μL滴加双孔板(Karmali和哥伦比亚血平板)的滤膜上,约1 h后揭去滤膜,翻转平板,置于微需氧环境37 ℃培养24 h。
1.2.3 四重PCR检测和鉴定 用接种环刮取双孔板上单菌落纯培养(至少挑取5个),DNA核酸提取采用Roche机器提取试剂盒。采用弯曲菌四重荧光PCR检测试剂盒进行弯曲菌的鉴定。
1.2.4 药敏方法 药敏试验采用琼脂稀释法为基础的试剂盒,成品试剂盒将11种含有不同浓度抗生素的MH琼脂包被到96孔板中,获得弯曲菌的最小抑菌浓度(MIC)。质控菌株为本实验室保存的空肠弯曲菌(ATCC33560)。采用2014年美国国家耐药监测中心(National Antimicrobial Resisitance Monitoring System, NARMS)(http://ars.usda.gov/Main/docs.htm.docid=6750)细菌耐药标准来判断弯曲菌的敏感、中介、耐药。弯曲菌菌株对三类及三类以上抗生素耐药特征为多重耐药性。
1.3 结果分析 采用SPSS 22.0进行统计学分析,使用χ2检验进行组间计数资料的比较,检验水准α=0.05。
2 结 果
2.1 弯曲菌的分离情况与流行病学分析 采集408份不同来源的样本,不同来源样本的分离率见表1,其中鸡盲肠的弯曲菌阳性率最高,达72.0%(36/50),鸡肉的分离率次之,为49.3%(34/69)。腹泻病人弯曲菌分离率为10.7%(17/159)。牛肉、猪肉弯曲菌分离率低,海鲜中分离到1株空肠弯曲菌,生菜未分离到弯曲菌。

表1 不同来源样本弯曲菌分离数及阳性率Tab.1 Number and positivity rates of Campylobacter isolated from different samples
共采集腹泻病人粪便样本159份,弯曲菌阳性率为10.7%(17/159)。17株弯曲菌中,空肠弯曲菌13株,结肠弯曲菌2株,简明弯曲菌2株。弯曲菌阳性病例临床表现主要为腹泻,其中糊状便占76.5%(13/17),水样便占17.6%(3/17),成型便占5.9%(1/17)。腹泻病人不同年龄组存在差异,46岁以上年龄组弯曲菌阳性率(27.8%)高于10~45岁年龄组(7.9%),差异有统计学意义(χ2=4.352,P=0.037)。
2.2 菌株抗生素敏感性特征 13株腹泻病人和40株鸡源空肠弯曲菌菌株耐药结果见表2。2种来源空肠弯曲菌菌株对萘啶酸、环丙沙星和四环素的耐药率均高于90%。值得注意的,2种来源空肠弯曲菌菌株对氟苯尼考的耐药率均高于75%。空肠弯曲菌的总体耐药梯度为喹诺酮类、四环素、氯霉素类、林可酰胺类、大环内酯类、氨基糖苷类。53株空肠弯曲菌菌株有39株存在多重耐药性(11株人源,28株鸡源),其中有8株(人源2株,鸡源6株)空肠弯曲菌对11种抗生素全部耐药。腹泻病人来源和鸡源空肠弯曲菌常见的耐药谱为萘啶酸-环丙沙星-四环素-氟苯尼考,耐药率分别为69.2%(9/13)和65%(26/40),差异无统计学意义(χ2=0.000,P=1.000)。

表2 13株腹泻病人和40株鸡源空肠弯曲菌菌株耐药结果Tab.2 Drug resistance of 13 patients with diarrhea and 40 Campylobacter jejuni strains from chickens
2株腹泻病人和30株鸡源结肠弯曲菌菌株耐药结果见表3。32株结肠弯曲菌菌株对萘啶酸、环丙沙星和四环素全部耐药。值得注意的是,32株结肠弯曲菌对氟苯尼考的耐药率高达62.5%(20/32)。32株结肠弯曲菌菌株全部存在多重耐药性,其中4株鸡源结肠弯曲菌对11种抗生素全部耐药。

表3 2株腹泻病人和30株鸡源结肠弯曲菌菌株耐药结果Tab.3 Drug resistance results of two strains of Campylobacter coli isolated from patients with diarrhea and 30 strains from chickens

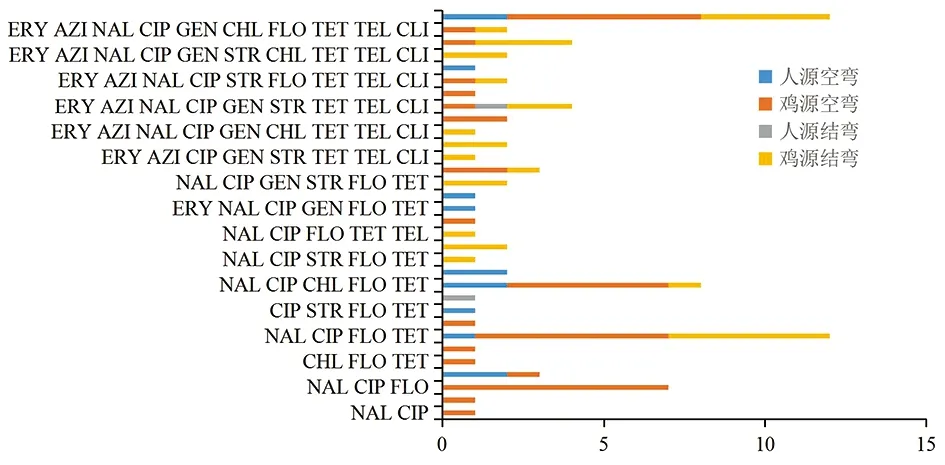
注:ERY:红霉素;AZI:阿奇霉素;NAL:萘啶酸;CIP:环丙沙星;GEN:庆大霉素;STR:链霉素;CHL:氯霉素;FLO:氟苯尼考;TET:四环素;TEL:泰利霉素;CLI:克林霉素。图1 2种来源弯曲菌的耐药谱Fig.1 Drug resistance spectrum of Campylobacter from two sources
2.3 与往年弯曲菌的流行及耐药特征的比对分析 2019年腹泻病人来源空肠弯曲菌分离率和2016年(5.3%,23/437)差别无统计学意义(χ2=1.743,P=0.187)。2019年鸡肉来源空肠弯曲菌分离率和2016年(36.5%,23/63)差别无统计学意义(χ2=0.313,P=0.576)。
2019年腹泻病人分离的空肠弯曲菌菌株萘啶酸-环丙沙星-四环素-氟苯尼考多重耐药(69.2%,9/13)高于2016年(30.4%,7/23),差异有统计学意义(χ2=5.063,P=0.024)。

3 讨 论
污染的禽畜类动物是人类弯曲菌感染的主要来源[6]。本研究中,深圳地区鸡肉与鸡盲肠中弯曲菌检出率较高,为49.3%和72%,牛肉、猪肉、生菜和海鲜中弯曲菌的检出率较低(≤3.3%)。2020年Zbrunab等[7]的meta分析表明鸡是弯曲菌的主要传染源,与本研究结果一致。2016年本课题组鸡肉、牛肉中空弯曲菌检出率分别为36.5%、1.1%[3]。四川省鸡盲肠、江苏省、山东省青岛市鸡肉弯曲菌检出率分别为56.1%、46.7%、34.66%[8-10]。西班牙北部鸡肉、鸡粪弯曲菌检出率分别为35.4%、62%[11]。上述国内外鸡肉和鸡粪(鸡盲肠)中弯曲菌检出均低于本研究,说明深圳地区鸡源弯曲菌污染严重,且呈递增趋势。深圳地区猪源弯曲菌污染(3.3%,1/30)低于中国东部地区(19.3%,333/1 726)[12]。弯曲菌在法国某海岸线的贝类样品中检出率为26.6%[13]。本研究深圳地区生菜中未检出弯曲菌,39份海鲜样品检出1株空肠弯曲菌,中国其他地区生菜和海鲜样品弯曲菌的检出率未见报道。
2019年腹泻病人空肠弯曲菌分离率(8.2%)与2016年(5.3%)进行比较,空肠弯曲菌分离阳性率增加,但差异无统计学意义(χ2=1.743,P=0.187)。鸡源空肠弯曲菌的差异也无统计学意义,说明2016—2019年3年深圳地区腹泻病人和鸡源空肠弯曲菌的感染无明显变化。2017—2018年北京地区腹泻人群中弯曲菌的检出率为7.81%[14],与本研究差别无统计学意义。值得注意的是,深圳地区46岁以上年龄组弯曲菌分离率(27.8%)高于(10~45岁)年龄组(7.9%),这与2017年北京顺义地区(弯曲菌感染以16~30岁病例居多,达14.5%)[4]和加纳地区弯曲菌的分离(以10~29岁年龄组为主,为34.3%)[15]有差异,说明弯曲菌的感染存在地区和年龄差异。
印度地区鸡盲肠来源弯曲菌耐药从高到低依次为喹诺酮类(>90%)、四环素(39.3%)、红霉素(13.4%),而对氯霉素、链霉素和庆大霉素敏感(耐药<2%)[16]。本研究鸡源弯曲菌对抗生素的耐药率除喹诺酮类和四环素高于90%,其他几种抗生素耐药率均高于30%。说明深圳地区弯曲菌耐药现象比印度地区更严重。2019年鸡源空肠弯曲菌对红霉素、阿奇霉素、泰利霉素和克林霉素的耐药高于2016年,且腹泻病人分离的空肠弯曲菌对萘啶酸-环丙沙星-四环素-氟苯尼考多重耐药(69.2%,9/13)高于2016年(30.4%,7/23)。说明深圳地区弯曲菌耐药现象增强,且存在多重耐药现象,尤其大环内酯类抗生素作为一线抗菌药物[17],耐药性也在增加,应引起广大部门的注意。
本研究腹泻病人来源弯曲菌对氟苯尼考抗生素存在高耐药性(空肠弯曲菌为76.9%,结肠弯曲菌为50.0%)。北京顺义地区腹泻病人来源空肠弯曲菌、结肠弯曲菌对氟苯尼考耐药率分别为46.05%和0[18]。RE-Cme ABC外排泵可能是导致近几年氟苯尼考在禽畜空肠弯曲菌高耐药的原因[19]。氟苯尼考一直在禽畜中使用,但在人源中也有较高的耐药率,需要进一步研究其在人源中产生耐药的原因。
