菲对融合菌株F14胞外聚合物特征的影响
2021-11-03刘怡暄王舒淇吕岳骏高于涵
刘怡暄,高 乔,王舒淇,吕岳骏,高于涵,汪 杰,侯 彬,卢 静
(中北大学环境与安全工程学院,山西 太原 030051)
0 引言
多环芳烃 (Polycyclic Aromatic Hydrocarbons,PAHs)是指2 个以上苯环以稠环形式相连的有机化合物,它普遍存在于环境中,性质稳定,难于降解,且具有潜在的致畸性、致癌性和致突变性[1]。环境中PAHs 的主要来源于人类活动,如废物、化石燃料和其他碳氢化合物的不完全燃烧、工业生产、食品加工过程以及原油的泄漏等[2]。菲作为PAHs 中的一种重要污染物,常被用于对PAHs 的实验研究。微生物修复技术因其操作较为简单,修复效果好,对环境影响微弱,几乎无二次污染等优点,越来越受到专家学者的关注,成为去除PAHs 的主要途径。
微生物在新陈代谢过程中,分泌出一种附着于微生物表面及周围环境的高分子聚合物质,称为胞外聚合物(Extracellular Polymertic Substances,EPS)。它主要由多糖和蛋白质构成(两者在EPS 成分中占比为70% ~ 80%),除此之外还包含少量的核酸、腐殖酸等[3-4]。张颖等[5]在研究Arthrobacter sp.JQ-1 菌株胞外聚合物对不同浓度酞酸酯类化合物的吸附规律时,发现微生物的EPS 表面有非极性官能团,其中包括蛋白质中的脂肪族化合物、芳香族化合物及多糖中的疏水区域,这些组分参与了微生物对酞酸酯类化合物的降解过程。PAN Xiang-liang 等[6]研究表明,好氧活性污泥产生的EPS 和菲之间的作用是自发进行的,它们之间的结合主要依靠于疏水作用。LIU An-bo 等[7]研究表明,细菌产生的EPS 可促进土壤中菲进行解吸过程。甄凯等[8]研究表明,Seudomonas sp.DNBe-S1 产生的EPS 可促进土壤中苯并芘的降解。
融合菌株F14 是以菲降解菌Sphingomonas sp.GY2B 和芘降解菌Pseudomomas sp.GP3A 为亲本,通过原生质体融合技术构建的一株高效降解多环芳烃的降解菌[9]。与亲本相比,该菌株具有更广的温度(20 ~40 ℃)和pH 值适应范围(6.5 ~9),对菲的降解效率更高,而且具有和亲本GY2B 不同的菲降解途径,融合菌株F14 具有2 条菲代谢途径并且在降解过程中较少积累有毒中间代谢产物。
基于此,通过系统研究不同浓度菲诱导下对融合菌株F14 胞外聚合物 (Extracellular Polymertic Substances,EPS)的影响,包括EPS 中蛋白质和多糖含量的变化、对降解效率与荧光性能的影响,并通过FTIR 和SEM 进一步分析了EPS 表面官能团的变化和微观形貌的变化,阐示融合菌株F14 降解菲的作用机理,为融合菌株F14 实地修复菲污染提供科学依据和理论支持。
1 材料与方法
1.1 实验材料及样品
研究使用的菲(浓度为98%)、甲醇(色谱纯)、正己烷(分析纯)、二氯甲烷(色谱纯)等试剂,均购自上海阿拉丁生化科技股份有限公司,其余试剂无特殊说明均为分析纯。
无机盐基础培养液(MSM):分别取5 mL 磷酸盐缓冲液 (KH2PO4,8.5 g/L;K2HPO4·H2O,21.75 g/L;Na2HPO4·12H2O,33.4 g/L;(NH4)Cl,5.0 g/L)、3 mL MgSO4溶液(22.5 g/L),1 mL CaCl2溶液(36.4 g/L),1 mL FeCl3溶液 (0.25 g/L),1 mL 微量元素(MnSO4·H2O,39.9 mg/L;ZnSO4·H2O,42.8 mg/L;(NH4)6Mo7O24·4H2O,34.7 mg/L),然后加入超纯水定容至1 L,调节培养基pH 值为6.8,在121 ℃高压灭菌锅中灭菌20 min 后备用。
含有菲的无机盐培养液(质量浓度分别为0,60,100,230 mg/L):在灭菌的三角瓶中加入不同量的菲标准储备液(5 g/L,正己烷为溶剂配制),待正己烷挥发完毕,加入灭菌后的MSM。
实验菌种:融合菌株F14 利用原生质体融合技术融合而成[9]。
1.2 菲对融合菌株F14 的驯化
按照10% 的接种量,将融合菌株F14 菌液接种到含有不同质量浓度(0,60,100,230 mg/L)菲的无机盐培养液(总体积为30 mL)中,将其置于30 ℃、转速为120 r/min 的摇床培养箱中,培养24 h 后,提取EPS。
1.3 融合菌株F14 的EPS 的提取
采用加热法提取EPS。首先,取30 mL 融合菌株F14 菌液,于转速为2 000 r/min 低温冷冻离心机中离心10 min,丢弃上清液,补充无菌水至原体积,再于转速为2 000 r/min 离心3 min,丢弃上清液,补充无菌水至原体积,将上述步骤重复2 次。然后,将获得的溶液放入水浴锅(60 ℃)加热30 min,再次放入离心机中,于8 000 r/min 转速下离心15 min,最后将收集的上清液经0.22 μm 滤膜过滤,即为EPS 溶液。同时将部分溶液在低温冷冻干燥机中干燥24 h,所得粉末用于后续检测[10]。
1.4 驯化后的EPS 降解菲
取0.2 mL 质量浓度为5 g/L 菲的储备液于三角瓶中,待正己烷挥发后,分别加入10 mL 上述提取的EPS 溶液,对照组为10 mL 水,用保鲜膜密封,置于30 ℃、转速为120 r/min 摇床中震荡24 h 后取样。每组试验设3 组平行,并将其进行编号,菲质量浓度分别为0,60,100,230 mg/L,对应编号为a,b,c,d,对照组编号为0。
1.5 分析方法
1.5.1 EPS 主要成分分析
采用考马斯亮蓝法测定蛋白质;采用蒽酮-硫酸分光光度计法测定多糖[11]。
1.5.2 菲的提取及含量测定
采用液相萃取法提取菲,首先向样品中加入等体积的二氯甲烷,振荡5 min(30 ℃,转速为180 r/min),随后全部转移至分液漏斗,待静置分层后,将下层有机相放入烧杯,上述步骤重复3 次。再使用氮气吹脱仪将溶液吹至近干,最后过0.22 μm 有机滤膜后全部移入进样瓶中,并用甲醇定容。
使用岛津高效液相色谱(HPLC(20A))测定菲的剩余量,并计算菲的降解率。
1.5.3 EPS 三维荧光光谱分析
将提取出来的EPS 溶液进行三维荧光测定,分析不同浓度菲诱导后产生的EPS 蛋白峰的变化情况。
1.5.4 EPS 傅里叶红外光谱分析
取冻干后的EPS 粉末,使用红外光谱仪(Thermo Scientific Nicolet iS5)采用KBr 压片法进行测试,分析不同浓度菲诱导后产生的EPS 主要成分及官能团变化。
1.5.5 EPS 形貌特征分析
利用扫描电镜(ZEISS MERLIN Compact)观察不同浓度菲诱导后产生的EPS 表面形貌变化。
2 结果与分析
2.1 不同浓度菲诱导EPS 成分的变化
不同浓度菲诱导产生EPS 成分的变化见图1。菲对融合菌株F14 的EPS 的产生及成分变化有一定影响。当菲质量浓度由0 mg/L 增至230 mg/L 时,EPS 中的蛋白质和多糖呈先增后减的变化规律。当菲质量浓度为0 mg/L 时,EPS 中多糖含量大于蛋白质含量,当菲质量浓度由0 mg/L 增至100 mg/L 时,蛋白质和多糖均有不同程度的增加,推断原因可能是融合菌株F14 为抵御外界不利因素的影响,提高其耐受性,分泌了大量的EPS。当菲质量浓度为100 mg/L 时,蛋白质和多糖的浓度分别达到最大值。而当菲质量浓度达到230 mg/L 时,蛋白质和多糖的含量均降低,这说明过高浓度的菲会对微生物产生毒性,从而抑制其生长,进而影响EPS 的分泌。简静仪等[12]研究发现,随着加入Zn2+和Cu2+浓度的增加,死谷芽孢杆菌(Bacillus vallismortis)产生的EPS 呈增加趋势,且不同种类的重金属,胁迫后产生的EPS 成分变化也存在明显差异。唐蕊等[13]也在不同浓度的苯并[a]芘驯化毛霉的实验中,发现随着污染物浓度的增加,EPS 中的多糖和蛋白质含量呈先增后减的趋势。
2.2 不同浓度菲诱导对EPS 降解能力的影响
融合菌株F14 产生的EPS 对菲也有一定的降解作用,降解效果见图2。由图2 可以看出,随着时间的变化,不同浓度菲诱导后EPS 对菲的降解率均呈先高后低的趋势,12 h 时降解率达到最大值,且菲的诱导质量浓度为100 mg/L 时,EPS 的降解效果最好。林治岐等[14]提出EPS 对菲有吸附,主要是通过EPS 中的疏水区与菲发生疏水作用。JIA Chan-yan等[15]通过对Zoogloea sp.和Aspergillus niger 产生的EPS 对土壤中芘降解效果的研究发现,EPS 对芘的降解,前期是在EPS 与芘之间的相互疏水作用下,两者结合在一起,随后EPS 中的酶参与了芘的降解过程。在12 h 内,不同浓度菲诱导后的EPS 降解率均有升高,但是随着时间的变化,降解率逐渐降低,推断原因可能是EPS 降解菲的过程中,先将菲吸附在EPS 表面的吸附位点上,后再由EPS 中的酶进行降解,但是酶的产量不足以将吸附位点上的菲完全降解,随着时间的变化,未降解的菲又逐渐回到溶液中,从而导致EPS 降解率降低。在24 h 时,质量浓度为0 mg/L 的菲诱导后的EPS 降解效率明显高于菲的质量浓度分别为60 和230 mg/L 的菲,推断原因可能是EPS 在前期诱导过程中已与菲结合,使得EPS 表面吸附位点减少,且消耗了部分蛋白酶,从而导致生物吸附能力降低。而当菲的诱导质量浓度为230 mg/L 时,降解效果减弱,推断原因可能是过高浓度的菲会抑制微生物的生长,影响EPS 的产生。综上所述,经过菲诱导后的EPS 降解效果会提高,且菲的质量浓度为100 mg/L 时降解效果最佳。
2.3 不同浓度菲诱导下对EPS 三维荧光光谱的影响
不同浓度菲诱导产生的EPS 三维荧光的图像见图1。
不同浓度菲诱导产生的EPS 三维荧光的分析结果见表1。
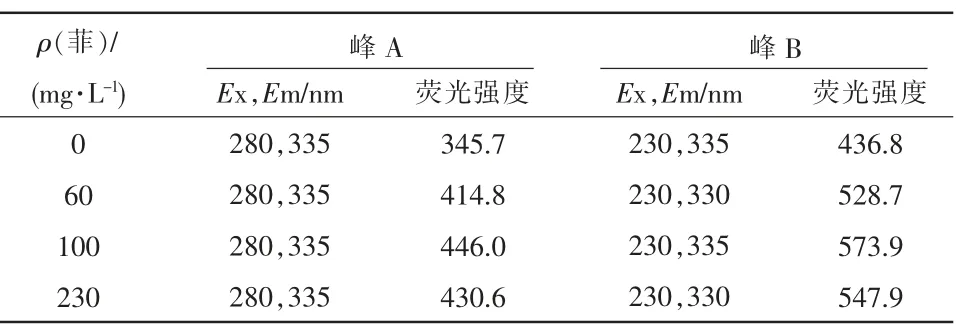
表1 不同浓度菲诱导下EPS 三维荧光光谱分析结果
由表1 可以看出,峰A 为酪氨酸蛋白峰:Ex,Em=280,335 nm;峰B 为色氨酸蛋白峰:Ex,Em=230,(330~335)nm。这2 个峰在菌体形成聚集体和稳定结构的过程中发挥了重要作用[16],且与EPS 中的芳香环氨基酸结构有关[17]。
由图3 和表1 可以看出,当菲质量浓度由0 mg/L增至100 mg/L,蛋白峰强度逐渐增强,色氨酸和酪氨酸的含量也逐渐增加,这说明菲对融合菌株F14 产生胞外蛋白起到了显著的促进作用。当菲质量浓度为100 mg/L 时,峰A 和峰B 强度达到最大,分别为446.0 和573.9;当菲质量浓度由100 mg/L 增至230 mg/L 时,蛋白峰强度明显减弱。分析原因可能是菲处于低浓度时,不易与菌体充分接触,菌体可利用的能源物质较少,影响菌体的生长代谢。随着菲浓度的增加,菌体的代谢增强,分泌出胞外蛋白增多,所以蛋白峰明显增强,但是菲浓度过高则会影响菌体正常分泌胞外蛋白,从而导致蛋白峰减弱。随着菲的加入,EPS 的蛋白峰强度发生了变化,直接影响了EPS对菲的降解作用。ZHU Liang 等[18]在对不同种类污泥的EPS 提取过程中发现,酪氨酸和色氨酸蛋白峰强度发生了改变,这表明蛋白质在生物代谢降解过程中起到了主要作用。ZHANG Jing 等[19]得出结论,1-羟基芘能与牛血清蛋白中的色氨酸残基发生键合作用。
2.4 不同浓度菲诱导下对EPS 红外光谱的影响
为确定不同浓度菲诱导产生EPS 官能团的差异,对EPS 进行了FTIR 光谱分析,结果见表2 和图4。由表2 和图4 可以看出,4 000 到1 000 cm-1之间的吸收峰能够反映出EPS 的基本组成部分,主要是蛋白质和多糖[20]。3 400 ~ 3 200 cm-1区间的吸收峰强而宽,可归属为O-H 拉伸振动和蛋白质的N-H键伸缩振动吸收峰;位于1656.51 cm-1处的酰胺(O=CN-H)Ⅰ带(1 700~1 600 cm-1),是蛋白质功能组中具有代表性的重要部分,属于C=O 伸缩振动;位于1 550.97 cm-1处的酰胺Ⅱ带(1 600~1 500 cm-1),是N-H 弯曲振动和C-N 拉伸振动的耦合产生;羧基的C=O 和C-O 伸缩振动峰分别出现在1 403.28 和1 243.65 cm-1;位于1 104.53 cm-1处的是多糖(1 200~1 000 cm-1)的O-H 和C-O-C 的伸缩振动。

表2 FTIR 观察到的不同浓度菲诱导下EPS 主要基团

图4 不同浓度菲诱导下EPS 红外光谱
对比可知,3 378.33 cm-1处的吸收峰发生了轻微移动且峰强度明显减弱,推断原因可能是N-H 键和O-H 键参与了对菲的降解过程。1 656.51 cm-1处的酰胺Ⅰ带诱导前是较为尖锐的吸收峰,诱导后,峰的强度先增强后减弱,推断原因可能是低浓度的菲刺激生成了蛋白质,而后随着菲浓度的增加,菲与EPS的接触更加紧密,蛋白质中的C=O 参与了降解过程。多糖区的吸收峰诱导后发生轻微移动,峰的强度也有所变化,说明在融合菌株F14 降解菲时,EPS 中多糖上的O-H 和C-O-C 键参与了反应。
很多资料表明,由于EPS 含有大量的负电荷官能团如羧基、羟基等,对有机污染物有很强的吸附能力[21]。通过对红外光谱图的分析可知:在融合菌株F14 降解菲的过程中,主要起作用的基团是羟基、氨基、酰胺基团和C-O-C 基团。
2.5 不同浓度菲诱导对EPS 形貌特征的影响
不同浓度菲诱导后EPS 的形貌变化情况见图5。由图5(a)可以看出,EPS 呈薄片状,且有明显的孔隙结构,随着菲浓度的增加,孔隙在逐渐变小,表面厚度增大,变得光滑圆润,结构密实,这说明为更好的保护菌体,避免菲的不利影响,促进了EPS 的大量产生。WIENS J R 等[22]研究表明:部分金属离子可以促进大肠杆菌、绿胳杆菌等微生物分泌大量的蛋白质与多糖。NIELSEN 等[23]认为微生物主要是利用松散结合型胞外聚合物(LB-EPS)和紧密结合型胞外聚合物(TB-EPS)来吸附有机物,与有机物结合后,EPS 会打破原有结构。由图5(d)可以看出,EPS表面的孔隙数明显减少,这不利于与菲的结合,降解效果会减弱。

图5 不同浓度菲诱导后EPS 扫描电镜
3 结论
(1)随着菲诱导浓度的增加,融合菌株F14 产生的EPS 中蛋白质和多糖均呈先大后减的变化趋势,且当菲诱导质量浓度为100 mg/L 时达到最大,推断原因可能是融合菌株F14 为抵御外界不利因素的影响,提高其耐受性,分泌了大量的EPS,但随着浓度的不断增加,毒性加大,抑制其生长。
(2)随着时间的变化,经不同浓度菲诱导的EPS降解率均呈先高后低的趋势,这说明在融合菌株F14 降解菲的过程中,EPS 先是通过疏水作用与菲结合,随后再利用产生的酶参与降解过程。菲的诱导有利于提高EPS 的降解效果,且质量浓度为100 mg/L 时降解效果最佳,在12 h 时,降解率达到最大值。
(3)在融合菌株F14 降解菲的过程中,EPS 中的蛋白质和多糖参与了反应,羟基、氨基、酰胺基团和C-O-C 基团也发挥了重要作用。
(4)随着菲诱导浓度的增加,EPS 的孔隙逐渐变小,表面也变得光滑密实,EPS 原有结构也发生变化,推断原因可能是为有效阻止菲的污染,分泌了大量物质,但浓度过高,孔隙会明显减少,不利于吸附降解,从而降解效果减弱。
