PD-1/PD-L1抑制剂致1型糖尿病不良反应文献分析
2021-11-03谢婷婷
刘 慧,谢婷婷,刘 源,杨 柳
(1 河南省商丘市第一人民医院药学部,商丘 476900;2 解放军总医院医疗保障中心药剂科,北京 100853;3 河南省周口市商水县人民医院药剂科,周口 466100)
近年来免疫疗法为恶性肿瘤患者带来了福音,改变了传统的肿瘤治疗方法。常见的免疫抑制剂包括细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂、程序性死亡受体-1/配体-1(programmed death-1/ligand-1,PD-1/PD-L1)抑制剂[1]。PD-1/PD-L1抑制剂主要作用机制是阻断PD-1/PD-L1信号通路、活化T细胞功能、增强免疫、提高免疫细胞对肿瘤细胞的杀伤作用。然而,活化的T细胞也会攻击正常组织,导致自身抗体和细胞因子的增加,从而诱发自身免疫炎症,产生一系列免疫治疗相关不良反应(immune-related adverse events,irAEs)。PD-1/PD-L1抑制剂在恶性肿瘤的治疗中有广阔的使用前景,但因一些正常细胞也存在PD-1/PD-L1受体,致使PD-1/PD-L1抑制剂成为一把“双刃剑”。当PD-1/PD-L1抑制剂与正常细胞受体的结合被阻断时,正常细胞会受到免疫细胞攻击而出现免疫相关不良反应,全身所有脏器均可受累,有时甚至危及生命。由PD-1/PD-L1抑制剂治疗引发的1型糖尿病(type 1 diabetes mellitus,T1DM)是相关并发症的一种,发生率不足1%,但是一旦发生后果较为严重,可致糖尿病酮症酸中毒(diabetic ketoacidosis,DKA),严重者甚至可导致死亡[2]。目前,国内被批准上市的PD-1/PD-L1抑制剂有纳武利尤单抗、帕博利珠单抗、阿替利珠单抗、信迪利单抗、卡瑞利珠单抗及特瑞普利单抗,且国内外已有PD-1/PD-L1抑制剂致T1DM的相关报道。为了解PD-1/PD-L1抑制剂致T1DM发生的特点,本研究检索PD-1/PD-L1抑制剂致T1DM的国内外文献,对病例进行分析总结,以期为临床安全合理用药提供参考。
1 资料与方法
1.1 资料来源
检索Medline、PubMed、Springer数据库、中国知网(CNKI)、万方数据库和维普中文科技期刊数据库(VIP)所有文献,中文以PD-1、PD-L1、纳武利尤单抗、帕博利珠单抗、阿替利珠单抗、信迪利单抗、卡瑞利珠单抗、特瑞普利单抗和糖尿病为检索词;英文以nivolumab和diabetes、pembrolizumab和diabetes及atezolizumab和diabetes为检索词。检索出应用PD-1/PD-L1抑制剂引起T1DM的相关文献,并逐篇查阅原文,剔除重复报道或病例来源于同一篇的文献、综述以及描述不详细的临床报道。共得到符合条件的个案报道41篇,共计47例患者。
1.2 统计学方法

2 结果
2.1 患者性别与年龄分布
47例患者中,男性26例,女性21例;年龄范围31~83岁,平均年龄(62.83±11.47)岁。
2.2 瘤种与药物分布
47例患者中,食管癌患者1例、黑色素瘤患者21例、肺癌患者17例、肾癌3例、尿路上皮癌1例、胆管癌1例、霍奇金淋巴瘤1例、上颌窦癌1例、Merkel细胞癌1例。纳武利尤单抗使用者29例、帕博利珠单抗使用者10例、纳武利尤单抗和伊匹单抗联合用药5例、阿替利珠单抗使用者2例、PD-1/PD-L1抑制剂名称不详者1例。见表1。

表1 PD-1/PD-L1抑制剂诱导的T1DM病例汇总
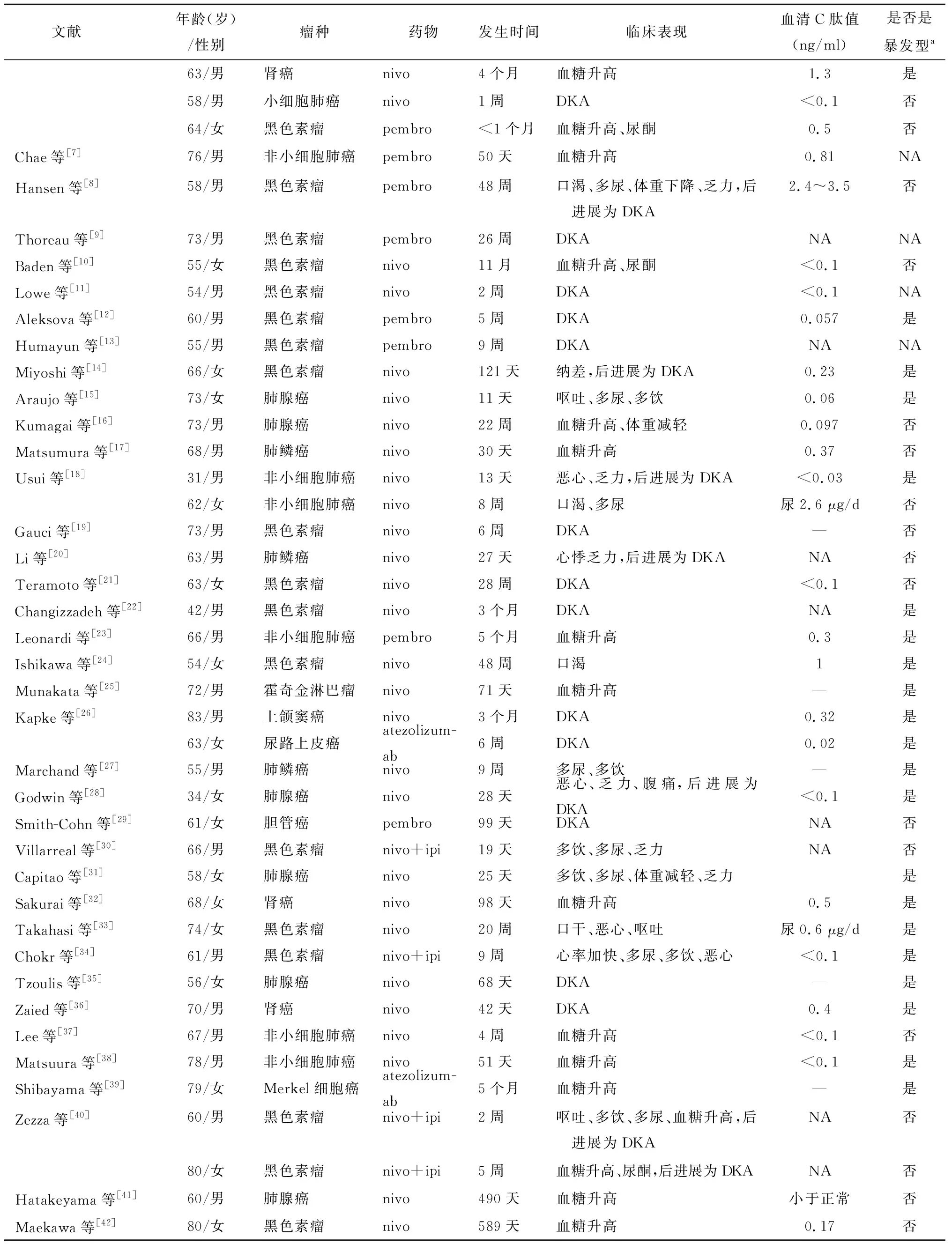
(续表)
2.3 T1DM发生的时间与症状分布
47例患者中出现T1DM的时间范围为1~85周,平均时间为11周左右。初期发生以呕吐、恶心、多尿、多饮、口渴和血糖升高等症状为主,其中25例患者出现DKA,17例患者出现不同程度的血糖升高症状。
3 讨论
在肿瘤免疫应答中,PD-1/PD-L1通路能够抑制T细胞活化,诱导淋巴细胞凋亡,维持自身免疫耐受。在肿瘤微环境中,肿瘤细胞通过其高表达PD-L1与肿瘤细胞表面PD-1结合,抑制淋巴细胞的功能,从而逃脱免疫系统的监视和杀伤。PD-1/PD-L1抑制剂阻断了上述抑制性信号通路,增强了T细胞免疫应答,起到抗肿瘤作用。PD-1/PD-L1抑制剂在增强T细胞抗肿瘤功能的同时也会产生免疫应答介导的毒副作用。
本文共统计47例PD-1/PD-L1抑制剂诱导的T1DM患者,年龄在31~83岁,男性26例,女性21例,中位发生时间为11周(1~85周),其中48.9%(23/47)的患者诊断为FT1DM(表1),按照现有的诊断标准,目前已知T1DM急性发生率为9.4%~12.6%,远低于使用PD-1抗体治疗后的发生率。这提示PD-1/PD-L1抑制剂诱导的T1DM患者β细胞损害更快且更严重,需要紧急的医疗干预。
因PD-1/PD-L1抑制剂诱导的T1DM是较为罕见的不良反应,其早期识别很重要。T1DM中位发生时间为11周(1~85周),与免疫抑制剂相关的胃肠道反应发生时间重叠。因此,当患者出现恶心和呕吐等症状时并不能引起临床医生的足够重视。尽管定期监测血糖水平可能是有效的筛查策略,但从表1中可见初发症状表现为血糖升高的T1DM仅为31.91%,而68.09%的患者是因血糖升高之外的症状起病。有学者认为动态监测C肽水平是预见T1DM的有效手段。在47例患者中只有1例患者发病时C肽处于正常水平[8],其他患者C肽均低于正常值或无法检出。因此,对于患者自身抗体的监测是用于鉴别糖尿病分型的重要指标。
《中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南》指出[43],对于PD-1/PD-L1抗体引起的免疫相关不良反应是因免疫激活引起的,因此糖皮质激素被认为是治疗这些不良反应的首选策略,可抑制过度的免疫反应。而对于免疫抑制剂诱导的T1DM是否使用激素治疗仍有待商榷。笔者不推荐大剂量激素冲击治疗,因为糖皮质激素可升高血糖,可能会使T1DM的治疗复杂化。目前对于免疫抑制剂诱导的T1DM依然推荐按T1DM诊治指南进行管理,包括对患者进行胰岛素治疗、监测血糖、纠正电解质紊乱等措施[44]。
在接受PD-1/PD-L1抑制剂治疗的同时除了关注其疗效外,还要密切关注一切可能发生的不良反应,包括较少见的TIDM和FT1DM,因其发生率较低且部分患者早期以DKA之外的症状起病,不易引起足够的重视,一旦起病则会较为凶险。因此,在治疗前后应动态监测患者糖尿病指标,尤其是C肽的动态变化以便判断胰岛功能情况。在接受PD-1/PD-L1抑制剂治疗的同时,除了关注其疗效外,还要密切关注较少见的T1DM。虽然T1DM发生率较低且部分患者早期以DKA之外的症状起病,但一旦起病会比较凶险,在治疗前后应动态监测患者糖尿病指标尤其是C肽的动态变化,以便判断胰岛功能情况,从而及早预见T1DM的发生。
