发酵葡萄酒中菌种的分离鉴定及糖类耐受性的探究
2021-11-03孙晓璐杨永学
孙晓璐,杨永学,郭 斌,张 源,兰 伟
(1.阜阳职业技术学院 生化工程系 安徽阜阳 236037 2.阜阳师范大学 生物与食品工程学院 安徽阜阳 236037)
葡萄作为目前世界上栽植面积最广、产量最高的水果之一,其副产物葡萄酒也颇受大众欢迎[1]。据统计,中国2012 年的葡萄种植面积为57万hm2,占全球葡萄种植总面积的7.6%[2,3]。多个研究表明,葡萄酒中风味物质主要由葡萄品种、工艺条件产、酿酒微生物几大因素决定[4,5]。确定葡萄品种后,要酿造出风味独特的葡萄酒,酿酒的酵母菌种品种选择在助力发酵中作用就很突出。酿酒酵母具有将果实中的糖代谢得到醇、醛、酯等功能性物质,赋予葡萄酒独特的风味物质[6]。相比酿酒酵母,非酿酒酵母可产生多种酯类[7]、多种酶类(如果胶酶、糖苷酶等)和较多的甘油,进而挥发出独特的香气[8,9]。
研究表明,葡萄产区所酿造出的葡萄酒常具有其地域特色和独特风格[10,11]。薛波等[12]通过对从新疆采集的7 株野生型酿酒酵母分析其酒精、低pH 值、SO2、高浓度葡萄糖耐受性研究发现:该7株野生型新疆酿酒酵母基本都能耐受12%的酒精;当pH=2.5 时,菌株也可以正常生长;当SO2的浓度=250 mg/L 时,野生酿酒酵母也能够继续生长;所有菌株都能够耐受低于50%葡萄糖的浓度;即这7 株具有优良的耐受性和酿酒特性[13]。李艺凡等[14]从红茶菌液中分离出了酵母H8,并且将其与全美梅氏酵母、葡萄有孢汉生酵母按等比例混合培养46 h 后获得了混菌酵母。同时他们还发现该类酵母发酵后含有较多单菌种没有的物质,使得其香气具有独特性[15-18]。郑晓吉等人[19]从新疆第六师葡萄产区的土壤和葡萄皮中分离出127 株酵母菌,并通过分析其综合性耐受性实验获得F12,该菌株能在10~35 ℃、含糖>400 g/L、SO2含量>200 mg/L、乙醇体积分数>15%、含酸量>18 g/L 的葡萄汁中发酵。
目前,大部分研究内容限于在天然或驯化后的酿酒酵母的发酵条件的优化,而对非酿酒酵母的研究不多。本研究通过分离安徽阜阳葡天下所产的葡萄皮中的菌株,并对所分离的菌株进行形态观察和分子生物学鉴定,以获得更适合本地区气候的菌株。通过形态观察和分子生物学鉴定确定葡萄酒发酵体系中非酿酒酵母对香气物质富集与酒品整体风味具有一定影响力,并由此在葡萄酒酿造中引入多菌种发酵新工艺,显示出非酿酒酵母在葡萄酒酿造中的独特作用,丰富了自然发酵体系中非酿酒酵母品种,进一步挖掘非酿酒酵母的价值具有一定意义。
1 材料与方法
1.1 材料与试剂
材料:葡萄采摘于安徽阜阳葡天下。试剂:SanPrep 柱式DNA 胶回收试剂盒SK8191、DNA Ladder Mix maker SM0337、DreamTaq-TM DNA Polymerase EP0702:生工生物工程(上海)股份有限公司;pMD®18-T Vector 连接试剂盒D101A:日本Takara(宝生物)工程有限公司;氯化钠、葡萄糖、EDTA、CTAB、SDS 等其他生化试剂均为市售分析纯。
1.2 培养基
富集培养基:豆芽汁培养基。YPD 培养基:1%酵母浸粉,2%蛋白胨,2%葡萄糖。
1.3 实验方法
1.3.1 菌种富集
将少量葡萄皮加入到100 mL 灭菌的豆芽汁培养基中,并置于25 ℃、100 rpm/min 摇瓶中培养48 h。吸取1 mL 生理盐水进行梯度稀释分别为(10-2、10-3、10-4),再吸取稀释液100 μL 涂布在WL培养基中,进行平行实验3 次,置于30 ℃环境中培养48 h[20-,21]。
待豆芽汁培养液发酵后,吸取200 μL 培养液涂布于WL 培养基中(加青霉素至终浓度100 μg/mL),置于25 ℃环境中培养48~72 h[22]。
1.3.2 分离纯化
将颜色不同的菌落接入YPD 平板,多次划线分离培养,进行分离纯化。
挑取生长良好的单菌落(共计8 个菌落),转入YPD 液体培养基中,12 层纱布封口,置于30 ℃环境并以180 rpm/min 振荡培养,并测定24 h、48 h、72 h 和96 h 的生长速度,以OD600进行计算[23]。
1.3.3 菌株形态观察
通过制作临时装片,于40×的油镜下观察,记录细胞形态特征、细胞大小、出芽情况。置于荧光倒置显微镜下进行采集,得到相关酵母细胞形态图像,进行形态学观察。
1.3.4 菌株DNA 提取和PCR 反应
按照SK8255(细菌)、SK8259(真菌)、SK8257(酵母)试剂盒说明书进行菌株DNA 提取。使用通用引物F(5’-TCC GTA GGT GAA CCT GCG G-3’)和R(5’-TCC TCC GCT TAT TGA TAT GC-3’)扩增。
PCR 循环条件:先置于94 ℃环境中预变性4 min,接着置于94 ℃中45 s 使模板变性,55 ℃中45 s 使引物与模板退火,72 ℃中1 min 使引物在模板上延伸,改反应程度循环30 次,然后置于72 ℃中修复延伸10 min,最后PCR 产物置于4 ℃中终止反应并保存[24,25]。
PCR 产物经1%琼脂糖凝胶电泳20 min,条件为150 V、100 mA。
1.3.5 基因片段的测序与分析
用DNA 胶回收试剂盒(Omega)进行切胶回收得到电泳条带,进行纯化和测序。
1.3.6 构建菌株系统发育树
将上述获得的测序结果录入GenBank 数据库中,利用其提供的Blast 功能进行本次实验测序结果的同源性比对分析。通过Mega 7.0 软件[26]进行构建菌株P1 和菌株P2 系统发育树。
2 结果与分析
2.1 葡萄皮中酵母菌的筛选
利用平板涂布法从自然发酵的葡萄皮中选取样品,进而分离得到单菌落菌株。经培养后平板内逐渐开始出现长势不同的酵母菌。分别在测定其在24 h、48 h、72 h 和96 h 的生长速度如表1 中所示:当培养24 h 时,P2 >P1>P3 >P5 >P4、P6 >P7、P8;当培养48 h 时,P2 >P1 >P3 >P5 >P6 >P4 >P8 >P7;当培养72 h 时,P2 >P1 >P3 >P4 >P5 >P6 >P7 >P8;当培养96 h时,P3 >P1、P5 >P2 >P4、P6 >P7 >P8。相比其他菌株,P1(3.2、6.5、6.8、4.1)、P2(3.4、6.6、7.0、3.9)和P3(2.3、6.3、6.6、4.5)这三个菌株的24 h、48 h、72 h 和96 h 的OD600较高有较好的生长活性。
对该8 株菌株的理化性质进行分析,结果如表2。8 株菌株均可耐受葡萄糖和麦芽糖,但是对于乳糖和蔗糖的耐受结果不同:P2、P4 和P7 可耐受乳糖,但不可耐受蔗糖;P1、P3 和P8 可耐受蔗糖,但不可耐受乳糖;P5 对于乳糖和蔗糖均可耐受;P6 对于乳糖和蔗糖均不可耐受。由于后续实验中为了比较其中的差别,故而选取乳糖阳性而蔗糖阴性和蔗糖阳性而乳糖阴性,且生长速度良好的两株菌株,即P1 和P2。后续形态特征及分子生物学鉴定实验均以P1 和P2 作为研究对象。
2.2 分离菌株形态特征及分子生物学鉴定
2.2.1 菌株的形态特征
经过筛选得到的P1 和P2 这两株菌株在平板上的菌落形态和细胞形态如图1 所示。A1 和A2图所示菌落黄色略带粉色,表面光滑扁平,边缘整齐。通过置于荧光倒置显微镜下(10*40)进行采集观察,B1 和B2 图所示细胞多呈卵圆形,且具有典型的真核细胞结构。
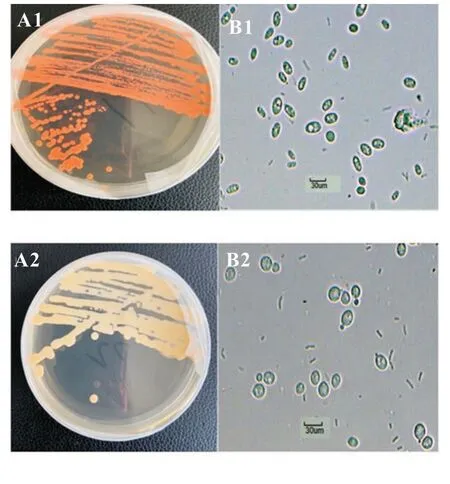
图1 菌株的菌落及细胞形态
2.2.2 基因的分子生物学鉴定
提取P1 和P2 菌株中的DNA,并使用引物来扩增其ITS rDNA,对其PCR 扩增产物进行1%琼脂糖凝胶电泳检测,结果如图2 所示。

图2 PCR 扩增产物电泳结果
由图2 可知,P1 和P2 两株菌株电泳条带不同,但都在ITS rDNA 的PCR 扩增产物条带范围内:P1 扩增产物的片段大小约在1500 bp 左右,P2扩增产物的片段大小约在600 bp 左右,且两株菌株的扩增条带清晰明亮可见,无明显非特异性扩增。因此该PCR 产物可满足后续实验要求。
2.2.3 分离菌株的系统发育树
借助NCBI 中的Blast 功能将本实验中的2株菌株的ITS rDNA 与GenBank 数据库,对菌株的同源性比对进行分析。构建P1 和P2 这两个菌株的系统发育树,系统发育树的结果如图3 所示。P1 和近玫色锁掷孢酵母(Sporidiobolus pararoseus)JN544046.1 为一个分支,P2 和金黄蝶形担孢酵母(Papiliotrema flavescens)MK026970.1 为一个分支。之后使用Bootstrap 检验1000 次随机重复实验以验证上述结果。综合P1 和P2 菌株的菌落及细胞形态观察、PCR 扩增产物电泳结果及系统发育树结果,可发现P1 和P2 这两株菌株按照亲缘关系可分属于2 个种:Sporidiobolus pararoseus JN544046.1:P1;Papiliotrema flavescens MK026970.1:P2。

图3 系统发育树(P1 和P2)
3 结论与讨论
本研究利用平板涂布法从自然发酵的葡萄皮中分离得到8 株酵母菌株。其中两个菌株(P1、P2)分别对蔗糖和乳糖具有良好的耐受性,且生长速度良好。通过形态观察和分子生物学鉴定确定了这两株菌株可分属于2 个种:近玫色锁掷孢酵母(Sporidiobolus pararoseus);金黄蝶形担孢酵母(Papiliotrema flavescens)。近年来,对葡萄酒发酵体系中非酿酒酵母的探究已充分证明其对香气物质富集与酒品整体风味呈现的影响力[27],并由此在葡萄酒酿造中引入了多菌种发酵(非酿酒酵母与酿酒酵母混菌或顺序发酵)新工艺,显示出非酿酒酵母在葡萄酒(果酒)酿造中的独特价值[28]。
在酒精代谢活动开始前,葡萄汁中非酿酒酵母都能够快速增殖并且在控制条件下的生长代谢,有助于改善葡萄酒的结构与风味复杂性[29],这种发酵方式在一定程度上通过了不同种类发酵菌种间的协同作用,从而表现出不同的发酵效果,体现了非酿酒酵母在发酵葡萄酒中的潜在应用价值,也为呈香物质的优化提供了有力借鉴[30]。目前,相关研究较多集中于使用酿酒酵母,发酵葡萄酒中的非酿酒酵母菌群的可控制混合发酵效果探讨领域,本研究对丰富自然发酵体系中非酿酒酵母的认识,进一步挖掘非酿酒酵母的价值具有一定意义。
