保健食品中西地那非化学发光免疫分析方法研究
2021-11-03张咏仪杨金易徐振林雷红涛孙远明沈玉栋
程 智,张咏仪,杨金易,徐振林,王 弘,雷红涛,孙远明,沈玉栋
(华南农业大学 食品学院 广东省食品质量安全重点实验室,广东 广州 510642)
西地那非(Sildenafil,SD)是美国食品药品管理局(FDA)于1998年批准用于治疗性功能障碍的一种5型磷酸二酯酶(Phosphodiesterase 5,PDE5)抑制剂[1],是已批准的3个壮阳药之一,其副作用主要有头痛、背痛以及视力听力障碍,与硝酸酯类药物同时服用时会显著降低血压导致意识丧失甚至死亡等[2]。因此,2012 年3 月中国国家食品药品监督管理总局发布的“食药监办保化[2012]33 号”文件中明确禁止在保健食品中添加西地那非。然而,部分保健食品企业为了加强产品功效,在经济利益驱使下,向产品中非法添加那非类药物,其中以西地那非违禁添加问题最为突出,如上海食品药品检验所2016~2018年检出的458批次非法添加化学药物的食品中,西地那非检出428批次[3],河北省药品检验研究院于2017 年检出的12 批次非法添加化学药物的酒类产品中,西地那非检出8 批次[4],深圳市计量质量检测研究院2018 年检出的15 批次非法添加药物的功能酒中,西地那非阳性8 批次[5]。因此,建立保健食品中西地那非药物灵敏准确的检测方法,对食品安全监管具有重要实际意义。
目前,针对保健食品中那非类药物的检测方法主要是基于色谱-质谱联用技术的大型仪器确证分析方法[6-12],该类方法具有准确、灵敏等特点,但也存在仪器昂贵,前处理复杂,检测成本高等问题,因而难以在基层普及。免疫分析方法[13-18]具有特异性强、灵敏度高、成本低、快速等优点,是仪器分析方法的互补方法。近年来,关于西地那非残留的免疫分析方法陆续有少量报道,如间接竞争酶联免疫吸附分析(Indirect competitive enzyme-linked immunosorbent assay,icELISA)[13-16]和免疫层析分析(Immunochromatography assay,ICA)[17-18],样品检测灵敏度约在5~80 μg/mL 之间,不能满足保健食品中禁用药物西地那非的测定需求。因此,开发更为灵敏可靠的技术方法,对有效监测保健食品中非法添加西地那非的食品安全问题,保障人体健康具有重要意义。
直接竞争化学发光酶免疫分析(Direct competitive chemiluminescence enzyme immunoassay,dcCLEIA)方法是以酶联免疫吸附分析原理为基础发展起来的新一代超灵敏免疫分析技术[19-20]。该方法以鲁米诺等发光底物作为信号输出探针,在辣根过氧化物酶(HRP)催化下,使过氧化氢释放出活性氧,从而将底物鲁米诺氧化为激发态,最后激发态跃迁回基态实现发光。dcCLEIA 具有化学发光信号灵敏度高,可有效规避基质背景干扰,检测结果稳定等突出优势[21-22];同时,采用基于酶标抗体的直接竞争模式,减少了酶标二抗的反应步骤,简化了检测过程,节省了检测时间,提高了检测效率。因此,本研究利用前期获得的抗体制备酶标抗体,开展了保健食品中西地那非超灵敏检测的dcCLEIA 方法研究,以期为保健食品安全监管提供技术支持。
1 实验部分
1.1 仪器与试剂
UV-160A 紫外-可见扫描仪(日本Kyoto 公司);MK3 多功能酶标仪(美国Thermo 公司);DEM-3自动洗板机(北京拓普分析仪器有限责任公司);MS3 旋涡混合器(i国IKA 公司);96 孔不透明白色发光板(厦门市云鹏科技发展有限公司);AB SCIEX 5500 三重四极杆质谱仪(美国AB SCIEX 公司)。
西地那非、瓦地那非(Vardenafil)、米罗那非(Mironafil)、他达那非(Tadalafil)、红地那非(Acetildenafil)等药物购自Alfa Aesar 公司;西地那非多克隆抗体和包被原(SDBA-OVA)由本实验室[14]自制;鲁米诺化学发光底物液(A 液:4 mg 鲁米诺钠盐(Luminol-Na)溶于20 mL 水中)和底物缓冲液(B液:2 mg 对碘酚溶于100 μL 二甲基亚砜中,加入4 μL 3%的双氧水);包被缓冲液(pH 9.6,0.1 mol/L碳酸盐缓冲液)、封闭液(0.2 g/L KCl,0.2 g/L KH2PO4,2.9 g/L Na2HPO4·12H2O,8.5 g/L NaCl,0.05%Tween-20,5%脱脂奶粉)、洗涤液(2.9 g/L Na2HPO4·12H2O,8.5 g/L NaCl,0.05%Tween-20)、稀释液(磷酸盐吐温溶液,PBST,5%甲醇,0.1% Tween-20,0.01 mol/L pH 7.4 磷酸盐溶液)、终止液(10%H2SO4溶液)等溶液均为实验室自配[14,23];其它试剂为国产分析纯。
1.2 实验方法
1.2.1 辣根过氧化物酶标记抗体(HRP-Ab)的制备与评价 采用过碘酸钠法[24]对西地那非兔多克隆抗体进行辣根过氧化物酶(HRP)标记制备酶标抗体HRP-Ab。然后,将酶标抗体稀释成系列浓度,在1 μg/mL包被原浓度下,采用酶联免疫吸附分析(ELISA)法测定不同浓度的抗体与包被抗原反应的A450nm值(450 nm可见光波长下的吸光度值),将读数为1.0左右对应的酶标抗体稀释倍数定义为效价。同时,加入500 ng/mL 西地那非标准品与抗体发生竞争反应,读取A450nm值,并计算抑制率(Inhibition rate,IR),计算公式为:IR(%)=(1-B/B0)×100%,其中,B0为未添加药物的微孔吸光值,B为添加药物的微孔吸光值。
1.2.2 dcCLEIA实验步骤 将包被原用包被液稀释至适当浓度,以每孔100 μL加入到化学发光板中,37 ℃下孵育过夜。洗涤液洗板2 次后,拍干备用。每孔加入120 μL 封闭液,37 ℃下封闭3 h 后甩干孔内液体,置于37 ℃烘箱内烘干备用。用磷酸盐缓冲液将西地那非标准品稀释成0、0.000 2、0.002、0.02、2、20、200 ng/mL,酶标抗体稀释至0.5 mg/mL。每孔分别加入不同浓度的药物与酶标抗体各50 μL,振荡混匀,37 ℃下孵育40 min,洗板5次后拍干;加入100 μL 等体积混合的化学发光A 液和B液,振荡混匀后,用化学发光仪读取相对发光强度(Relative light units,RLU)。
1.2.3 dcCLEIA 方法的建立 参照文献[23]步骤,对包被原浓度、抗体稀释倍数、封闭液和洗涤液的吐温含量、稀释液PBST 的甲醇添加量以及竞争反应时间进行考察。按照“1.2.2”步骤操作,以西地那非浓度负对数为横坐标,RLU 值为纵坐标,绘制标准曲线,通过比较最大化学发光值RLUMAX、IC50、RLUMAX/IC50选择最佳工作条件。确定最佳工作条件后以RLU 值为纵坐标,标准品浓度负对数值为横坐标,采用四参数拟合绘制标准曲线,并计算西地那非的检出限(LOD,IC10)、半抑制浓度(IC50)和线性范围(IC20~IC80)。
1.2.4 方法特异性 采用交叉反应率(Cross-reactivity,CR)评价方法的特异性,根据“1.2.3”方法拟合获得西地那非药物及其类似物的IC50,计算CR,计算公式如下:
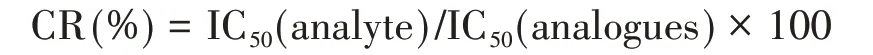
1.2.5 样品前处理方法 ①口服液类:准确吸取1 mL 样品置于50 mL 离心管中,加入10 mL 二氯甲烷,振荡5 min 后超声10 min,4 000 r/min 离心5 min 后取上清液,旋蒸后用1 mL 甲醇复溶并稀释10倍,备用。②胶囊、片剂类:准确称取研细的样品1 g于50 mL离心管中,加入5 mL pH 5.0~6.0的盐酸水溶液,振荡5 min后超声10 min,4 000 r/min离心5 min后取上清液,调至pH 9.0,加入10 mL二氯甲烷萃取,振荡5 min后超声10 min,4 000 r/min离心5 min,反复萃取3次,合并有机层,旋蒸后用1 mL甲醇复溶并稀释20倍,备用。
1.2.6 加标回收与仪器验证 根据所建立dcCLEIA 方法的检测范围,在经过前处理的阴性样品中加入低、中、高3 个浓度水平的西地那非标准品后用dcCLEIA 方法测定,计算出各样品的加标回收率以及相对标准偏差(Relative standard deviation,RSD)。同时,利用dcCLEIA 与HPLC-MS/MS 标准确证法(SN/T 4054-2014)[25]对随机盲样进行比对检测,评价方法可靠性。
2 结果与讨论
2.1 酶标抗体性质的鉴定
将“1.2.1”制得的5 mg/mL 酶标抗体稀释10 倍至0.5 mg/mL 后,测定并计算酶标抗体HRP-Ab 的效价及抑制率。结果显示在500 ng/mL的西地那非药物质量浓度下抑制率达到90%以上,此时效价为1∶400(图1),考虑初始的10倍稀释,其原始酶标抗体效价应为1∶4 000,说明抗体酶标后保持了良好的分析性能。
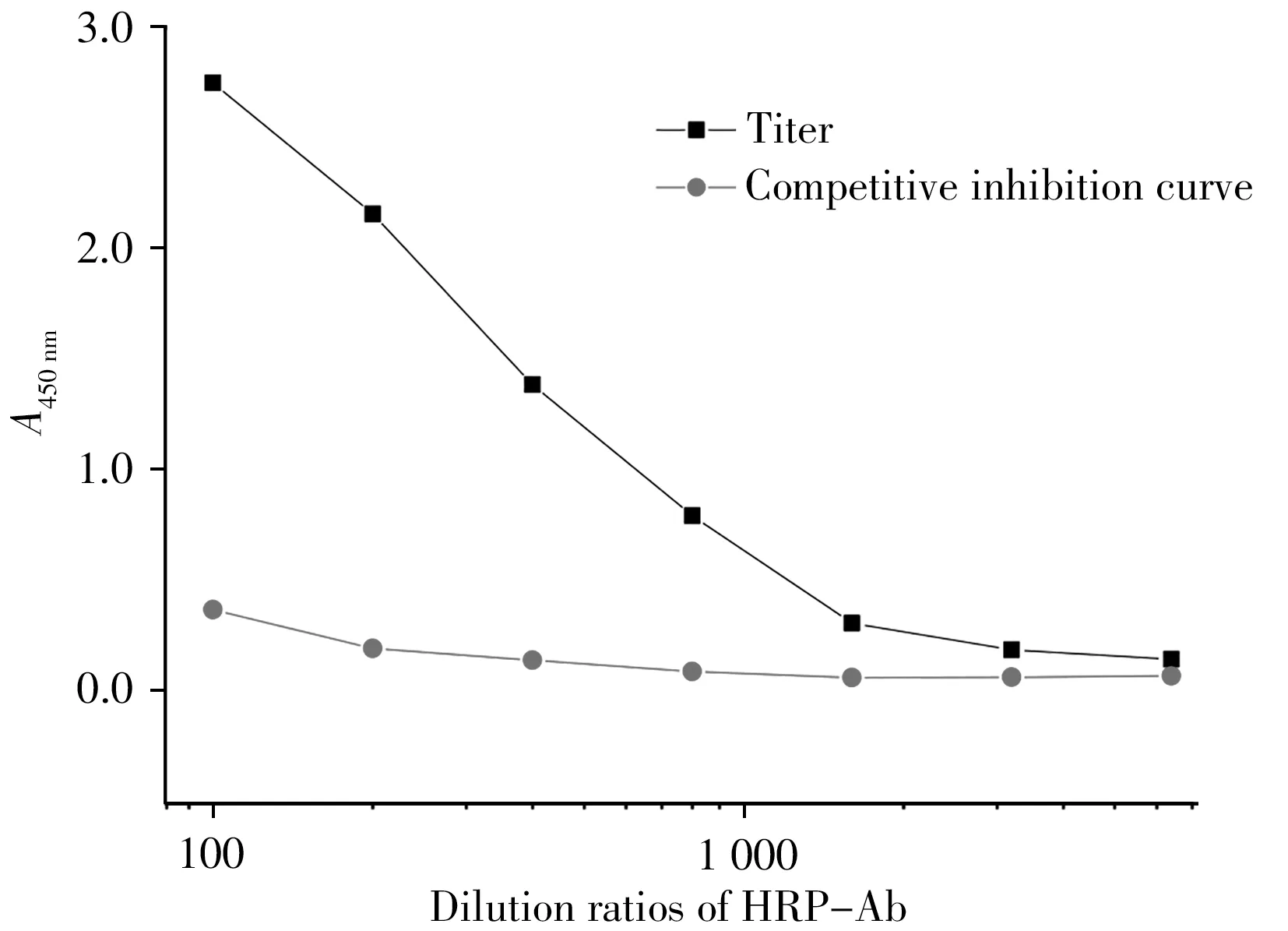
图1 HRP-Ab的效价抑制曲线Fig.1 Titer and inhibition curve of HRP-Ab
2.2 dcCLEIA工作条件的优化
对影响dcCLEIA 的实验参数进行了优化,以RLUMAX/IC50值作为评价标准,比值越大,说明灵敏度越高,重复性越好[24]。对包被原浓度、抗体稀释倍数、封闭液和洗涤液的吐温-20 含量、稀释液PBST 甲醇添加量以及竞争反应时间等条件进行优化。最终选择RLUMAX/IC50较高、RLUMAX适中、IC50较低的条件作为最佳工作条件。结果表明,最佳工作条件为:包被原质量浓度为41.67 ng/mL,酶标抗体质量浓度为1.25 μg/mL,封闭液和洗涤液吐温-20 含量为0.05%,稀释液甲醇添加量为5%,竞争反应时间为40 min。
2.3 标准曲线的建立
根据确定的优化条件,以RLU 值为纵坐标,西地那非标准品浓度的负对数为横坐标,绘制方法的标准曲线,并采用四参数拟合得到西地那非检测的IC50为0.17 ng/mL,线性检测范围(IC20~IC80)为0.024~1.21 ng/mL,检出限IC10为0.008 ng/mL,达到了pg/mL 水平,相比报道的ELISA 与ICA 方法[13-18],灵敏度显著提高。另外,由于采用直接竞争法,减少了酶标二抗捕获一抗步骤(一般需要30 min以上),将检测时间缩短至40 min,较ELISA 检测方法缩短了20 min以上,节省了时间,提高了检测效率(表1)。
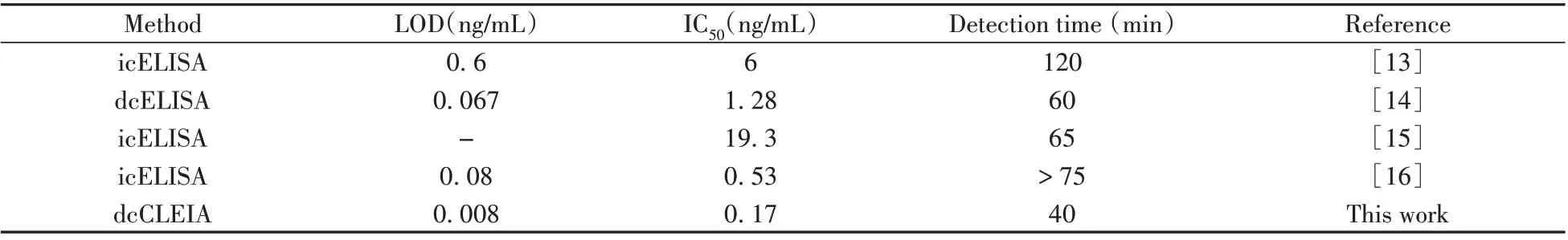
表1 已报道的西地那非ELISA检测方法与本方法的比较Table 1 Comparison between the proposed dcCLEIA and other ELISA methods for detection of sildenafil
2.4 方法特异性
选择主要的结构或功能类似物,利用dcCLEIA测定交叉反应率。以西地那非作为参照(交叉反应率100%),结果显示(表2),该方法对主要结构功能类似物瓦地那非以及米罗那非的交叉反应率分别为48.5%与62.5%,与他达那非和红地那非类药物无明显交叉反应(CR <0.1%)。瓦地那非、米罗那非与西地那非的结构类似度较高,说明抗体主要识别其共有结构部分,因而此方法可用于这3 类结构药物的半定量检测。
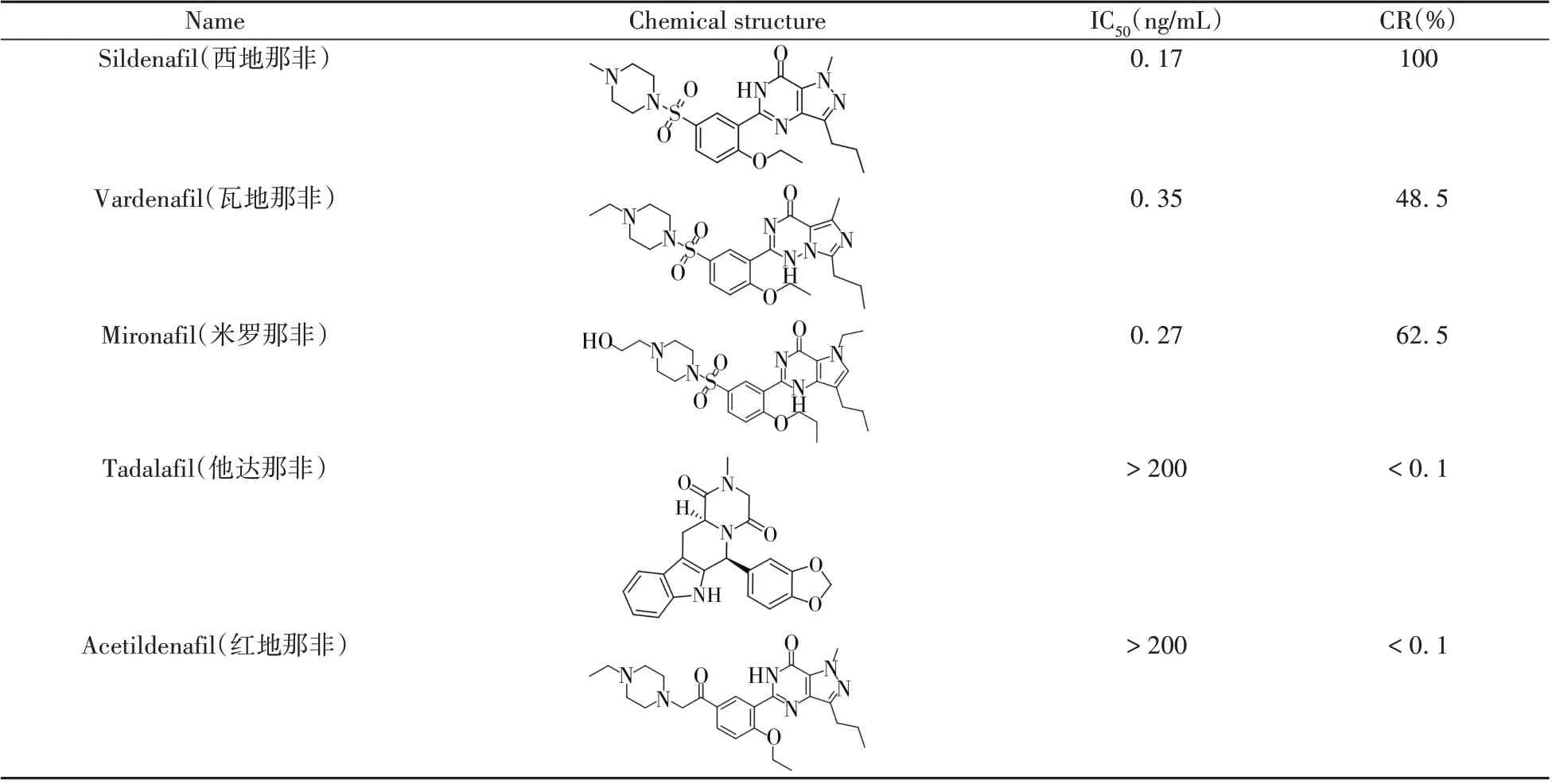
表2 西地那非结构功能类似物的交叉反应率Table 2 Cross-reactivity of sildenafil analogues by dcCLEIA
2.5 基质效应的消除
样品经“1.2.5”前处理后用PBST 稀释适当倍数,以西地那非为标准品进行dcCLEIA 测定并绘制标准曲线,考察基质效应消除情况。结果表明(图2):口服液基质以PBST稀释10倍,胶囊和片剂基质以PBST稀释20倍后,抑制曲线与西地那非标准曲线均能基本重合,表明样品基质效应基本消除。

图2 实际样品基质效应的消除Fig.2 Elimination of matrix effect in real samples
2.6 实际样品分析
根据所建方法的灵敏度和线性范围,向口服液、片剂、胶囊3种阴性样品中添加低、中、高3个浓度水平的西地那非药物,采用建立的dcCLEIA 方法进行检测,计算回收率与相对标准偏差(表3)。结果表明:西地那非样品的加标回收率为82.0%~114%,RSD 均小于15%。同时采用dcCLEIA 方法与HPLC-MS/MS 方法对随机盲样进行检测,两种方法的检测结果具有良好一致性(表4),相关系数(r2)为0.991。说明该方法准确性良好,可满足实际样品检测需求。
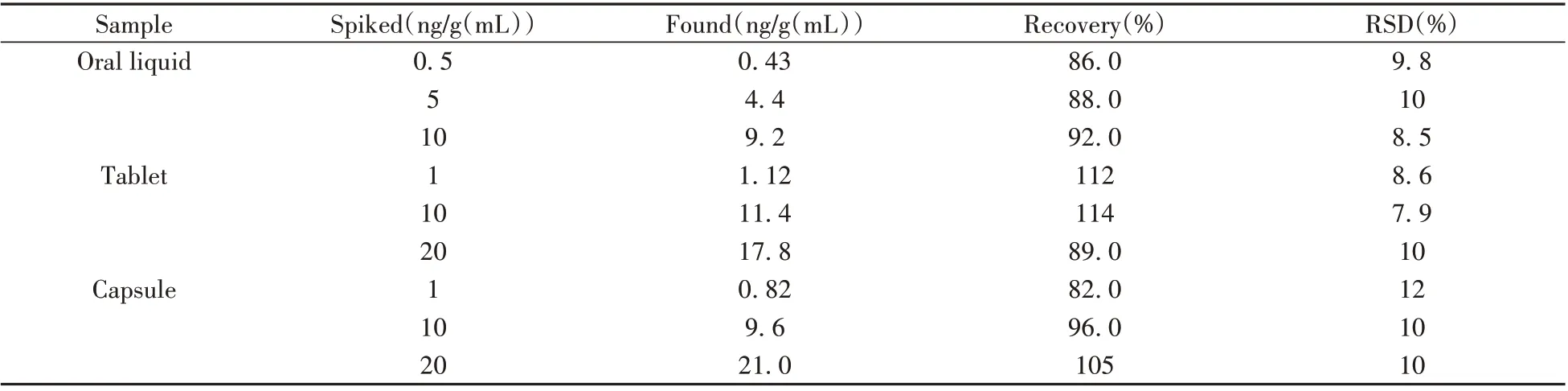
表3 实际样品中西地那非的加标回收实验结果(n=3)Table 3 Recoveries of sildenafil in spiked samples by dcCLEIA(n=3)
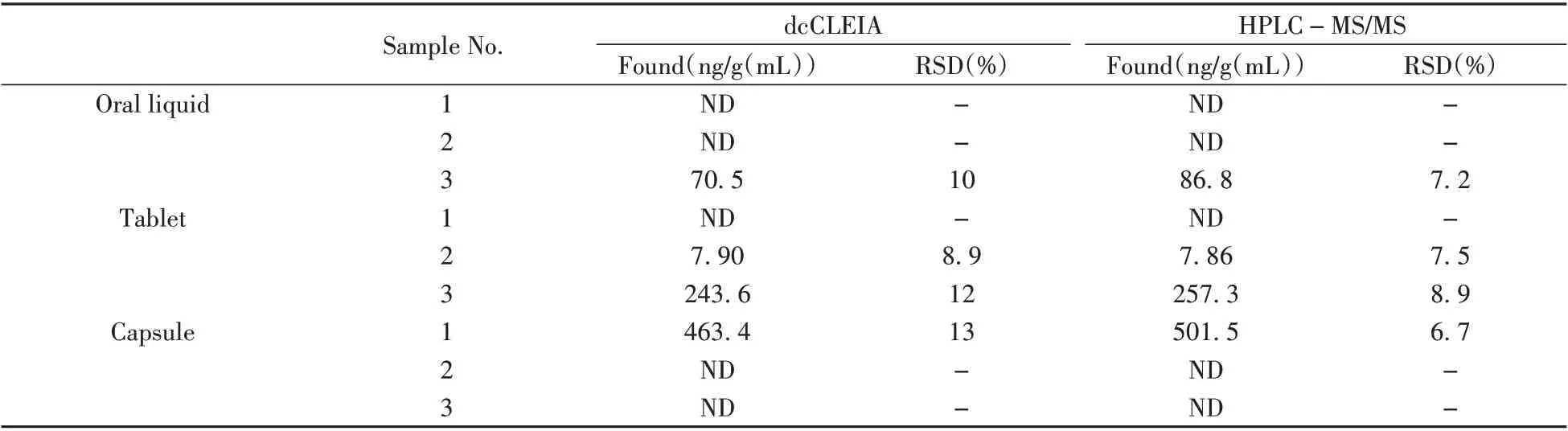
表4 随机盲样中西地那非的测定(n=3)Table 4 Determination of sildenafil in random blind samples by dcCLEIA and HPLC-MS/MS(n=3)
3 结 论
本研究建立了保健食品中西地那非的dcCLEIA 检测方法,方法检出限达pg/mL 级,与他达那非和红地那非等类似物无交叉反应。实际样品的加标回收率为82.0%~114%,RSD 均小于15%。盲样检测结果与HPLC-MS/MS方法相关性良好,检测时间为40 min,可用于实际样品的快速检测。
